北柴胡挥发油的GC-MS分析及其多组分测定
马媛媛,华 伟
(1.复旦大学附属中山医院药物临床试验机构,上海 200032;2.山东华信制药集团股份有限公司,山东菏泽 274009)
柴胡为伞形科柴胡属植物部分种类的根或全草,《中国药典》2000年版收载了北柴胡和南柴胡(狭叶柴胡)两个种。柴胡药材中主要成分有柴胡皂苷、植物甾醇、侧金盏花醇、挥发油、多糖、黄酮类、木脂素类、香豆素类等成分[1]。主要有解热[2]、镇痛[3]、抗炎[4]、降血脂[5]和抗病毒等药理作用,秦汉时期,柴胡已经开始应用于临床,在马王堆汉幕帛书《五十二病方》中,就有单味柴胡煎服治疗头痛的记载[6-7]。
柴胡注射液为部颁标准《中药成方制剂》第十七册收载的品种。是由柴胡的干燥根,经水蒸气蒸馏制成的灭菌水溶液[8],主要为水饱和的挥发油。柴胡注射液是治疗上呼吸道感染、风寒感冒和发热的常用药物[9]。部颁标准中柴胡注射液无定量测定项。而一般的性状鉴别和理化鉴别只能从中药及其制剂的外观和个别活性成分进行质量控制,再加上其化学成分复杂,有效成分含有量相差悬殊,造成了柴胡及其制剂质量不稳定[10]。对柴胡质量控制方法的研究报道很多,但定量分析指标只局限在柴胡皂苷[11]等个别成分上,无法对中药材及其制剂进行全面而准确的质量控制。本课题首先通过GC-MS确定了北柴胡药材和注射液中的5种成分,通过对其中的2种成分,即正己醛和正庚醛成分的控制,建立了北柴胡药材以及北柴胡注射液的成分含有量限值测定方法。
1 仪器和试药
GCT型气相色谱-高分辨质谱联用仪(美国Waters公司);NIST05标准质谱库;GC8100气相色谱仪,配有氢火焰检测器(FID)(山东经纬分析仪器有限公司),Unmicro色谱工作站(上海微通分析技术有限公司),KDM型调温电热套(佳祥电器),挥发油提取器(沈阳禹王化玻仪器有限公司)。
北柴胡(参照《中国药典》,对其进行薄层色谱鉴定[12],与对照品一致)10批(安徽海鑫中药饮片有限公司,产地为蒙古,批号为 090101、090102、 090103、 090104、 090105、 090106、090107、090108、090109、090110),北柴胡注射液10批(山东华信制药集团股份有限公司,规格2mL/支,批号为090101、090102、090103、090104、 090105、 090106、 090107、 090108、090109、090110),1-辛烯(国药集团化学试剂有限公司)、正己醛、正庚醛(天津光复试剂公司)均为色谱纯,正己烷、无水硫酸钠为分析纯。
2 方法和结果
2.1 GC-MS条件及供试品溶液制备
2.1.1 GC-MS条件 DB-35MS(30 m×0.25 mm×0.25μm)毛细管柱;载气为高纯氦(纯度≥99.999%);体积流量1 mL/min;分流比10∶1;进样口温度230℃;升温程序为初始温度60℃,保持3 min,以15℃/min的升温速率升温至250℃,保持3 min;EI电子源70 Ev,氦气恒流模式1 mL/min,分流比50∶1,TOF质量分析器。
2.1.2 供试品溶液的制备 取北柴胡20 g,于500 mL蒸馏瓶中,加水100 mL,在挥发油提取器中加水5 mL,加热,以10滴/min的体积流量回流2 h,冷却,取上层提取液用己烷定容至100 mL,加入无水硫酸钠适量除水,即得。
2.2 GC条件及溶液制备
2.2.1 GC条件 二甲基硅氧烷共聚物的毛细管柱(30 m×0.25 mm,0.25μm);FID检测器,检测器温度为280℃;载气为氮气,体积流量为1 mL/min,分流比为10∶1,进样口温度为280℃。升温程序:初始温度40℃,保持5 min,以10℃/min的升温速率升温至120℃,保持2 min。理论板数按1-辛烯峰计算应不低于50000。
2.2.2 内标物溶液的制备 取1-辛烯,加己烷稀释成2 mg/mL的溶液,即得。
2.2.3 对照品溶液的制备 取对照品正己醛、正庚醛,加己烷稀释成各含2 mg/mL的混合溶液,即得。
2.2.4 供试品溶液的制备 分别精密称定北柴胡20 g和精密量取北柴胡注射液40 mL,于500 mL蒸馏瓶中,加水100 mL,在挥发油提取器中加水5 mL和内标物溶液1 mL,加热,以10滴/min的体积流量回流2 h,冷却,取上层提取液适量,并用己烷定容至1 mL,加入无水硫酸钠适量除水,即得北柴胡药材和注射液供试品溶液。
2.3 方法学考察
2.3.1 精密度试验 取对照品正己醛、正庚醛及1-辛烯,加己烷稀释成各含1.6 mg/mL(80%的对照品浓度)、2 mg/mL(100%对照品浓度)、2.4 mg/mL(120%的对照品浓度),再加入适量1-辛烯,配成分别含1-辛烯2 mg/mL和3种不同质量浓度对照品的混合溶液,分别进样2次,计算平均校正因子。其相对标准偏差不大于1.85%。
2.3.2 重复性试验 取北柴胡按定量测定项供试品溶液的制备方法制备5份,各取1μL注入气相色谱仪,记录色谱图。计算正己醛、正庚醛相对峰面积的相对标准偏差,均不大于1.19%。结果表明,该方法的重复性符合方法学要求。
2.3.3 稳定性试验 取北柴胡挥发油供试品溶液1μL,分别于0、2、4、6、8 h注入气相色谱仪,计算正己醛、正庚醛相对峰面积的相对标准偏差,均不大于1.61%。结果表明供试品溶液8 h内的稳定性良好。
2.3.4 线性关系试验 取正己醛、正庚醛对照品适量,精密称定,加己烷制成分别含正己醛、正庚醛0.02、0.2、2、10、20 mg/mL 5个不同质量浓度的1-辛烯(含2 mg/mL)混合溶液。以质量浓度(mg/mL)为横坐标,相对峰面积为纵坐标,分别对正己醛和正庚醛进行线性回归,得到正己醛线性回归方程为 Y=0.3264 X+0.0519,r=0.9998。正庚醛线性回归方程为 Y=0.4177X+0.0028,r=0.9996。结果表明:正己醛、正庚醛在0.02~20 mg/mL范围内与气相色谱峰响应值线性关系良好,适宜用内标法进行测定计算。
2.3.5 加样回收率 取已测定含有量的北柴胡药材批号09010110 g,分别加入等量的正己醛、正庚醛对照品,然后按上述样品制备方法制备6份。分别进样1μL,记录色谱图,按内标法计算。6份样品回收率相对标准偏差均不大于1.60%。结果如表1所示。
3 结果
3.1 GC-MS分析结果 把北柴胡挥发油的供试品溶液用气-质联用仪,得到总离子流图,结果见图1,并结合NIST05标准库,与标准图谱核对,做定性分析,结果如表2所示。
根据GC-MS分析结果,我们确定了北柴胡挥发油中的5种化学成分,并最终确定了正己醛和正庚醛为共有组分,并进行定量分析。根据10批气相指纹图谱的叠加图,得到北柴胡药材及其注射液的对照图谱,如图2、图3所示。
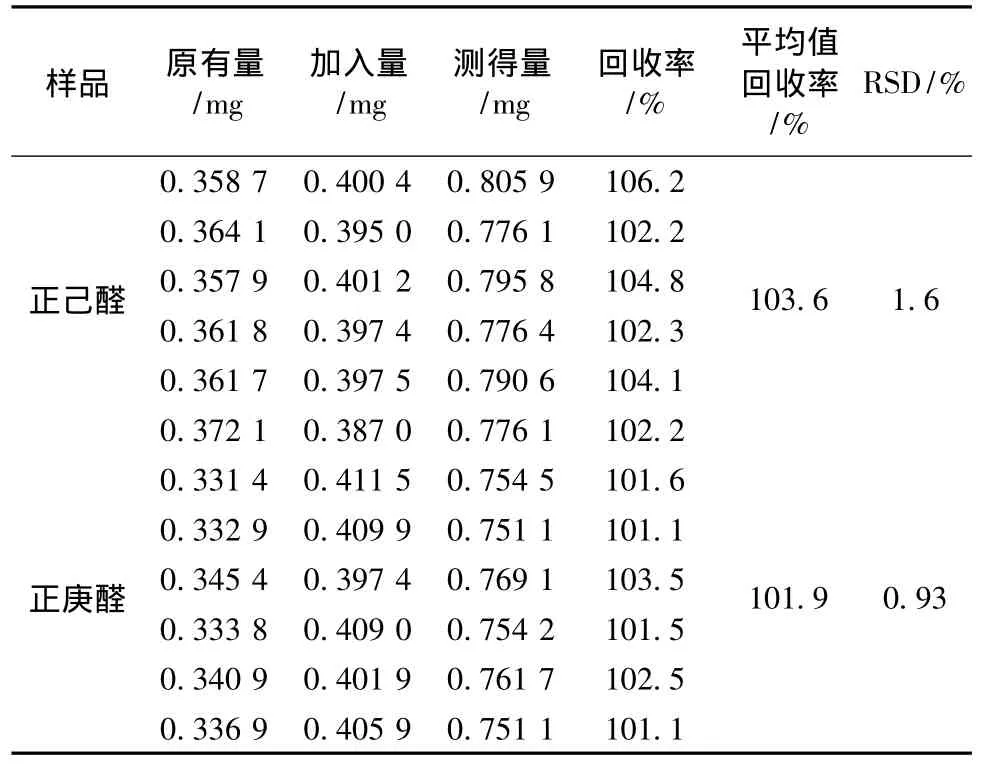
表1 正己醛和正庚醛回收率试验Tab.1 Results of recovery tests for hexyl aldehyde and heptaldehyde
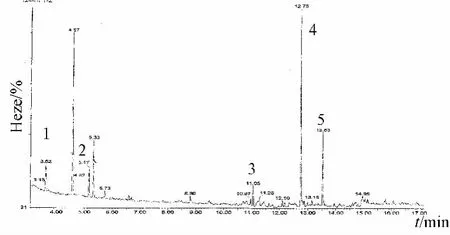
图1 北柴胡供试品溶液的GC-MS色谱图Fig.1 GC-MS chromatogram of Bupleuri Radix

表2 北柴胡挥发油的GC-MS分析结果Tab.2 GC-MS analysisresultofvolatileoilfrom Bupleuri Radix
3.2 北柴胡药材及其注射液含有量限值的确定
3.2.1 北柴胡药材成分含有量限值的确定 取北柴胡10批,按上述方法检测,结果如表3所示。结果表明,10批北柴胡按干品计含正己醛在0.030~0.047 mg/g之间;含正庚醛在 0.026~0.065 mg/g之间。所以取下限为含有量限值,即“按干品计,含正己醛每1 g不少于0.03 mg;含正庚醛每1 g不少于0.026 mg”。
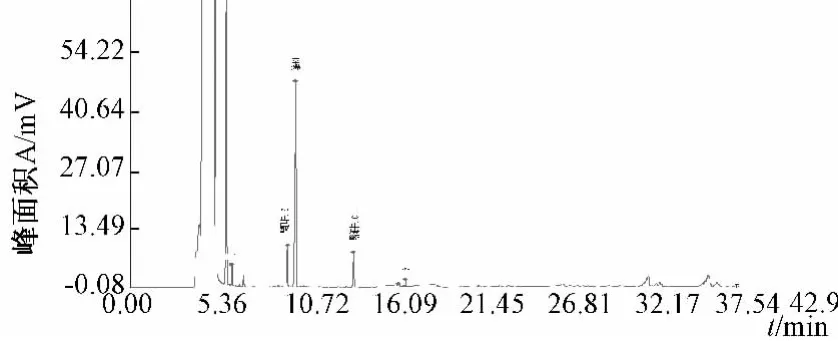
图3 北柴胡注射液成分对照指纹图谱Fig.3 Standard fingerprint spectrum(FPS)of Bupleuri Radix Injection
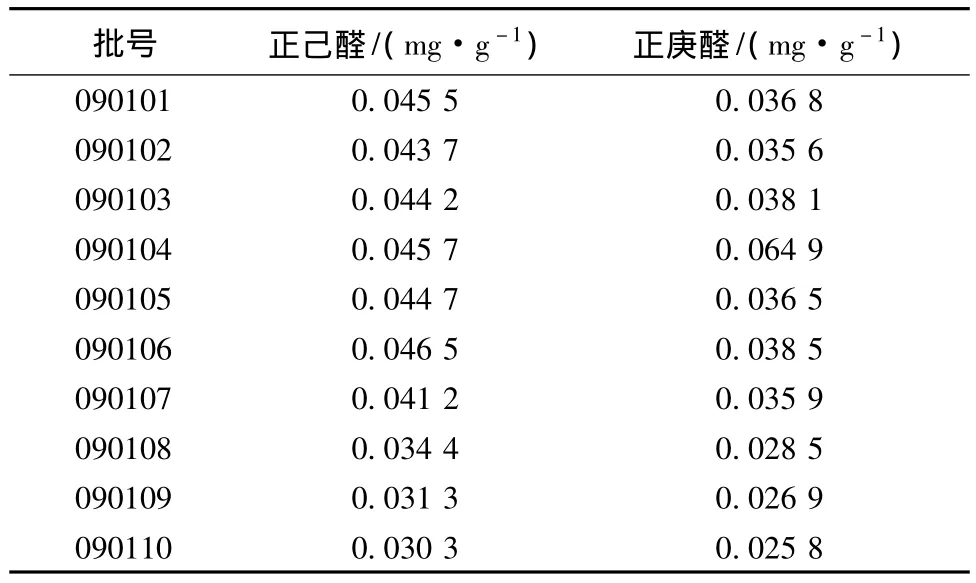
表3 10批北柴胡药材的测定结果Tab.3 Determination results of 10 batches of Bupleuri Radix
3.2.2 北柴胡注射液成分含有量限值的确定 取北柴胡注射液检测,测定结果如表4所示。结果表明,10批柴胡注射液含正己醛在0.0071~0.0092 mg/mL之间;含正庚醛在 0.0054~0.0077 mg/mL之间。所以取下限为含有量限值,即每1 mL含正己醛不少于 7.1μg,含正庚醛不少于5.4μg。
4 讨论
4.1 共有成分的确定 通过GC-MS成分分析结果可以看出,由于正己醛和正庚醛的相对保留时间比较固定,后三种物质的相对位置不固定,不易辨认,且峰面积较小,定量上存在困难,因此,最终确定正己醛和正庚醛进行含有量限度测定。
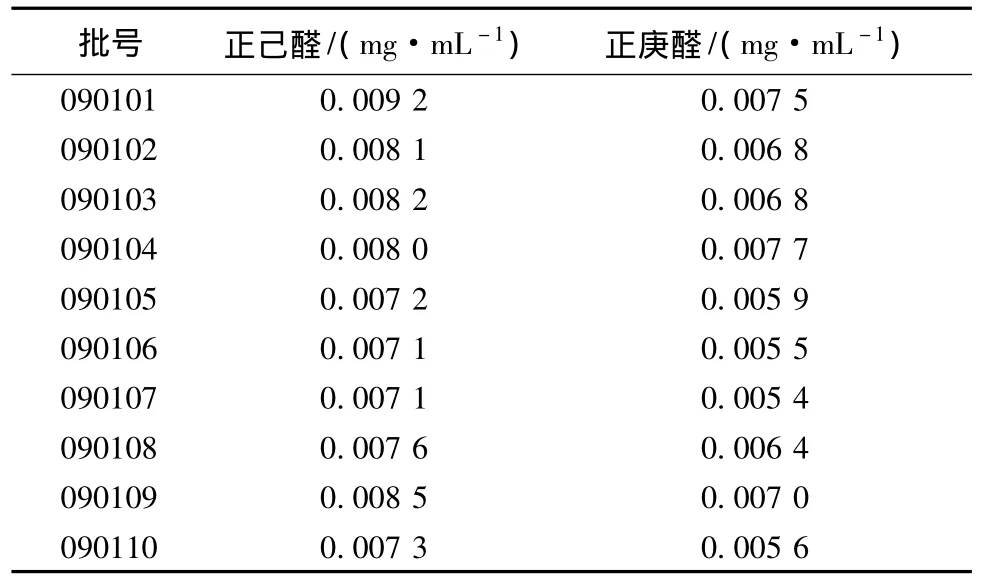
表4 10批北柴胡注射液的测定结果Tab.4 Determination results of 10 batches of Bupleuri Radix Injection
4.2 挥发油提取时间的确定 取同一批北柴胡药材(090101),分别按提取时间为0.5、1、2、3、4 h制备挥发油供试品溶液,按测定项计算,结果如表5所示。结果表明,2 h为最佳提取时间。

表5 正庚醛、正己醛提取时间考察结果Tab.5 Extraction time of the determination of hexyl aldehyde and heptaldehyde

图4 10批北柴胡药材指纹图谱叠加图和对照图谱RFig.4 GC-FPS of 10 batches of Bupleuri Radix and reference fingerprint R
4.3 柴胡挥发油气相指纹图谱 指纹图谱[13]系指中药材或其制剂经适当处理后,采用一定的分析手段,得到的能够标示该药材或其制剂特性的共有峰的图谱,以便识别真伪、辨认优劣,确定其质量和有效性。指纹图谱相似度的评价方法主要有峰重叠率(Nei系数法)、相关系数法、距离系数法、向量夹角余弦法、和峰重叠率与共有峰强度结合法等方法[14-15]。本实验采用的国家药典委员会的“中药指纹图谱相似度评价系统”软件对10批北柴胡药材进行相似度评价[16],其原理是向量夹角余弦法,结果如图4所示,表明,10批北柴胡药材指纹图谱的相似度良好,为后续实验数据的准确性提供保证。
[1]杨 柳,王雪莹,刘 畅,等.北柴胡化学成分与药理作用的研究进展[J].中医药信息,2012,29(3):143-145.
[2]张青叶,胡 聪,从月珠.三岛柴胡与北柴胡解热作用比较[J].中药材,1997,20(3):147-149.
[3]柴田丸.柴胡的药理学研究[J].药学杂志,1973,93(12):1660-1663.
[4]刘 伟.柴胡不同炮制方法对其抗炎作用的影响[J].河南中医药学刊,1998,13(4):10.
[5]梁 云,崔若兰.柴胡皂苷d治疗抗肾小球基膜型肾炎的实验研究[J].第二军医大学学报,1999,20(7):416-417.
[6]黄 煌.柴胡[J].中国社区医师,2002,18(12):28.
[7]李向中.关于柴胡药理研究的探讨[J].中药通报,1983,8(2):39.
[8]国家食品药品监督管理局.WS-10973(ZD-0973)-2002丹参注射液质量标准[S].
[9]沈慧娜.柴胡注射液的临床研究应用概况[J].海峡药学,2012,24(2):150-153.
[10]潘胜利.中药柴胡的药源调查及商品鉴定[J].中药材,1996,19(5):231.
[11]张相年,张相波.柴胡皂苷的生理活性及在治疗肾病中的应用[J].广东医学学报,2000,16:121-123.
[12]林明美,罗 燕.柴胡的薄层指纹图谱分析[J].药物分析,1987,7(1):13-14.
[13]谢培山.中药指纹图谱在新药开发中的作用[J].中国中西医结合杂志,2002,22(9):644-645.
[14]聂 磊,曹 进,罗国安.中药指纹图谱相似度评价方法的比较[J].中成药,2005,27(3):249-252.
[15]程翼宇,陈闽军,吴永江.化学指纹图谱的相似性测度及其评价方法[J].化学学报,2002,60(11):2017-2021.
[16]王启帅,杨 云,肖功胜,等.北柴胡HPLC-ELSD指纹图谱的建立及色谱数据的分析[J].中成药,2011,33(3):373-378.

