柠檬催化转化原人参二醇组皂苷制备人参皂苷Rg5的初步研究
孙成鹏,高维平,赵宝中,成乐琴*
(1.东北师范大学化学学院,吉林 长春 130024;2.吉林化工学院化学与制药工程学院,吉林 吉林 132022)
人参Panax ginseng C.A.Meyer属五加科草本植物,我国重要名贵药材,其应用有超过4000年的历史[1]。人参皂苷是人参的主要活性成分之一,现代药理研究表明,人参皂苷具有抗衰老、抗肿瘤、抗自由基、保护神经和保护心血管等作用[2-9]。
人参皂苷Rg5最初从红参中分离得到[10],属次级人参皂苷,是原人参二醇组皂苷(PPD)的代谢产物。人参皂苷Rg5具有抗接触性皮炎[11]、抗肿瘤[12]、抑制环氧合酶-2[13]和改善肺部炎症[14]等作用,特别在改善记忆力方面,其药效远优于人参皂苷 20(S)-Rg3 和 20(R)-Rg3[15]。由于人参皂苷Rg5的制备和分离难度较大[16],在其制备过程中,生成副产物较多,如人参皂苷Rk1和Rz1,同时其分离仅可以通过制备型高效液相色谱和高速逆流来实现,故有关人参皂苷Rg5的制备及其药理研究报道较少,目前,仅有炮制人参和专利[17]两种方法,但上述方法产率很低,因此有必要开发人参皂苷Rg5的制备方法。
本实验选用生物质材料柠檬为催化剂,PPD皂苷为原料,低成本环境友好地制备高附加稀有人参皂苷Rg5(图1),结合硅胶柱层析和半制备型高效液相色谱分离人参皂苷 Rg5和 Rk1,并通过HPLC、1H-NMR和13C-NMR进行定量分析和结构鉴定。
1 材料
人参皂苷对照品 Rb1、Rb2、Rb3、Rc、Rd、20(S)-Rg3和20(R)-Rg3购自成都曼斯特公司;PPD皂苷自制(纯度为98.51%,其中人参皂苷Rb1、Rc、Rb2、Rb3和 Rd的含有量分别为48.60%、19.11%、16.95%、4.72%和9.13%);人参皂苷对照品Rg5为自制(根据峰面积归一化法测得其纯度为99.33%);蒸馏水自制,乙醇、丙酮为分析纯,乙腈和甲醇为色谱纯。
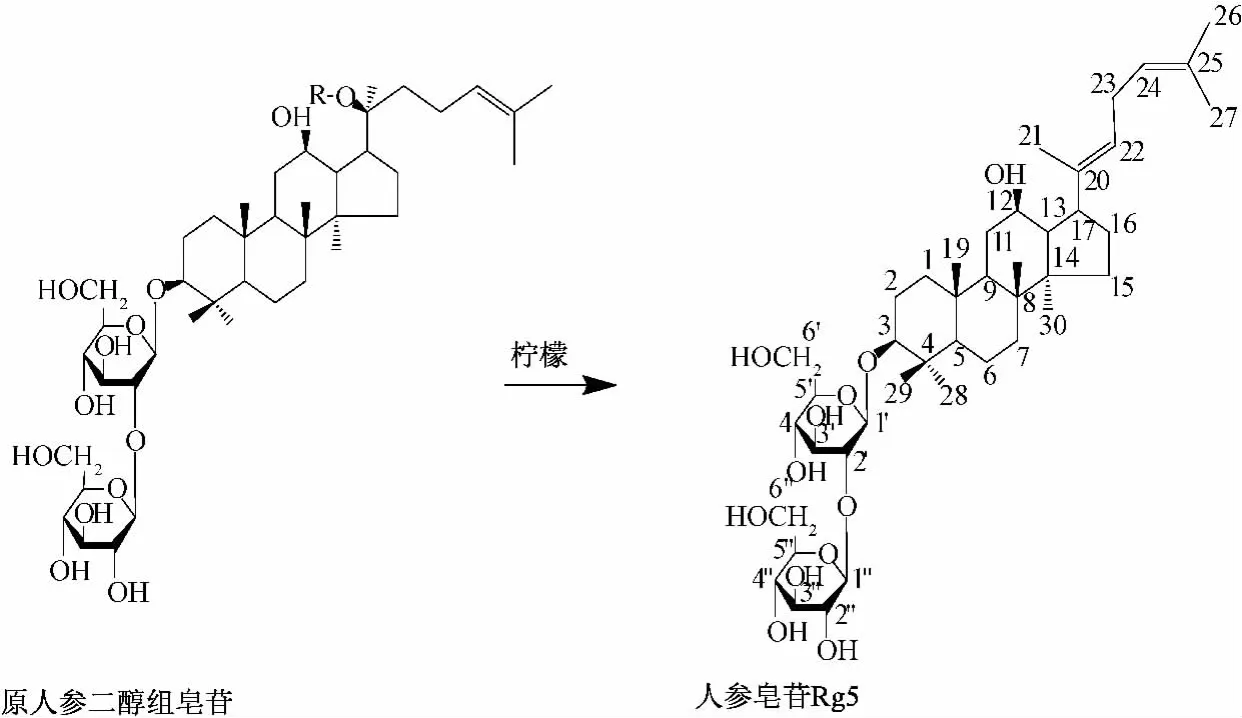
图1 人参皂苷Rg5的制备方案Fig.1 Method of preparation of ginsenoside Rg5
P230P型高效液相色谱仪(大连依利特分析仪器有限公司);JJ—1大功率电动搅拌器(常州国华电器有限公司);DK—98—Ⅱ型恒温水浴锅(天津市泰斯特仪器有限公司)。
2 方法
2.1 稀有人参皂苷Rg5和Rk1的制备 向原人参二醇组皂苷溶液(20 mg/mL)中加入80%的柠檬汁水溶液(1∶2.5,V∶V),于100℃反应2 h。反应产物经饱和碳酸钠中和后,用水饱和正丁醇萃取5次,合并有机层,于50℃旋转蒸发仪蒸干。残留物甲醇溶解(4 mL),0.45μm滤膜过滤,进行HPLC定量分析。
2.2 稀有人参皂苷Rg5和Rk1的分离 将上述反应产物做成样品胶,以三氯甲烷-甲醇为洗脱剂(8.5∶1.5,V/V),利用硅胶柱层析分离得到人参皂苷Rg5、Rk1和Rz1的混合物。将上述混合物溶于甲醇,经半制备型高效液相色谱 [Hypersil C18,250 mm×20 mm,10μm,乙腈-水(39 ∶61),15 mL/min]分离得到三个馏分,分别为化合物1(27.5 mg)、2(18 mg)以及2和3的混合物(20.5 mg)。
2.3 HPLC分析
2.3.1 有机酸测定 将柠檬用榨汁机榨成汁,冷冻杀菌,放置于冰箱内储存。取1 mL柠檬汁加入蒸发皿中,于70℃蒸干。残留物用80%乙醇溶解(8 mL),经离心和滤膜(0.45μm)过滤,用于HPLC分析。Damonsil C18色谱柱(250 mm×4.6 mm,5μm),二极管阵列检测器,进样量 20μL,柱温30℃,体积流量 0.8 mL/min。流动相为0.1%磷酸水溶液。HPLC分析结果,见图2。
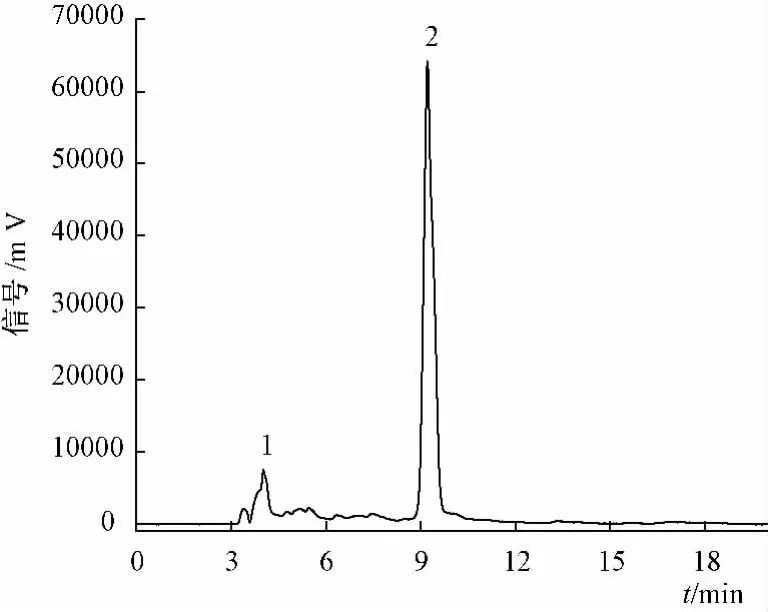
图2 柠檬中有机酸HPLC谱图Fig.2 HPLC analyses of organic acids in lemon
由图2可知,柠檬中主要含有柠檬酸和苹果酸,且柠檬酸的量远大于苹果酸。HPLC定量分析表明,柠檬中苹果酸的量为0.14 mg/mL,柠檬酸的量为20.20 mg/mL,其含有量为苹果酸的144倍,且柠檬的pH为2.46,酸性较强,因此,可用其代替传统HCl、H2SO4和HAc等催化剂,用于人参皂苷Rg5的制备。
2.3.2 反应产物测定 YMC J'sphere ODS-H80色谱柱(4.6 mm×250 mm,4μm),UV检测器,检测波长为203 nm,进样量20μL,柱温30℃,体积流量1 mL/min。流动相A为乙腈,B为水。梯度洗脱程序:0~30 min,30% ~40%A;30~37 min,40% ~50%A;37~45 min,50% ~51%A;45~60 min,51% ~55%A;60~60.10 min,55% ~90%A;60.10~75 min,90%A;75~75.10 min,90% ~30%A。HPLC分析结果,见图3。
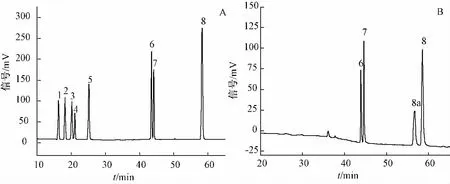
图3 人参皂苷对照品(A)和反应产物(B)的局部HPLC谱图Fig.3 HPLC profile analysis of refer ginsenosides(A)and reaction product(B)
图3-A为人参皂苷对照品的HPLC分析图,人参皂苷 Rb1、Rc、Rb2、Rb3、Rd、20(S)-Rg3、20(R)-Rg3和Rg5的保留时间分别出现在16.3、18.2、 20.2、 21.1、 25.2、 43.5、 44.4、 58.2 min。图3-B为反应产物的HPLC分析图,与图3-A相比,保留时间在15 min~28 min之间没有出现任何信号峰,说明原料人参皂苷 Rb1、Rc、Rb2、Rb3和Rd均已完全转化。由图3-A可知,人参皂苷Rg5的信号峰出现在保留时间58.2 min,图3-B中,保留时间在56.4 min处出现的信号峰,推测为人参皂苷 Rk1与 Rz1[18]混合物,而保留时间58.3 min出现的信号峰可以认定为人参皂苷Rg5,对其定量分析结果表明,收率为30.77%,得率为21.53%。
3 结构鉴定
将化合物1和2溶于氘代吡啶,采用BRUKER AVANCEⅡ核磁共振仪(Switzerland,500 MHz)测定上述两种化合物的1H-NMR和13C-NMR。
化合物1:白色粉末(乙腈);1H-NMR(pyridine-d5,500MHz) δ:0.85(3H, s,-CH3),0.99(3H, s,-CH3),1.05(3H, s,-CH3),1.13(3H, s,-CH3),1.32(3H, s,-CH3),1.61(3H, s,-CH3),1.65(3H, s,-CH3),1.84(3H,s,-CH3),3.31(1H,dd,J=4.0 Hz,C3-H),3.94(1H,s,C12-H),4.94(1 H,d,J=7.5 Hz,C1'-H),5.38(1 H,d,J=7.5 Hz,C1″-H),5.25(1H,t,C24-H),5.53(1H,t,C22-H);13C-NMR结果见表1。
化合物2:白色粉末(乙腈);1H-NMR(pyridine-d5,500MHz) δ:0.83(3H, s,-CH3),0.98(3H, s,-CH3),1.03(3H, s,-CH3),1.13(3H, s,-CH3),1.32(3H, s,-CH3),1.61(3H, s,-CH3),1.68(3H, s,-CH3),3.31(1H,dd,J=4.0 Hz,C3-H),3.94(1H,s,C12-H),4.96(1H,d,J=7.5 Hz,C1'-H),5.41(1 H,d,J=7.5 Hz,C1″-H),4.93(1H,s,C21-H),5.17(1H,s,C21-H),5.30(1H,t,C24-H);13C-NMR结果见表1。
在化合物1的1H-NMR中,δ 0.85~1.84分别出现了C-19、C-30、C-18、C-29、C-28、C-27、C-26和C-21的8个-CH3氢信号峰,δ 5.25和5.53分别为C-24和C-22的双键氢的信号峰。在化合物1的13C-NMR中,共出现42个碳信号峰,其中 δ 105.44和106.37为两个糖端基碳信号峰,δ 140.54、123.65、124.05和 131.62分别为 C-20、C-22、C-24和C-25的双键碳信号峰,而其他1HNMR和13C-NMR数据与文献 [19]基本一致,故化合物1鉴定为人参皂苷Rg5。
化合物2是在制备人参皂苷Rg5过程中副产的次级人参皂苷,其1H-NMR的数据与化合物1基本相似,只是在δ 0.83~1.68之间只有7个-CH3氢信号峰,分属于 C-19、C-30、C-18、C-29、C-28、C-27和C-26的-CH3的氢。此外,由于C-21双键碳上亚甲基的两个氢所处化学环境不同,存在有两个信号峰,分别在δ 4.93和5.17;另一个双键碳(C-24)的氢信号峰出现在δ 5.30。在化合物2的13C-NMR中,化合物2的C-20、C-21和C-22与化合物1存在着明显不同,其信号峰分别出现在δ155.91,108.48和 34.24。化合物 2的其他1HNMR和13C-NMR数据与文献[19]基本一致,故化合物2鉴定为人参皂苷Rk1。
4 人参皂苷Rg5的反应机理
从图4可以看出,PPD转化为人参皂苷Rg5的途径为PPD→Rg3→Rg5,同时生成副产物人参皂苷Rk1和Rz1。PPD皂苷在酸性条件下,首先生成人参皂苷Rg3,再进一步脱水生成人参皂苷Rg5及其副产物。由于人参皂苷Rg3在水中溶解度很低进而形成沉淀,阻碍了人参皂苷Rg3进一步脱水。此外,人参皂苷Rg3在脱水过程中,存在着3种不同的脱水方式,分别生成人参皂苷Rg5(脱水方式符合扎伊切夫规则,E-构型),人参皂苷 Rk1(脱水方式符合霍夫曼规则)和Rz1(脱水方式符合扎伊切夫规则,Z-构型,与人参皂苷Rg5属于顺反异构体)。然而,在上述3种产物中,由于人参皂苷Rg5的脱水方式符合扎伊切夫规则,同时其构型为E-构型,属于优势构象,故其在3种产物中产率较高。从上述分析结果可以看出,若能提高中间产物人参皂苷Rg3溶解度和其脱水的选择性,人参皂苷Rg5的收率势必将有质的提高。
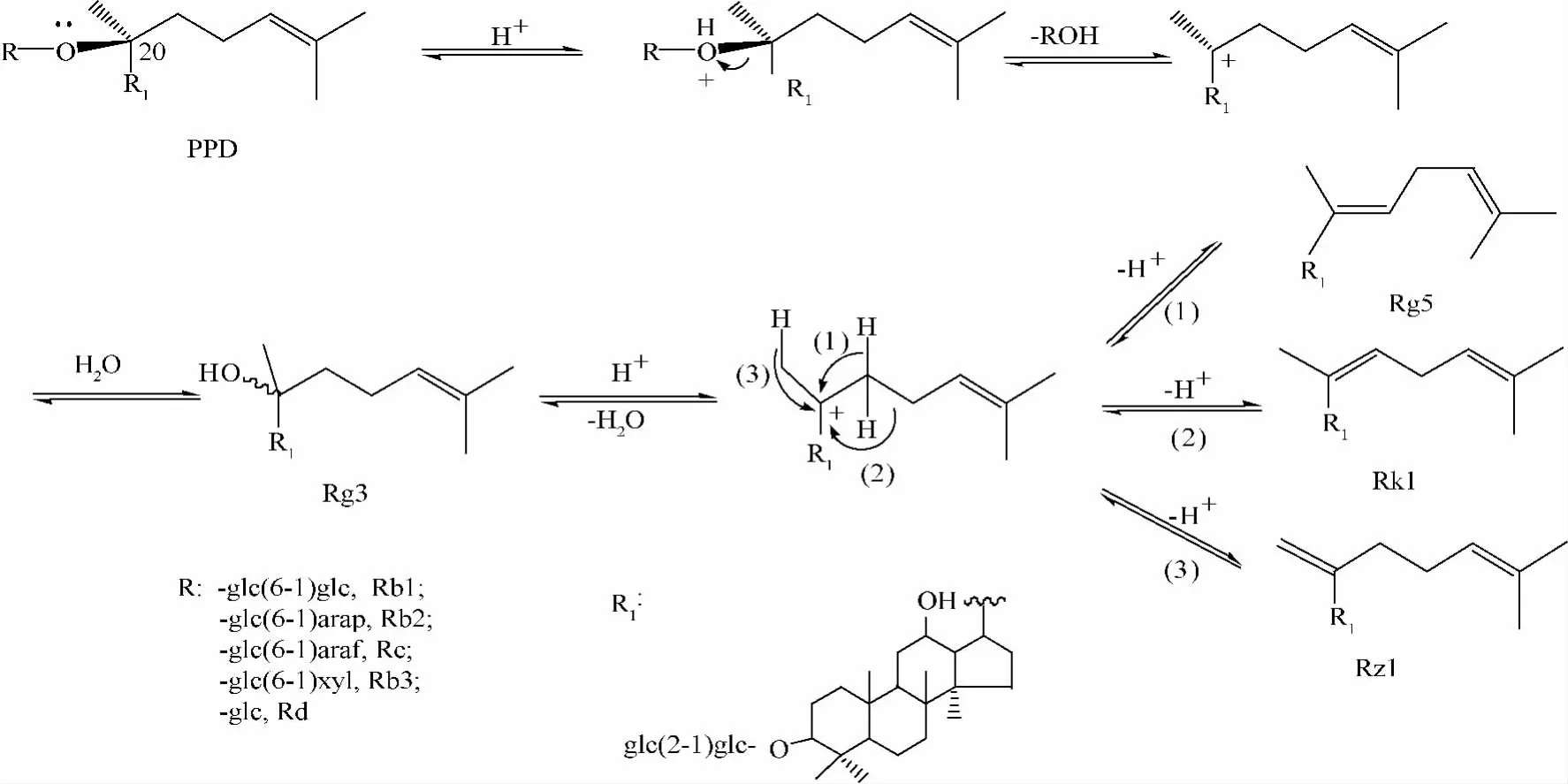
图4 人参皂苷Rg5的反应机理Fig.4 Reaction mechanism of ginsenoside Rg5
5 结论
稀有人参皂苷Rg5为PPD皂苷的次级代谢产物,在抗肿瘤、改善记忆力和抗接触性皮炎等方面疗效显著。由于人参皂苷Rg5的中间体人参皂苷Rg3在水中溶解度较小,而给其制备带来了一定的难度,故有关人参皂苷Rg5制备及药理活性研究报道较少。实验结果表明,PPD皂苷溶液经柠檬汁处理,人参皂苷Rb1、Rc、Rb2、Rb3和 Rd的转化率达到100%,人参皂苷Rg5收率为30.77%,得率为21.53%。与专利方法[17]相比,人参皂苷Rg5的制备不需任何气体(氮气)保护,操作简单,反应时间短,相对于专利缩短了22 h,同时其得率提高了6.83%。这对于研究人参皂苷Rg5的药理活性及开发相关保健品具有重要参考价值。
[1]孙光芝,刘 志,张俊杰.人参二醇组皂苷的药理学研究概况[J].有机农业与食品科学,2005,21(2):136-140.
[2]包海鹰,李 磊,昝立峰,等.黑根霉对人参皂苷Re的生物转化[J].菌物学报,2010,29(4):548-554.
[3]Leung K W,Yung K K,Mak N K,et al.Angiomodulatory and neurological effects of ginsenosides[J].Curr Med Chem,2007,14(12):1371-1380.
[4]Yue P Y,Mak N K,Cheng Y K,et al.Pharmacogenomics and the Yin/Yang actions of ginseng:anti-tumor,angiomodulating and steroid-like activities of ginsenosides[J].Chin Med,2007,2:6.
[5]Kang K S,Yokozawa T,Yamabe N,et al.ESR study on the structure and hydroxyl radical-scavenging activity relationships of ginsenosides isolated from Panax ginseng C.A Meyer[J].Biol Pharm Bull,2007,30(5):917-921.
[6]王国贤,肖志洁,宗瑞义.人参二醇皂甙对小鼠急性脑缺血损伤的保护作用[J].锦州医学院学报,2001,22(6):5-7.
[7]Wu Q G,Hu J Y,Wang Z W.Research progress on the ginsenoside Rg3 in prevention and treatment of tumor and its effective mechanism[J].Guiding Journal of TCM,2005,11(8):87-89.
[8]Liu T G,Huang Y,Cui D D,et al.Inhibitory effect of ginsenoside Rg3 combined with gemcitabine on angiogenesis and growth of lung cancer in mice[J].BMC Cancer,2009,9(1):250-260.
[9]Kim J H,Cho S Y,Lee J H,et al.Neuroprotective effects of ginsenoside Rg3 against homocysteine-induced excitotoxicity in rat hippocampus[J].Brain Res,2007,1136(1):190-199.
[10]Kitagawa I,Yoshikawa M,Yoshigara M,et al.Chemical studies on crude drug precession.I.on the constitution of Ginseng Radix Rubra(1)[J].Yakugaku Zasshi,1983,103:612-622.
[11]Shin Y W,Bae E A,Kim D H.Inhibitory effect of ginsenoside Rg5 and its metabolite ginsenoside Rh3 in an oxazoloneinduced mouse chronic dermatitis model[J].Arch Pharm Res,2006,29(8):685-690.
[12]Park I H,Piao L Z,Kwon S W,et al.Cytotoxic dammarane glycosides from processed ginseng[J].Chem Pharm Bull,2002,50(4):538-540.
[13]Yoo H H,Park J H.Cyclooxygenase inhibitory activity of ginsenoside from heat-processed ginseng[J].Food Chem,2012,133(3):998-1000.
[14]Kim T W,Joh E H,Kim B,et al.Ginsenoside Rg5 ameliorates lung inflammation in mice by inhibiting the binding of LPS to toll-like receptor-4 on macrophages[J].Int Immunopharmacol,2012,12(1):110-116.
[15]张 晶,王世荣,陈全成,等.人参皂苷Rg3(R),Rg3(S),Rg5/Rk1对乙醇致小鼠记忆阻碍改善作用的影响[J].吉林农业大学学报,2006,28(3):283-284.
[16]田 桐,宋建国,赵 慕,等.人参皂苷Rg3与Rg5的分离及Rg3异构体的拆分[J].大连工业大学学报,2011,30(2):109-112.
[17]杨 凌,何克江,杨 义.一种人参二醇型皂甙酸水解制备人参皂甙Rk1和Rg5的方法:中国,CN1463980A[P].2003-12-31.
[18]Kwon S W,Han S B,Park I H,et al.Liquid chromatographic determination of less polar ginsenosides in processed ginseng[J].J Chromatogr A,2001,921(2):335-339.
[19]Park H I,Han S B,Kim J M,et al.Four new acetylated ginsenosides from processed ginseng(Sun Ginseng)[J].Arch Pharm Res,2002,25(6):837-841.

