二种纯化工艺对茵陈水提液的影响研究
雷 昌,夏新华,黄玛莎,沈芹芹,彭买娇
(湖南中医药大学药学院,湖南长沙 410208)
茵陈为菊科多年生草本植物滨蒿Artemisia scoparia Waldst.et kit.或茵陈蒿 Artemisia capillaries Thunb.的干燥地上部分。茵陈原名茵陈蒿,始载于《神农本草经》,其味苦、辛,性微寒;归胃、脾、胆、肝经,具有清湿热,退黄疸的功能,可用于治疗黄疸尿少、湿疮瘙痒、传染性黄疸型肝炎等症[1-2]。茵陈的化学成分主要有香豆素类、有机酸类、色原酮类及挥发油等[3-4]。
壳聚糖化学名为(1,4)-2-氨基-2-脱氧-β-D-葡萄糖,是甲壳素脱乙酰基后的一种产物,其结构类似于纤维素。目前,壳聚糖絮凝澄清工艺近年来研究较多,被同行认为有望广泛推广[5-8]的新型的中药水提液纯化方法,研究表明其除杂效果明显优于水提醇沉法,并具有操作简单、高效、安全和降低成本及降低浸膏吸湿性的优点[9-10];同时壳聚糖在缓释、控释制剂[11-13]、纳米微粒靶向制剂的应用上有着独特的物化性质、生物相容性和生理活性。本实验采用壳聚糖絮凝澄清工艺和醇沉工艺对茵陈水提液的纯化进行了系统研究,从糖类、蛋白质和鞣质去除效果、固形物与绿原酸的保留率、以及吸湿性等方面与醇沉法进行了比较,可为合理选择中药水提液纯化工艺提供科学依据。
1 仪器与试药
Agilent 1100型高效液相色谱仪;SP—756型紫外可见分光光度计(上海光谱仪器有限公司);AR1140电子天平(上海奥豪斯仪器有限公司);DF101-S集热式恒温加热磁力搅拌器(巩义市英峪予华仪器厂);KQ5200BE型数控超声波清洗器(昆山市超声仪器有限公司);TD5A—WS台式低速离心机(湖南湘仪实验仪器开发有限公司);RE52—99型旋转蒸发仪(上海亚荣生化仪器厂);DZF—6050型真空干燥箱(上海精宏实验设备有限公司)。
茵陈(安徽惠隆中药饮片有限公司,批号20110401);绿原酸对照品(中国食品药品检定研究院110753-200413);壳聚糖(国药集团化学试剂有限公司,批号F20091203);苯酚(AR,湖南汇虹试剂有限公司,20090824);考马斯亮蓝G-250(天津光复精细化工研究所,分析纯);无水葡萄糖(中国药品生物制品检定所110833-200904);乙腈为色谱纯,乙醇为分析纯,水为纯化水。
1%壳聚糖溶液的配制 取壳聚糖5g,加1%醋酸500 mL,静置24 h,搅拌均匀,即得。
5%苯酚试液的配制 取苯酚5g,加蒸馏水定容至100 mL,摇匀,即得。
2 方法与结果
2.1 茵陈水提液的制备 取茵陈饮片1 kg,第1次加15倍量水煎煮2 h,第2次加10倍量水煎煮1.5 h,滤过,滤液备用。取上述滤液于70℃减压浓缩(-0.08 MPa),离心,取上清液(均匀分成2份),备用。
2.2 茵陈水提液的纯化处理
2.2.1 醇沉法处理 取上述上清液1份,等分成3份,分别浓缩至相对密度为1.15、1.20、1.25,每份再等分为3份,再缓缓加入95%乙醇使药液含醇量分别为50%、60%、70%,继续搅拌15 min后,静置24 h,滤过,收集滤液,备用。
2.2.2 壳聚糖絮凝澄清法处理 取上述上清液1份,等分成3份,分别浓缩至药液比(生药量-药液体积之比)为1∶2、1∶4、1∶6,每份再等分3份,置于水浴加热至70℃,再缓缓加入1%壳聚糖溶液(按药液所含生药量计算,分别为每1 g生药加入0.6、1.0、1.4 mL),继续搅拌15 min后,静置24 h,滤过,收集滤液,备用。
2.3 茵陈水提液纯化样品的测定
2.3.1 浸膏得率的测定 取适量上述醇沉和絮凝工艺后所得滤液,分别经减压浓缩、真空干燥(65℃)至恒定质量,计算浸膏得率。结果表明,茵陈水提液经2种纯化工艺处理后其浸膏得率有一定的差异,且经絮凝工艺处理后其浸膏得率明显高于醇沉工艺。
2.3.2 茵陈HPLC指纹图谱条件的建立和绿原酸的测定
(1)色谱条件 Kromasil ODS-1 C18色谱柱(250 mm×4.6 mm,5μm);流动相乙腈-0.05%磷酸水溶液(10∶90);体积流量1.0 mL/min;柱温30℃;检测波长为327 nm;进样量10μL。
(2)对照品溶液的制备与标准曲线的绘制精密称取绿原酸对照品适量,加50%甲醇溶解制成每1 mL含0.063 mg的对照品溶液。精密取取对照品溶液2、4、6、8、10μL,分别注入高效液相色谱仪,测定其峰面积积分值,以质量浓度为横坐标,峰面积为纵坐标,得到回归方程为 Y=2992.2X-14.3,R2=0.9990,表明绿原酸在0.126~0.630μg具有良好的线性关系。
(3)供试品溶液的制备 精密称定经纯化后的茵陈浸膏至具塞锥形瓶中,加入50%甲醇50 mL,浸泡20 min,称定质量,超声处理20 min,放冷,再称定质量,用50%甲醇补足减轻的质量,摇匀,离心,精密量取上清液5 mL,置10 mL棕色量瓶中,加50%甲醇至刻度,摇匀,0.45μm微孔滤膜滤过,弃初滤液,取续滤液,即得。
(4)稳定性试验 精密量取同一茵陈供试品溶液10μL,分别于0、2、4、8、12、24 h进样,记录绿原酸的峰面积。结果RSD为2.22%,表明样品溶液在24 h内稳定。
(5)精密度试验 精密量取同一茵陈供试品溶液10μL,重复进样6次,记录绿原酸的峰面积。结果RSD为1.47%,表明仪器精密度良好。
(6)重复性试验 按上述2.3.2项下“供试品溶液的制备”方法平行配制6份供试品溶液,再分别精密量取其供试品溶液10μL,记录绿原酸的峰面积。结果RSD为1.96%,表明该方法重复性良好。
(7)加样回收试验 取已知量(绿原酸为0.09%)的供试品溶液6份,分别加入绿原酸对照品适量,按上述2.3.2项下“供试品溶液的制备”方法制备供试品溶液,同上记录绿原酸的峰面积,计算平均回收率为100.3%,RSD值为2.65%。
(8)样品测定 取经2种纯化后的茵陈浸膏样品适量,按上述方法测定绿原酸的量。结果表明,茵陈水提液经壳聚糖絮凝法处理后其绿原酸的含量与醇沉法相近(见表1~2)。
2.3.3 蛋白质与鞣质的检测 按照欧金秀[14]蛋白质和鞣质的检查方法,对2种纯化工艺除去蛋白质和鞣质的效果进行比较。结果表明,醇沉处理后的溶液蛋白质、鞣质检查呈阳性,而经絮凝纯化处理后的溶液检查呈阴性,表明壳聚糖絮凝工艺除去蛋白质和鞣质的效果优于醇沉工艺。
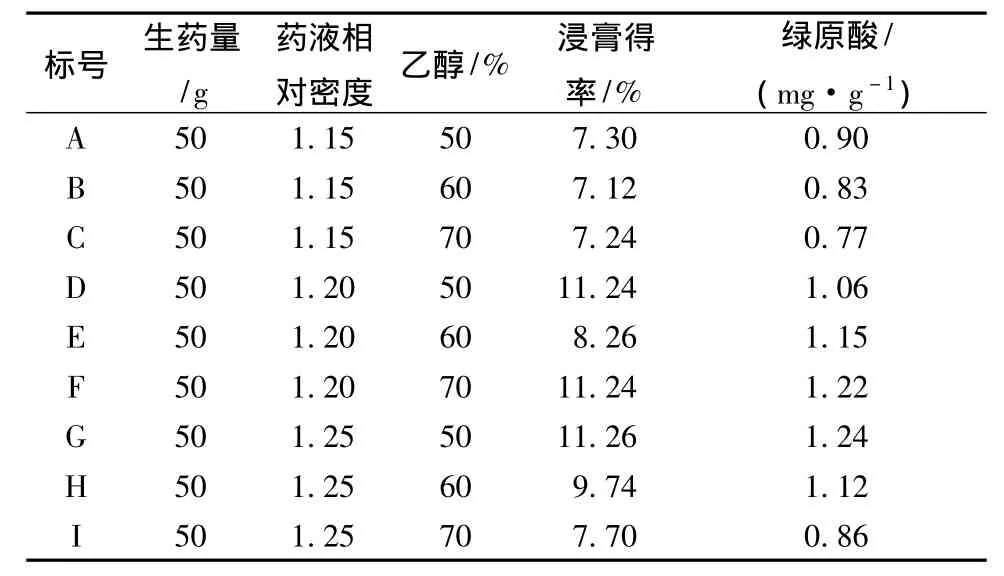
表1 茵陈水提液经醇沉法处理后的浸膏得率和绿原酸的量Tab.1 Extract yield and chlorogenic acid content of water extract from Herba artemisiae that was disposed by alcohol precipitation process
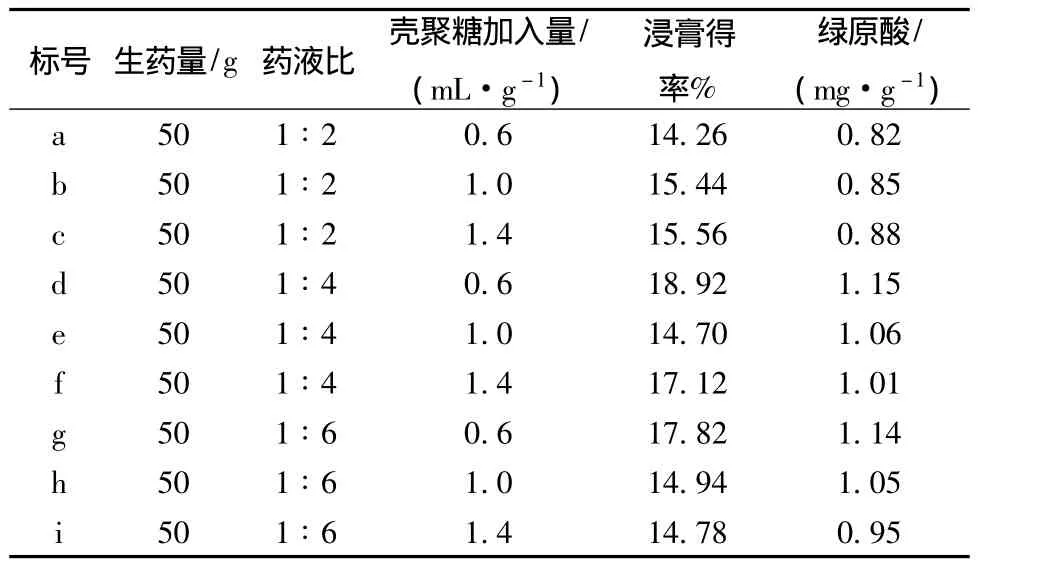
表2 茵陈水提液经壳聚糖絮凝澄清法处理后的浸膏得率和绿原酸的量Tab.2 Extract yield and chlorogenic acid content of water extract from Herba artemisiae that was disposed by chitosan flocculation clarification process
2.3.4 单糖、低聚糖和总多糖的测定
(1)标准曲线的绘制 按照楚笑辉[10]单糖、低聚糖和总多糖测定的方法,以葡萄糖质量浓度为横坐标,吸光值为纵坐标绘制标准曲线,回归方程为:Y=0.0086X+0.0036,R2=0.9994,表明葡萄糖质量浓度在9~90μg/mL范围内具有良好的线性关系。
(2)单糖-低聚糖测定 精密称取经2种纯化方法所得浸膏适量,加80%乙醇超声后定容至10 mL,再精密吸取上清液2 mL定容至25 mL,即得单糖-低聚糖供试品溶液。精密吸取供试品溶液1.0 mL,按上述2.3.4项下“标准曲线的绘制”方法测定吸光值,计算,结果见图1A。
(3)总多糖测定 精密称取经2种纯化方法所得浸膏适量,加适量蒸馏水超声溶解后定容至10 mL,再精密吸取2 mL定容至25 mL,即得总糖供试品溶液。精密吸取供试品溶液1.0 mL,按上述2.3.4项下“标准曲线的绘制”方法测定吸光值,计算得出总糖的量。总糖的量减去单糖-低聚糖含量即得总多糖的量,结果见图1B。
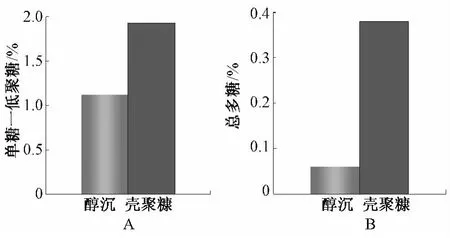
图1 两种纯化工艺所得样品总多糖和低聚糖、单糖保留率的平均值Fig.1 Polysaccharide and oligosaccharide,monosaccharide retention rate of the average value of two purification processes
由图1可见,壳聚糖絮凝工艺对茵陈水提液中总多糖和单糖-低聚糖保留率均高于醇沉工艺。
2.3.5 两种纯化方法对茵陈水提浸膏吸湿性的影响
(1)吸湿百分率的测定 按照杨磊[15]对两种纯化方法对丹皮水提浸膏吸湿性的研究方法,以平均吸湿百分率(%)为纵坐标,时间(h)为横坐标作图,结果表明在RH为75%的实验条件下,经壳聚糖絮凝澄清工艺处理后的浸膏粉末的吸湿性较醇沉工艺处理后的浸膏粉末有一定程度下降。(见图2)。
(2)临界相对湿度的测定 按照杨磊[15]对两种纯化方法对丹皮水提浸膏吸湿性的研究方法,以吸湿百分率(%)为纵坐标,相对湿度(RH%)为横坐标作图,曲线两端的切线,两切线交点对应的横坐标即为临界相对湿度(CRH)。
茵陈水提液经壳聚糖絮凝澄清工艺处理后所得9份浸膏的平均CRH为72%,经醇沉处理后所得9份浸膏的平均CRH为66%。而CRH是水溶性药物的固有特征,是药物吸湿性大小的衡量指标,药物的CRH越小则越易吸湿;反之则不易吸湿。因此表明茵陈水提液经壳聚糖絮凝澄清工艺处理后其干浸膏的吸湿性低于醇沉工艺。
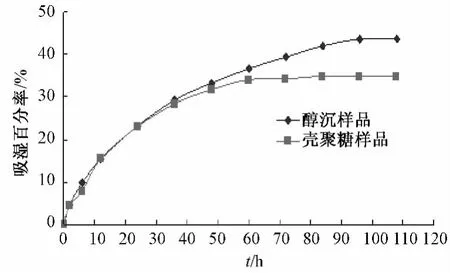
图2 两种纯化方法所得浸膏的吸湿曲线Fig.2 Moisture absorption curve of concrete of two purification processes
2.3.6 壳聚糖絮凝澄清法与醇沉法对茵陈化学成分影响的研究
(1)茵陈HPLC指纹图谱的绘制 按2.3.2项下方法建立茵陈HPLC指纹图谱,如图3所示为茵陈水提液经2种纯化方法处理后所得样品的HPLC指纹图谱的共有模式图。
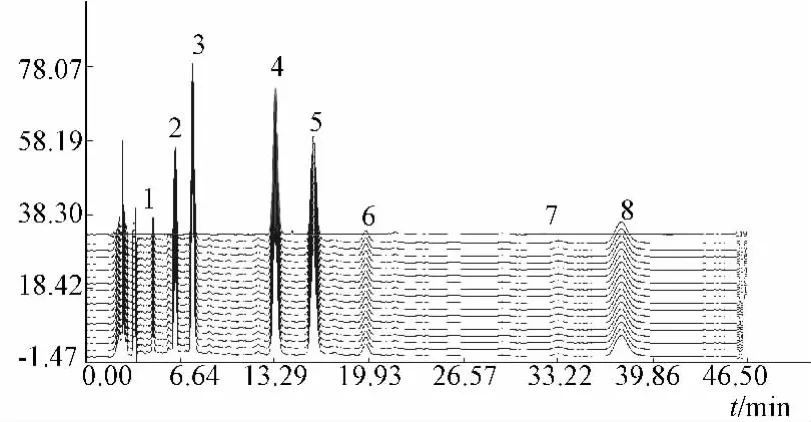
图3 茵陈水提液纯化样品HPLC指纹图谱共有模式图(S1~S9-醇沉工艺样品,S10~S18-壳聚糖工艺样品,S19-绿原酸对照品)Fig.3 HPLC fingerprint spectrum of pattern of water extract from Herba artemisiae that was disposed by purification process(S1~S9-alcohol sinking process samples,S10 ~ S18-chitosan samples,S19-chlorogenic acid reference substance)
(2)茵陈水提液二种纯化样品HPLC指纹图中各组分相对表观含量的比较 以绿原酸色谱峰(图3中4号峰)为参比,根据绿原酸对照品溶液的浓度和峰面积积分值,计算2种纯化样品HPLC指纹图谱中各组分的表观含量,并按下式求出二种纯化样品各组分的相对表观含量,同时绘制二种纯化样品各组分平均相对表观含量的折线图(见图4)。
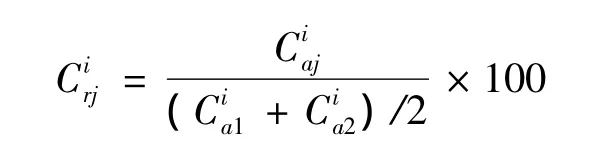
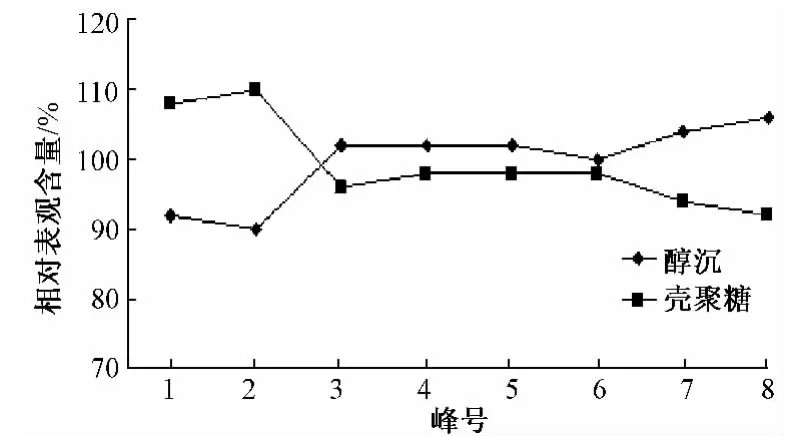
图4 茵陈水提液二种纯化样品HPLC指纹图谱中各组分相对表观含量折线图Fig.4 HPLC fingerprint spectrum of each component relative content of apparent line chart of water extract from Herba artemisiae that was disposed by two purification processes
由图4结合图3分析可知,茵陈中保留时间较短的组分(1~2号峰)在醇沉样品中的相对表观含量明显低于壳聚糖絮凝澄清样品,保留时间居中的组分(3~6号峰)在醇沉样品中的相对表观含量与壳聚糖絮凝澄清样品基本相同,而保留时间较长的组分(7~8号峰)在醇沉样品中的相对表观含量明显高于壳聚糖絮凝澄清样品。
3 讨论
3.1 本实验以茵陈药材为研究对象,较为系统地考察了壳聚糖絮凝澄清工艺与醇沉工艺对其水提液中所含糖类、蛋白质、鞣质、绿原酸及浸膏得率和浸膏吸湿性的影响。结果表明,茵陈水提液经壳聚糖絮凝澄清工艺处理后其浸膏的吸湿性低于醇沉工艺;浸膏得率、糖类所含有量均高于醇沉工艺(其中对多糖的保留明显优于醇沉工艺);有效成分绿原酸的保留量与醇沉工艺较为接近;同时壳聚糖絮凝工艺除去蛋白质和鞣质的效果优于醇沉工艺,这些与早期的研究结果相类似[10,14]。
3.2 本实验建立了茵陈水提液纯化样品的HPLC指纹图谱,并以表观含量与相对表观含量为评价指标,比较了二种纯化工艺对茵陈水提液中各化学成分的影响。结果表明,两种指纹图谱数据经统计分析后发现经两种纯化工艺所处理的样品,有效成分按极性可分为三部分,即相对亲水性部分、相对中等极性部分和相对亲脂性部分。壳聚糖絮凝澄清法所得药液亲水性部分(在反相HPLC色谱图中保留时间短的组分)含量明显高于醇沉所得药液,且随着极性减小两种方法所得药液化学成分含有量差异变小,当极性减小到一定程度时醇沉所提纯药液含有量明显高于壳聚糖絮凝澄清法所提纯药液,且随着亲脂性化学成分(在反相HPLC色谱图中保留时间长的组分)的增大含量越高。该研究成果对中药制剂的纯化精制具有指导价值,可根据两种中药纯化工艺对中药成分含有量的影响规律,结合所需纯化中药水提液有效成分的极性大小选用合适的纯化方法,以提高有效成分含量从而保证中药制剂质量。
[1]国家药典委员会.中华人民共和国药典:2005年版一部[S].北京:化学理工出版社,2005:166.
[2]徐建国,田呈瑞,胡青平,等.绵菌陈中绿原酸的提取工艺研究[J].中国农业通报,2007,23(9):162-165.
[3]褚明艳,胡一桥,谭仁祥.茵陈蒿的化学及药理学研究进展[J].中草药,1998,29(8):564-566.
[4]谢 韬,梁敬钰,刘 净.茵陈化学成分和药理作用研究进展[J].海峡药学,2004,16(1):8-13.
[5]颜 红.天然澄清剂在中药水提液澄清工艺中的应用[J].中医药导报,2005,11(1):80.
[6]张来华,王 博.中药水提液纯化技术研究进展[J].亚太传统医药,2009,5(7):154-157.
[7]龚慕辛,贾春伶.天然澄清剂在中药提取液精制中的应用[J].北京中医,2001,20(6):43-45.
[8]祝连彩,王伯初.壳聚糖在中药药液澄清中的应用[J].重庆大学学报:自然科学版,2003,26(12):55-57.
[9]郭立伟.中药分离原理与技术[M].北京:人民卫生出版社,2010:258
[10]楚笑辉,唐路梅,夏新华.壳聚糖絮凝澄清工艺与醇沉工艺纯化乙肝宁复方水提液的对比研究[J].中国实验方剂学杂志,2011,17(21):1-5.
[11]杨红梅,陈 旭,赵坤杰.阿司匹林壳聚糖缓释片兔体内药物动力学研究[J].西北药学杂志,2004,19(5):21-32.
[12]陈 丽,葛为公,裴世成,等.芦丁壳聚糖缓释片处方设计及体外释放度测定[J].解放军药学学报,2011,27(2):135-136.
[13]徐甲坤,毕彩丰,范玉华,等.羟甲基壳聚糖水凝胶制备在药物控释中应用[J].中国海洋大学学报,2007,37(3):503-506.
[14]欧金秀,夏新华.絮凝澄清技术与醇沉工艺用于精制乙肝宁水提液的对比研究[D].长沙:湖南中医药大学,2006.
[15]杨 磊.壳聚糖絮凝澄清法降低中药材水提浸膏吸湿性机理的研究[D].长沙:湖南中医药大学,2012.

