大黄素等提取物对耐药性大肠杆菌生物膜形成的影响
黄干荣,李晓华,黄衍强,黄小凤,韦连登,韦红玉,陈源红,唐华英,杨 珊,覃艳春
(右江民族医学院,广西百色 533000)
我国的中草药资源丰富,中医学是我国的传统医学,随着现代医学的发展,中医的作用理论越来越明确,已经通过实验证明部分中药在抗菌作用方面效果显著,但是很多中药的有效成分和作用机制却有待确定[1-3]。本研究通过检测大黄素等中药提取物对耐药性大肠杆菌生物膜形成的影响,探索能有效抑制大肠杆菌的中药成分,从生物膜作用层面阐述中药有效成分的作用。
1 实验材料
1.1 菌株来源 耐药性大肠杆菌由本实验室分离、鉴定、保存,均经过AUTOREADER快速细菌自动鉴定仪鉴定。对照菌株CMCC44103由广东省微生物菌种保藏中心提供。耐药性大肠杆菌对亚胺培南(Imipenem)、头孢哌酮(Cefoperazone)、左氧沙星(Levofloxacin)耐药。
1.2 中药提取物 98%大黄素、97%黄连素、98%苦参碱、90%黄芩苷购自陕西昂盛生物科技有限公司。
1.3 主要试剂 营养琼脂(Nutirent Agar)、M-H培养基 [pH(7.4+0.2)]、营养肉汤 [pH(7.4+0.2)]、蛋白胨、结晶紫购自杭州天和生物有限公司;FITC标记的刀豆球蛋白(FLUKA NO61361)及碘化丙啶(P4170-100MG)均购自美国Sigma公司产品。
1.4 主要仪器 SPX—150—Z型恒温培养箱(上海跃进医疗器械厂);低温冰箱(日本SANYO公司);SW—CJ—2FD型超净工作台(苏净集团安泰空气技术有限公司);电子天平(Sartorius公司,BP221S型);紫外分光光度计(BIO—RAD);激光共聚焦显微镜FV500型(OLYM—PUS公司)。
2 实验方法
2.1 制备对倍稀释的药物M-H琼脂平板和肉汤液
把98%大黄素、97%黄连素、98%苦参碱、90%黄芩苷与M-H琼脂液和肉汤液对倍稀释,把药物质量浓度分别调整为 1.00、2.00、4.00、8.00、 16.0、 32.0、 64.0、 128、 256 μg/mL,备用。
2.2 检测中药提取物对耐药性大肠杆菌的MIC采用标准琼脂平板对倍稀释法检测MIC[4]。将MH肉汤过夜培养的大肠杆菌稀释至0.5麦氏单位(相当于1.0×108CFU/mL),用移液器接种约2μL菌液到已经制备好的含不同质量浓度药物的MH琼脂平板上,每孔约105CFU,37℃孵育20 h后判断结果。以能完全抑制细菌生长的药物最低质量浓度为MIC。敏感性判断按照2012CLIS临床微生物标准。菌株CMCC44103作为敏感菌株对照。
2.3 制备中药提取物干扰耐药性大肠杆菌生长的96孔板 LB平板转大肠杆菌过夜,分别挑单菌落于10 mL LB培养基,摇菌约18~20 h,将菌液稀释至0.5麦氏单位后取2μL在96孔板中,用已经制备好的质量浓度分别为4、8、16、32、64、128μg/mL的含药M-H肉汤液200μL稀释,取3个复孔,放在37℃孵箱内孵育18~20 h。
2.4 检测中药提取物干扰耐药性大肠杆菌生长的OD值 采用结晶紫染色法[4]检测OD值。将2.2项中孵育好的孔板取出后弃去培养基,用无菌PBS液冲洗3次,风干,用1%结晶紫染色5 min,PBS液冲洗3次,风干,用30%的乙酸溶解后稀释两倍,在波长590 nm时测量吸光度,取其平均值。
2.5 检测中药提取物干扰后的耐药性大肠杆菌活菌数量 参照GB4789.2-2010《食品安全国家标准食品微生物学检验 菌落总数测定》,采用菌落计数法检测中药提取物干扰后的耐药性大肠杆菌活菌数量。
2.6 耐药性大肠杆菌生物膜的制备 采用96孔板免疫荧光标记技术[5],将2.2项中孵育好孔板取出后弃去培养基,用无菌PBS液冲洗3次,2.5%戊二醛固定1.5 h;PBS液冲洗,在4℃环境,用FITC-CONA标记30 min,PI标记15 min;PBS冲洗后40%PBS-甘油封片,形成耐药性大肠杆菌生物膜。
2.7 用激光共聚焦显微镜观察耐药性大肠杆菌生物膜形成 用激光共聚焦显微镜观察细菌在LB培养基中形成的生物膜,每个标本从生物膜底面朝向生物膜表面随机选取3个视野。
2.8 统计学分析方法 采用t检验,比较多组均数间差异。
3 实验结果
3.1 中药提取物对耐药性大肠杆菌的MIC测定结果 大黄素、黄连素、苦参碱对耐药性大肠杆菌的MIC分别是 32、64、128μg/mL,黄芩苷在 256μg/mL时无作用,见表1。

表1 耐药性大肠杆菌菌株对中药提取物的MIC测定结果Tab.1 MIC of drug resistance Escherichia coli to extractive of Chinese medicine
3.2 中药提取物干扰耐药性大肠杆菌生长的OD值 大黄素16μg/mL、黄连素32μg/mL、苦参碱64μg/mL时,菌株孔板OD值均小于1,黄芩苷作用组和对照组OD值无明显变化,在相同质量浓度
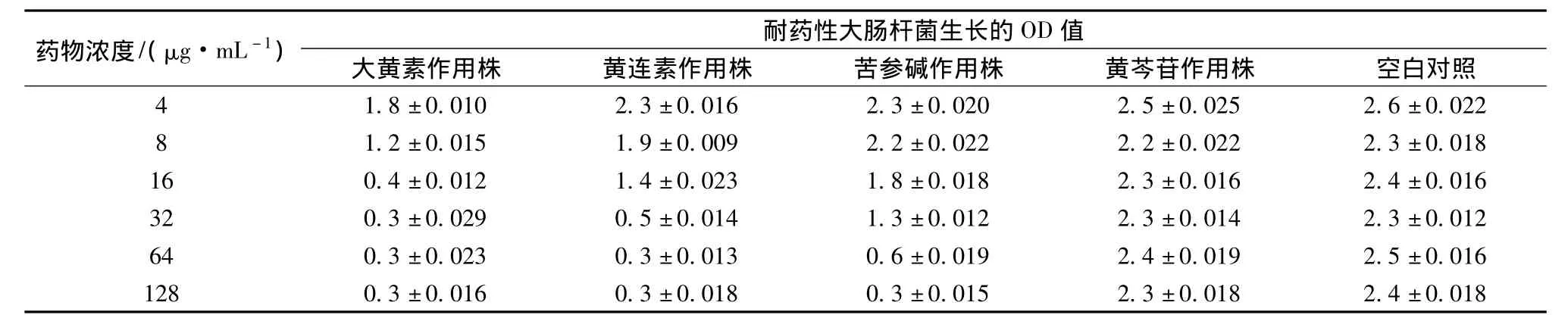
表2 中药提取物干扰耐药性大肠杆菌生长的OD值Tab.2 Growth OD of Escherichia coli to interference on Chinese medicine extractive
3.3 中药提取物干扰后的耐药性大肠杆菌活菌数量 检测不同质量浓度大黄素(8、16μg/mL)、黄连素(16、32μg/mL)、苦参碱(32、64μg/mL)干扰耐药性大肠杆菌的活菌数量,发现大黄素和黄连素作用组在菌液100倍和1000倍稀释时菌落数差异有统计学意义,苦参碱组在菌液1000倍稀释时菌落数差异有统计学意义,见表3。
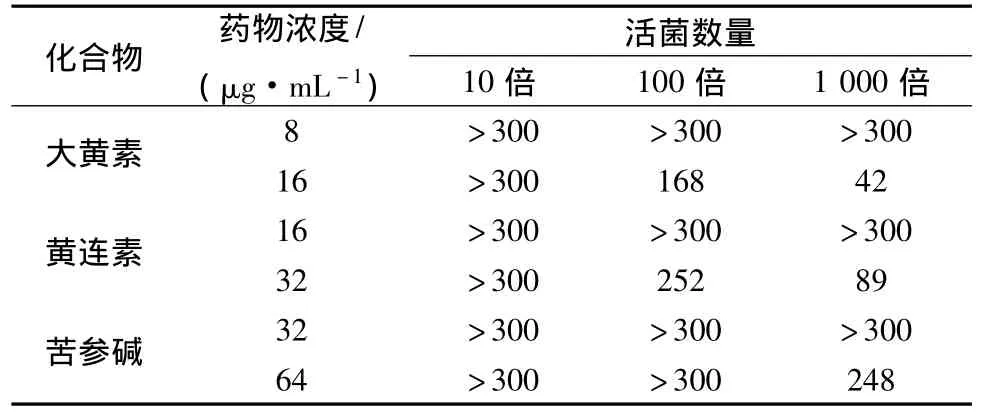
表3 中药提取物干扰后的耐药性大肠杆菌活菌数量Tab.3 Drug resistance Escherichia coli number to interference on Chinese medicine extractive
3.4 检测中药提取物抑制耐药性大肠杆菌生物膜形成 激光共聚焦显微镜扫描可发现生物膜从培养皿底部向上形成,空白对照组和黄芩苷作用组菌株形成的生物膜厚度较厚,蘑菇状突起,厚薄不均,部分连成片(见图1A、1B)。大黄素16μg/mL、黄连素32μg/mL、苦参碱64μg/mL干扰组菌株生物膜较稀疏,大多为散在小斑块状,显著少于对照组菌株(见图1C、1D、1F)。图中红色为细菌,绿色为细菌产生的多糖,细菌及多糖重叠产生图像中的黄色。
4 讨论
近年来,随着广谱抗生素的广泛应用,耐药细菌不断增多,大肠杆菌的耐药性也非常严重[6-7],因此寻找安全有效的抗菌药物是目前研究的热点之一。中草药是我国医学宝库中最珍贵财富之一,它存在很多抗菌活性强、毒性低的有效成分,如大黄等对大肠杆菌、金黄色葡萄球菌均有抑制作用[8-12],但是它们提取物的抑菌作用以及对生物膜形成的影响未见有报道。本研究结果发现大黄素、黄连素、苦参碱对耐药性大肠杆菌均有较明显的抑制作用,MIC分别是32、64、128μg/mL,可以用来治疗耐药性大肠杆菌引起的疾病,黄芩苷无作用。

图1 耐药性大肠杆菌生物膜扫描图Fig.1 Drug resistance Escherichia coli biofilm scans picture on the control group
细菌生物膜是由许多细菌聚集黏结在一起分泌的一种黏性物质,主要是多糖、核酸、脂类和蛋白等,交织粘附非生物或生物表面形成“薄膜”,能对抗外来危险,增强耐受抗生素的能力[13-14]。大肠杆菌是医院感染的重要病原菌之一,形成生物膜导致感染易慢性化并难于控制。有研究表明含糖的LB培养基对大肠杆菌的生物膜有一定的影响[15-16],是否还有其它物质也能干扰大肠杆菌生物膜的形成,有待进一步研究。本实验选用大黄素、黄连素、苦参碱、黄芩苷,在小于MIC质量浓度的96孔板中观察耐药性大肠杆菌生物膜的形成和活菌数量。结果发现,大黄素16μg/mL、黄连素32μg/mL、苦参碱64μg/mL时,菌株孔板OD值均小于1,而且活菌数量明显减少,共聚焦显微镜扫描显示多糖的绿色部分已经消失,生物膜形成受到明显抑制。其原因可能是部分菌株被抑制,存活菌株的荚膜被破坏,分泌多糖的能力下降,影响菌株的黏附,其它黏附分子,如菌毛黏附素,是否也被破坏需要进一步研究。另外,对比OD值与活菌数量、生物膜的扫描图,发现OD值小于1时,对应浓度菌孔生物膜的形成明显减少,活菌数量明显减少,因此可以借助OD值小于1指标初步判断菌株生物膜形成效果。
目前本研究发现大黄素、黄连素、苦参碱能明显抑制耐药性大肠杆菌形成生物膜,这只是表象,它们的分子作用机制还有待进一步研究。
[1]吴 霞,李药兰,张冬梅.25种中草药体外抑制鼻咽癌细胞增殖活性研究[J].中成药,2010,32(12):2161-2163.
[2]邢咏梅.加减黄连解毒汤治疗肝硬化饼发自发性腹膜炎的临床观察[J].中外健康文摘,2009,8(3):208.
[3]田文红,路 淋,胡筱娟.黄连解毒汤合增液及治疗糖尿病32例[J].陕西中医,2008,29(12):1603.
[4]赵丽娟,黄衍强.医学微生物学实验指导与考试指南[M].桂林:广西科学技术出版社出版,2008.
[5]Neu T R,Woelfl S,Lawrenee J R.Three-dimensional differentiation of photo-autotrophic biofilm constituents by multi-channel laster scaning microscopy(single-photon and two-photon excitation)[J].J Microbiol Methods,2004,56(2):161-172.
[6]刘坤友.7种壮药抗耐药性大肠杆菌的抑菌效果[J].广西医学,2012,34(11):1556-1556.
[7]常明向,章 晶,陈科力.黄连、赤芍及大黄对大肠杆菌内毒素释放的影响[J].中成药,2007,29(5):752-753.
[8]黄衍强,黄宏思,张 莲,等.6种中草药抗耐药性大肠杆菌的抑菌效果[J].右江民族医学院学报,2009,31(3):368-369.
[9]马志英.高效液相色谱-双波长紫外检测同时测定清肺抑火片中 4种药效成分[J].中成药,2012,34(12):2330-2334.
[10]张保国,程铁峰,刘庆芳.黄连解毒汤现代临床新用[J].中成药,2010,32(2):283-287.
[11]江汉奇.黄连解毒汤治疗全身炎症反应综合征的临床观察[J].光明中医,2009,24(3):480.
[12]丁 艳,黄志华.大黄素的抗肿瘤作用研究进展[J].时珍国医国药,2008,19(5):1272-1274.
[13]向 丽,周铁军,叶迎春.诃子鞣质对白色念珠菌及其生物被膜的影响[J].重庆医学,2013,42(2):134-137.
[14]王 忠,季 文,张瑞琴.激光共聚焦显微镜观察铜绿假单胞菌生物膜的形成[J].中国药物与临床,2013,13(1):37-39.
[15]Walsh C,Duffy G,Nally P,et al.Transfer of ampicillin resistance from Salmonella typhimurium DT104 to Escherichia coli K12 in food[J].Lett Appl Microbiol,2008,46(2):210-215.
[16]Wulff N A,Mariano A G,Gaurivaud P,et al.Influence of culture medium pH on growth,aggregation,and biofilm formation of Xylella fastidiosa[J].Curr Microbiol,2008,57(2):127-132.

