HBD-1、HBD-2和NF-κBp65在红皮病银屑病皮损中的表达
王淑艳,翟宁,周鸿波,耿龙
(中国医科大学附属第一医院,沈阳110001)
红皮病又称剥脱性皮炎,是一种较严重的皮肤疾病,表现为皮肤弥漫性潮红、肿胀、浸润、脱屑,有时可以导致内脏损伤和代谢紊乱,为多种原因引起的一种综合病症,死亡率也较高[1]。引起该病因素很多,包括银屑病、湿疹-皮炎、药物过敏反应、恶性肿瘤及原因不明者,银屑病是最常见的原因。人类防御素 β(human β-defensins,HBD)存在于皮肤和黏膜上皮组织,可分为两种,HBD-1为组成性表达,HBD-2为诱导性表达且受到较多关注,感染和一些炎症细胞因子如白细胞介素(IL)-1α、IL-1β、肿瘤坏死因子(TNF)-α、干扰素(IFN)-γ等能明显诱导或增强HBD-2表达水平[2]。核转录因子κBp(Nuclear-factor-κBp,NF-κBp) 是一种作用广泛的转录因子,调控众多细胞因子和炎症介质的基因表达,参与细胞内信号传递,调节免疫反应,从而影响组织细胞的生理、病理反应。本研究拟通过探讨HBD-1、HBD-2和NF-κBp65在银屑病红皮病皮损中的表达情况,分析 HBD-1、HBD-2、NF-κBp65 在银屑病红皮病的发生和发展中的作用。
1 材料与方法
1.1 对象来源 病例组:2012年1月—2013年3月30例红皮病继发于银屑病者。女13例,男17例。年龄17~80岁,平均(56.00±16.59)岁。均来自中国医科大学附属第一医院皮肤科,经临床及组织病理证实的银屑病红皮病患者。正常对照皮肤10例,女6例,男 4 例,年龄 20~76 岁,平均(50.66±18.46)岁,来源于中国医科大学附属第一医院整形外科非皮肤疾病患者。
1.2 试剂和研究方法
1.2.1 主要试剂 兔抗人HBD-1,2多克隆抗体以及NF-κBp65多克隆抗体(北京博奥森生物技术有限公司),羊抗兔二抗(河北博海生物工程有限公司),柠檬酸缓冲液,DAB显色剂等。
1.2.2 免疫组织化学方法检测 染色步骤严格按照试剂说明书进行。切片标本经二甲苯脱蜡,梯度乙醇脱水后加50 μL山羊血清,室温孵育20 min。去血清,分别滴加 50 μL的 1∶200稀释兔抗人RBD-1、RBD-2和 NF-κBp65多克隆抗体,4℃过夜。滴加50 μL生物素标记的羊抗兔二抗,室温孵育20 min,滴加50 μL辣根酶标记链酶卵白素工作液,室温孵育20 min。滴加100 μL新鲜配制的DAB,显微镜下观察1~2 min至合适显色。自来水冲洗,苏木精复染,盐酸乙醇分化,自来水冲洗返蓝。梯度乙醇脱水干燥,二甲苯透明,中性树胶封片。
1.2.3 免疫组化结果判断标准 以细胞浆中出现黄色至棕黄色颗粒,着色高于背景底色为阳性,胞浆不着色或呈浅黄色判断为阴性。以染色强度和密度作半定量记录(0~Ⅲ级),0级:阴性或染色弱,整个切片反应率<10%;Ⅰ级:轻度阳性(+),染色弱或部分染色,整个切片反应率10%~20%;Ⅱ级:中度阳性(++),染色清晰,整个切片反应率20%~50%;Ⅲ级:强染色(+++),染色清晰,整个切片反应率>50%。
1.3 统计学方法 组间比较进行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 HBD-1蛋白阳性表达 表现为细胞浆着色,也有细胞核内着色,主要表达于基底层细胞。HBD-1在正常皮肤组织和红皮病皮损组织中表达差异无统计学意义(P>0.05),见表1。证明HBD-1为固有表达,与疾病的发生、发展程度无关。
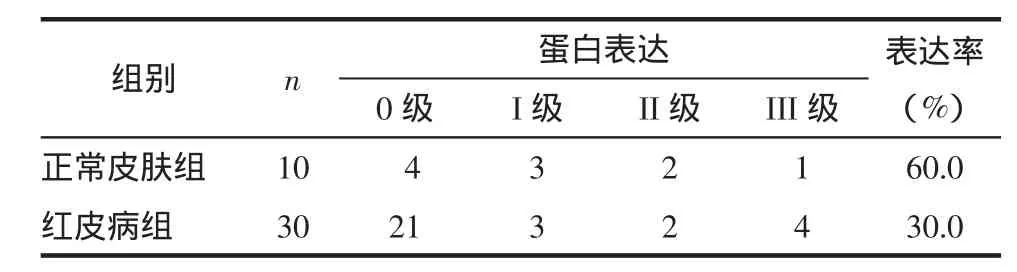
表1 正常皮肤和红皮病皮损组织HBD-1的表达 例
2.2 HBD-2蛋白阳性表达 主要位于基底层细胞膜和细胞浆内,红皮病皮损中HBD-2表达的阳性率为96.67%,正常皮肤表达阳性率20%,2组比较差异有统计学意义(χ2=42.65,P<0.01)。见图 1、2,表 2。
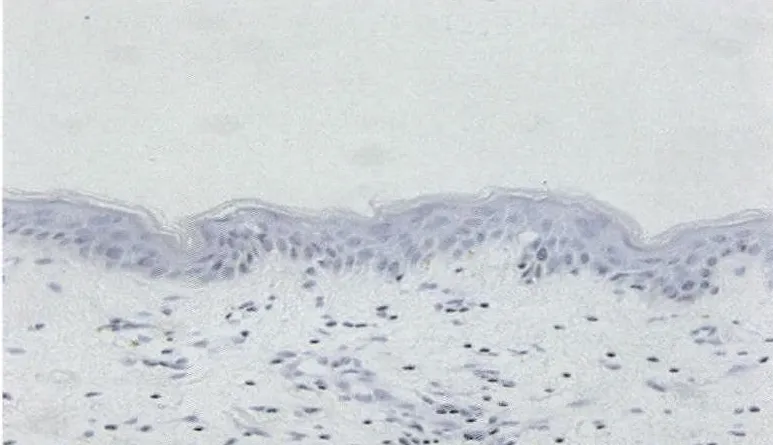
图1 正常皮肤组织HBD-2表达(H E染色×200)

图2 红皮病皮损组织HBD-2表达(H E染色×200)
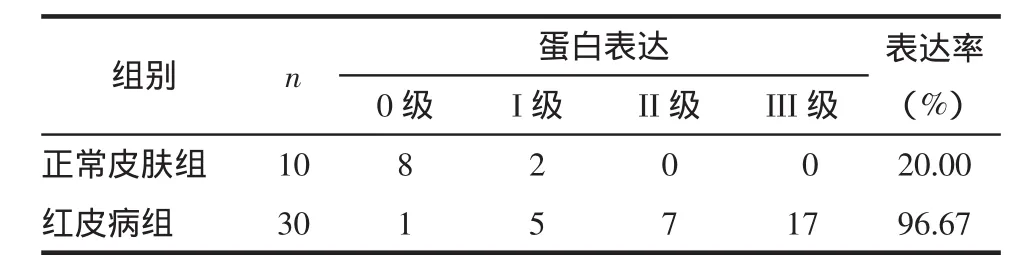
表2 正常皮肤和红皮病皮损组织HBD-2的表达 例
2.3 NF-κBp65表达 正常皮肤组织中,NF-κBp65为阴性表达或部分在细胞浆中表达,表达率20%。在红皮病皮损中,NF-κBp65主要表达于基底层附近区域的细胞浆中,表达的阳性率为93.33%,2组比较差异有统计学意义(χ2=39.44,P<0.01)。见图 3、4,表 3。
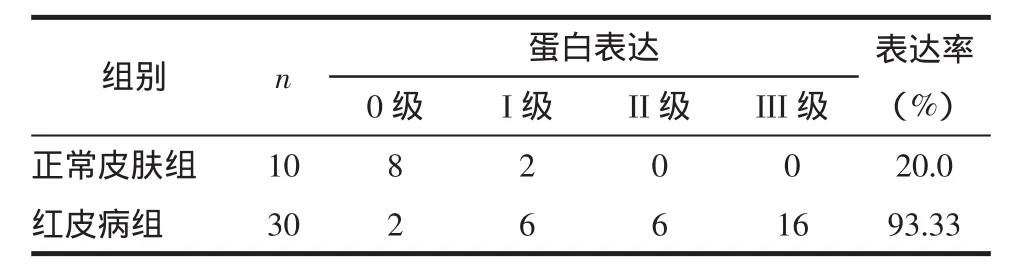
表3 正常皮肤和红皮病皮损组织NF-κB p65的表达 例
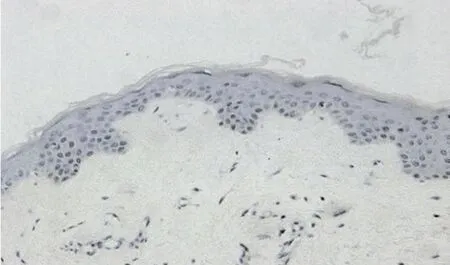
图3 正常皮肤组织NF-κB p65表达(H E染色×200)
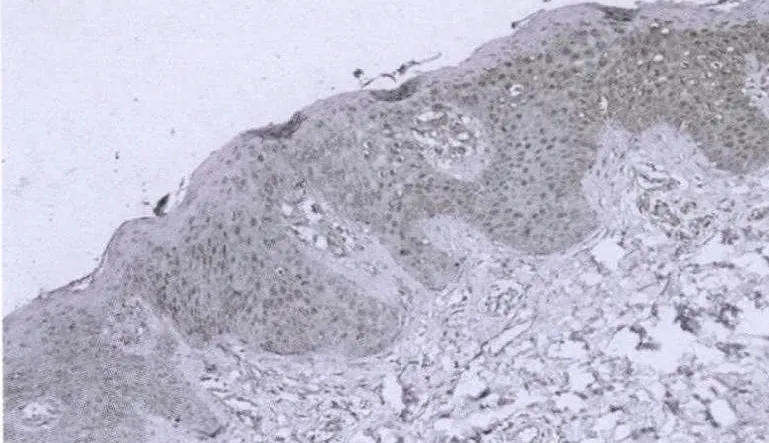
图4 红皮病皮损组织NF-κB p65表达(H E染色×200)
3 讨论
β-防御素不仅具有直接杀伤病原体的作用,还具有化学趋化作用及与其他蛋白酶(如溶菌酶)的协同作用,抗菌活性和对白细胞趋化活性的发挥与组织中所含β-防御素浓度有关[3]。在感染局部,β-防御素被大量诱导表达和释放,经过扩散而浓度降低后,则丧失杀菌活性,发挥趋化活性,募集白细胞到达组织局部以清除入侵病原体[4]。
本研究表明HBD-1在正常组和红皮病组织中均有表达,2 组间差异无统计学意义(P>0.05),证实HBD-1为组成性表达,不受炎症状态的诱导,与多数学者研究结果一致。提示HBD-1主要是维持正常皮肤微生态的稳定,在正常皮肤组织的先天性免疫中起着重要的作用。HBD-2最早是在银屑病患者病灶中发现并分离成功的,因病灶中防御素表达高,故银屑病病灶极少发生感染[5]。HBD-2不仅可直接杀菌而抵御入侵的病原微生物,还在介导获得性免疫、调节炎症反应和创伤修复中起重要作用[6]。研究表明红皮病皮损表皮HBD-2表达部位不仅为基底层,表皮全层均可见棕黄色染色,表达水平显著增强,除与抗微生物活性相关以外,还可能与免疫调节有关。提示HBD-2可能介导了炎症反应,参与了红皮病的发病过程。通常上皮细胞不表达或微量表达HBD-2,但当感染时则大量表达[7]。
有研究表明银屑病皮损处有大量活化的NF-κBp65。Lizzul等[8]研究表明正常皮肤中不存在活化形式的NF-κBp65,银屑病患者非皮损区有少量NF-κBp65,皮损区则存在大量活化形式的NF-κBp65。本研究显示银屑病红皮病皮损区NF-κBp65在表皮上层显著表达,胞核见较深棕褐色颗粒表达,提示NF-κBp65异常表达可能与红皮病的发生、发展过程密切相关。Tsutsumi等[9]用LPS刺激鼠巨噬细胞证实了被激活的NF-κBp65参与了HBD-2的表达。
本研究通过检测HBD-1、HBD-2和NF-κBp65在红皮病皮损及正常皮肤组织中表达情况,探讨三者在红皮病中表达的关系。推测炎症反应及炎症细胞因子可激活NF-κBp65信号通路实现对靶细胞的影响,并通过诱导HBD-2发挥作用,参与银屑病红皮病的发病。
[1] 赵辨.临床皮肤病学[M].第3版.南京:江苏科学技术出版社,2001:756.
[2] Wehkamp K,Schwichtenberg L,Schroder JM,et al.Pseudomonas aeruginosa and IL-1 beta mediated induction of human betadefensin-2 in keratinocytes is controlled by NF-kappaB and AP-1[J].J Invest Dermatol,2006,126:121-127.
[3]BalsR.Epithelial antimicrobialpeptides in hostdefense against infection[J].RespirRes,2000,1:141-150.
[4] DürrM,PeschelA.Chemokinesmeetdefensins:themerging concepts of chemoattractants and antimicrobialpeptides in hostdefense[J].Infect Immun,2002,70:6515-6517.
[5] 常小丽,季必华.β-防御素2与皮肤病[J].国际皮肤性病学杂志,2010,36(6):348-350.
[6] 雷娜,陈献伟,王会,等.防御素-2的生物学作用[J].现代生物学进展,2009,9(9):1761-1763.
[7]Jan Wehkam P,Klaus Fellermann,Klaus R,et al.Human-defensin2 but Not-defensin1 is expressed preferentially in colonic mucosa of inflammatory bowel disease.Eur J Gastroenterol Hepatol,2002,14:745-752.
[8]Lizzul PF,Aphale A,Malaviya R,et al.Differential expression of phosphorylated NF-kappaB/RelA in normal and psoriatic epidermis and downregulation of NF-kappaB in response to [J].Invest Dermatol,2005,124:1275-1283.
[9]Tsutsumi Y,Nagaoka I.NF-kappa B-mediated transcriptional regulation of human beta-defensin-2 gene following lipopolysaccharide stimulation[J].J Leukoc Biol,2002,71:154-162.

