猪脂联素球状结构域gAd 蛋白在重组乳酸乳球菌中表达条件的优化
杨虹坤,刘霭莎,胡文锋,李岩,吴同山,王进军
1(华南农业大学食品学院应用微生物研究室,广东 广州,510642) 2(东莞市畜牧科学研究所,广东 东莞,523320)
脂联素(adiponectin)是动物脂肪细胞分泌的一种蛋白类细胞因子。研究表明,脂联素与肥胖、动脉粥样硬化、胰岛素抵抗、Ⅱ型糖尿病,以及机体能量稳态等方面有密切关系[1-4]。脂联素能够调控动物和人体的能量稳态、葡萄糖代谢和脂肪代谢,是与脂肪沉积呈负相关的脂肪细胞特异性蛋白。猪脂联素蛋白由243 个氨基酸组成,一级序列分析包含4 个功能区:前17 个氨基酸组成的信号肽、23 个氨基酸组成的氨基端非螺旋功能区(N 端)、一段22 个胶原重复序列(包含8 个重复Gly-X-Pro 及14 个重复Gly-XY)组成的胶原区和137 个氨基酸组成的羧基端球状区(C 端)[5]。脂联素在体内循环中以全长型结构(full-length adiponectin,Ad)和较小的C 端球状结构域(globular adiponectin,gAd)两种形式存在[6]。脂联素羧基端的球状区是脂联素蛋白生物活性的关键部位,有研究报道该球状结构域单独作用具有更强的生物活性[7]。
乳链球素表达系统(nisin-control gene expressions,NICE 系统)是一种被广泛研究和运用的乳酸菌食品级诱导表达系统,常以乳链球菌素(nisin)作为目的蛋白表达的诱导剂,而乳链球菌素是运用于食品生产加工中的食品级防腐剂。在NICE 系统的调节过程中,组氨酸激酶nisK 作为nisin 的传感器,nisR蛋白作为反应调节子,激活靶基因的转录。nisR 和nisK 组成双组分调节系统。nisin 存在时,结合到nisK 上,nisK 通过磷酸化激活nisR,被激活的nisR 在nisA 启动子处诱导nisin 操纵子[8-9]。nisK 和nisR基因已经被分离并整合于适当宿主菌的染色体上,nisA 启动子也已被分离并位于质粒载体上。当目的基因被克隆到这个启动子的下游,并被转化进含有nisR 和nisK 的宿主菌中,这个基因的表达便可以通过nisin 来激活。
目前在国内外对脂联素的研究中,对于不同的表达载体,脂联素的表达量不尽相同,张国栋等用大肠杆菌表达系统表达脂联素,结果重组全长脂联素占总细胞蛋白的35%,脂联素球状结构域占总蛋白的22%[10]。王云龙等在脂联素原核表达的研究中,其表达量约占菌体总蛋白的30%[11]。Tullin 等在动物细胞和酵母菌表达分别表达人和鼠脂联素基因时,表达产物经纯化后得到的重组鼠脂联素蛋白含量在10 ~30mg/kg,而人脂联素蛋白在动物细胞核酵母菌表达量为5 ~15 mg/kg[12]。刘霭莎等在乳酸乳球菌中表达了猪脂联素球状结构域基因,通过检测蛋白相对分子质量约为17kDa[13],本文在此基础上进一步研究gAd 基因最佳表达条件,为今后此基因工程菌工业化发酵生产奠定基础。
1 材料和方法
1.1 材料
1.1.1 菌种
刘霭莎等构建的猪脂联素球状区域基因的乳酸乳球菌(Lactococcus lactis)原核表达系统L. lactis NZ9000-gAd[13]。
1.1.2 试剂
M17 肉汤培养基,青岛海博生物公司;氯霉素(Cm)、TEMED、SDS,北京普博欣生物公司;nisin,Sigma 公司产品;蛋白质Marker MP102,天根生化科技公司;30%丙烯酰胺,广州美津生物技术公司。
1.1.3 培养基
表达条件优化试验培养基:改良的M17G 培养基[14]。
培养基优化试验培养基:5%乳糖,1%酵母膏,1.5% 大 豆 蛋 白 胨,1mmol/L MgSO4,0.01g/L Na2HPO4[15],用氯霉素作为抗性选择性标记,pH 值为7。
1.2 方法
1.2.1 菌种活化
将-20 ℃保存的重组L. lactis NZ9000-gAd 接种于M17G 培养基(含5 ng/mL 氯霉素),30 ℃培养48 h。挑取单菌落接种于含5mL M17G(含5ng/mL 氯霉素)液体培养基的试管中,培养12 h。
1.2.2 诱导剂浓度对gAd 蛋白表达的影响
将已活化的菌液接到含M17G(含5ng/mL 氯霉素)液体培养基的试管中,30 ℃培养2.5h 后,加入浓度分别为10ng/mL、20ng/mL、30ng/mL、40ng/mL、50ng/mL、60ng/mL 的诱导剂nisin,诱导培养6h,4 ℃离心收集菌体,经溶菌酶作用1h 后煮沸10 min,离心弃上清,用SDS-PAGE 电泳检测分析,蛋白表达量分析采用BandScan 分析软件。
1.2.3 诱导后培养温度对gAd 蛋白表达的影响
接种操作同上,细胞培养2.5h 后,加入终浓度10ng/mL 的诱导剂nisin 后,分别置于20,25,30,35,40,45 ℃的恒温培养箱中培养6h 后收集菌体,检测方法同上。
1.2.4 诱导时间点( OD) 对gAd 蛋白表达的影响
接种操作同上,接种后于不同时间测定OD600值,分别当OD600≈0.3,0.4,0.5,0.6,0.7 时,加入终浓度为10 ng/mL 的诱导剂nisin,30 ℃培养6h 后,检测方法同上。
1.2.5 乳糖浓度对gAd 蛋白表达的影响
按1% 的接种量分别接种于乳糖浓度为4%、5%、6%、7%、8%的培养基中,将pH 值调至7,30 ℃恒温培养箱中静置5h 后开始诱导,采用已获得的最佳诱导条件,用SDS-PAGE 检测目的蛋白表达情况。
1.2.5 氮源浓度对gAd 蛋白表达的影响
基础培养基中由于使用非单一氮源,而是酵母膏与大豆蛋白胨的复合氮源,因此在进行氮源筛选前,研究了酵母膏与大豆蛋白的最佳配比,为1∶2(酵母膏∶大豆蛋白胨)。将氮源总浓度设定为2%、3%、4%、5%、6%。培养条件同上。
1.2.6 磷酸盐浓度对gAd 蛋白表达的影响
将基础培养基中的Na2HPO4浓度设定为0.1%、0.15%、0.2%、0.25%、0.3%,将pH 值调至7,培养条件同上。
1.2.7 无机盐浓度对gAd 蛋白表达的影响
将已活化的菌种按1%的接种量分别接种于Mg-SO4浓度为0.01%、0.02%、0.03%、0.04%的基础培养基中,培养条件同上。
2 结果与分析
2.1 诱导剂浓度对gAd 蛋白表达的影响
结果如图1 所示,采用BandScan 分析软件得出gAd 蛋白在nisin 浓度为20ng/mL 时蛋白表达量最高。从20ng/mL 开始随着诱导剂Nisin 浓度的升高目的蛋白表达量反而降低,说明过高的浓度会抑制蛋白的表达,nisin 是一种天然防腐剂,具有一定的抑菌作用,浓度过高时诱导后菌体量明显降低。因此可以确定诱导剂nisin 的最佳浓度为20 ng/mL。

图1 不同诱导剂浓度对蛋白表达影响的SDS-PAGE 分析图Fig.1 Results of SDS-PAGE electrophoresis for the amount of added nisin
2.2 诱导后培养温度对gAd 蛋白表达的影响
结果如图2 所示gAd 蛋白在诱导后培养温度为25 ℃时表达量最高,从25 ℃开始随着温度的升高,蛋白表达量反而降低。诱导后培养温度是影响蛋白表达量的重要因素之一,若温度过低菌体生长缓慢,新陈代谢速度也随之降低,细胞活性降低,不利于细胞合成外源蛋白;若温度过高,菌体培养后期容易衰老自溶,合成的外源蛋白不稳定。因此可知重组乳酸菌的最佳诱导后的培养温度为25 ℃。
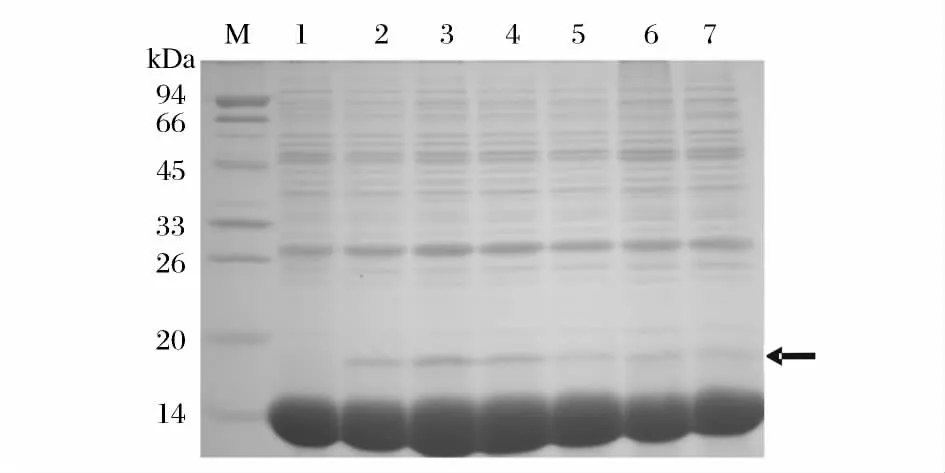
图2 不同诱导后培养温度对蛋白表达影响的SDS-PAGE 分析图Fig.2 Results of SDS-PAGE electrophoresis for the induction temperature
2.3 诱导时间点对gAd 蛋白表达的影响
结果如图3 所示,gAd 蛋白在OD600为0.4 时表达量相对较高。菌体密度影响蛋白的表达,一般菌体密度与蛋白表达量成正相关关系。过早表达外源蛋白不利于菌体的生长,影响菌体密度,并且表达外源蛋白对菌体本是一种负载,而且过量表达会引发细胞产生应激反应[16]。由此得出当OD600为0.4 时为最佳的诱导菌体密度。

图3 不同诱导时间点对蛋白表达影响的SDS-PAGE 分析图Fig.3 Results of SDS-PAGE electrophoresis for the time point of induction
2.4 乳糖浓度对gAd 蛋白表达的影响
结果如图4 所示,在乳糖浓度为7% 时gAd 蛋白的表达量最高。乳糖的浓度对细胞生长有很大的影响,浓度过低不利于细胞的生长,菌体得不到足够的营养生长受到抑制,浓度过高会产生反馈抑制作用,引起菌体异常,对菌体代谢、产物合成及氧的传递会产生不良影响[17],细胞在最适营养环境中正常生长,得到较高的细胞密度,是获得蛋白高效表达的保障。由此可知脂联素重组乳酸菌的最佳碳源浓度为7%。

图4 不同乳糖浓度对蛋白表达影响的SDS-PAGE 分析图Fig.4 Results of SDS-PAGE electrophoresis for the concentration of lactose
2.5 氮源浓度对gAd 蛋白表达的影响
结果如图5 所示,在氮源浓度为3%时获得的gAd 蛋白表达量较高。氮源浓度对菌体生长以及合成蛋白有极显著影响。如果一次性投入氮源过多,易引起菌体生长过盛而使培养基的营养成分过早耗尽,导致菌体过早衰老而自溶,缩短蛋白合成时间;反之氮源浓度过低,菌体生长和蛋白的合成均停止[18]。由此可确定重组乳酸菌的最佳氮源浓度为3%。
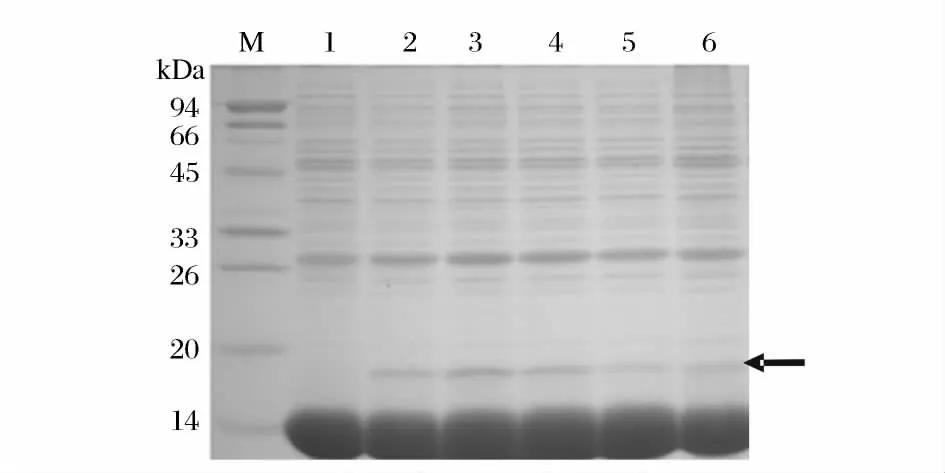
图5 不同氮源浓度对gAd 蛋白表达影响的SDS-PAGE 分析图Fig.5 Results of SDS-PAGE electrophoresis for the concentration of nitrogen source
2.6 磷酸盐(Na2HPO4)浓度对gAd 蛋白表达的影响
结果所图6 所示,在Na2HPO4浓度为0.25%时的蛋白表达量较高,磷酸盐的含量影响菌体的生长及基因产物的表达,基质中磷酸盐的含量影响表达质粒的复制速度[19]。当磷酸盐含量低时由于不能满足生长需求,菌体密度过低;当浓度过高时,早期菌体旺盛,导致菌体过早衰老,菌体密度依然不能达到较高值。乳酸菌发酵的终产物主要是乳酸,在同型发酵产酸的过程中,乳酸积累到一定的量,会使pH 值降低,影响其生长环境,抑制菌体的生长[20]。由此可以确定Na2HPO4的最佳浓度为0.25%。

图6 不同Na2HPO4 浓度对gAd 蛋白表达的SDS-PAGE 分析图Fig.6 Results of SDS-PAGE electrophoresisfor the concentration of Na2HPO4
2.7 无机盐(MgSO4)浓度对gAd 蛋白表达的影响
结果如所7 所示,当MgSO4浓度为0.02%时蛋白表达量最高。Mg2+对性细胞活性起到很大作用,是细胞进行新陈代谢时,酶的催化剂,适量的Mg2+能促进细胞的生长,加速各种代谢途径中酶的催化反应,但是过高的Mg2+浓度会造成细胞对金属离子中毒,而不利于菌体生长。因此确定脂联素重组乳酸菌的最适MgSO4浓度为0.02%。

图7 不同MgSO4 浓度对gAd 蛋白表达影响的SDS-PAGE 分析图Fig.7 Results of SDS-PAGE electrophoresis for the concentration of MgSO4
2.8 诱导表达条件正交实验的结果
根据单因素试验得到的结果选择三个水平进行正交试验,试验结果见表1,极差R 值大小顺序为:B(温度)>A(诱导剂浓度)>C(诱导时间点),较优的诱导条件组合是A3B2C2。因此,最终确定脂联素重组乳酸乳球菌的最佳诱导条件为:诱导剂nisin 的浓度为30 ng/mL、诱导后培养温度为25 ℃、诱导时间点为OD600为0.4。

表1 诱导表达条件正交试验结果及其极差分析Table 1 Results of orthogonal experiment of induction conditions and analysis of its range
2.9 培养基优化的正交实验结果
根据单因素试验得到结果选择3 个水平进行正交试验,试验结果见表2,极差的大小顺序为:B(氮源浓度)>A(乳糖浓度)>D(MgSO4浓度)>C(Na2HPO4浓度)。所以由正交试验得出的最佳培养基组合为A2B3C2D2。因此,最终确定脂联素重组乳酸乳球菌的最佳培养基组分为:乳糖浓度7%、氮源浓度 4%、Na2HPO4浓 度 0.25%、MgSO4浓 度0.02%。

表2 培养基优化正交试验结果及其极差分析Table 2 Results of orthogonal experiment of cultural medium and analysis of its range
3 结论
重组基因工程菌表达条件的优化,一般都是从诱导条件和营养条件方面进行,诱导剂浓度及诱导时菌体密度会影响外源蛋白的表达水平,菌体密度一般控制在菌体的对数生长期或对数中后期。乳酸乳球菌的最适生长温度是在30 ℃,而质粒稳定和目的蛋白的诱导温度大多为25 ℃,因此基因工程菌的发酵过程可分为生长和表达两个阶段,有利于提高细菌的生长密度和重组产物的表达量。要获得高效表达目的蛋白,培养基各组分的浓度和比例要适当,过量的营养物质反而会抑制菌体的生长,特别是碳源和氮源浓度。本文从以上几个方面对重组脂联素乳酸乳球菌进行了优化,最终蛋白表达量达到29.4%,为今后工业化生产脂联素基因工程菌提供了数据。
[1] 高小亚,戈敏娟,马向华. 单纯性肥胖患者血清瘦素、抵抗素和脂联素水平的研究[J]. 医学研究生学报,2006,19(6):544 -547.
[2] 卜瑞芳,吴文君,邓振霞,等. 脂联素基因多态性和血清脂联素水平与2 型糖尿病的相关研究[J]. 医学研究生学报,2007,20(3):285 -289.
[3] Ekmekci H,Ekmekci O B. The role of adiponectin in atherosclerosis and thrombosis[J]. Clinical and Applied Thrombosis-Hemostasis,2006,12(2):163 -168.
[4] Luo N L,Liu J,Chung B H,et al. Macrophage adiponectin expression improve insulin sensitivity and protects against inflammation and atherosclerosis [J]. Diabetes,2010,59(4):791 -799.
[5] Jocobi S K,Ajuwon K M,Weber T E,et al. Cloning and expression of porcine adiponectin,and its relationship to adiposity,lipogenesis and the acute phase response[J].Endocrinology,2004,182(3):133 -144.
[6] Scherer P E,Williams S,Fogliano M,et al. A novel serum protein similar to C1q,produced exclusively in adipocytes[J]. The Journal of Biological Chemistry,1995,270(31):849 -856.
[7] Waki H,Kamon J,Kia S,et al. Generation of globular fragment of adiponectin by leukocyte elastase by monocytic cell line THP-1 [J]. Endocrinology,2005,146 (18):790 -796.
[8] Neu T,Henrich B. New thermosensitive delivery vector and its use to enable nisin-controlled gene expression in Lactobacillus gasseri[J]. Applied and Environmental Microbiology,2003,69(3):1 377 -1 382.
[9] Kuipers O P,Ruyter PGGA de,Kleerebezen M M,et al.Quorum sensing controlled gene expression in lactic acid bacteria[J]. Journal of Biotechnology,1998,64(1):15-21
[10] 张国栋. 猪脂联素基因的染色体定位克隆原核表达抗血清制备及体内表达调控研究[D].武汉:华中农业大学,2004 :26 -27
[11] 王云龙,李永超,昌静峰,等. 人脂联素原核表达纯化及活性检测[J]. 动物医学进展,2011(10):36 -39.
[12] Tullin S,Sams A,Brandt J,et al. Recombinant adiponectin does not lower plasma glucose in animal models of type 2 diabetes[J]. Endocrinology,2012,7(10):270-279.
[13] 刘霭莎,李岩,胡文锋,等. 猪脂联素球状结构域gAd 基因在乳酸乳球菌中的表达[J]. 畜牧兽医学报,2012,43(3):353 -357.
[14] Dodd H M,HAO Z. Improved medium for lactic streptococcus and their bacteriophages[J]. Applied and Environmental Microbiology,1992,8(11):3 683 -3 693.
[15] Mierau I,Kees O,James M,et al. Optimization of the Lactococcus lactis nisin-controlled gene expression system NICE for industrial applications[J]. Microbial Cell Factories,2005,4(16):546 -515.
[16] Thumm G,Gotz F. Studies on prolysostaphin processing and characterization of the lysostaphin immunity factor(Lif)of Staphylococcus simulans biovar staphylolyticus[J]. Molecular Microbiology 1997,23(58):1 251 -1 265.
[17] Jean P G,Franc O,etal. Purification and characterization of conjugated bile salt hydrolase from Bifidobacterium longum BB536[J]. Applied and Environmental Microbiology,1995,15(38):2 577 -2 582.
[18] 刘慧,杜薇,张红星. 乳酸乳球菌乳酸亚种高产胆盐水解酶发酵条件的优化研究[J].食品科学,2006,27(11):322 -326.
[19] 徐皓,李民,阮长庚,等. 高密度发酵生产突变型重组人肿瘤坏死因子rhTNFа-DK2 的研究[J]. 工业微生物,1998,28(2):20 -25.
[20] Kashket E R. Bioenergetics of lactic acid bacteria:cytoplasmic pH and osmotolerance[J]. Microbiology Reviews 1987,46(4):233 -244.

