发酵法制备大豆肽的工艺优化及其抗氧化能力*
杨洁芳,刘会平,俞佳,王淑,王浩
(天津科技大学食品工程与生物技术学院,天津,300457)
肽(pepetides)是α -氨基酸以肽键形式连接而成的化合物,它是蛋白质水解的中间产物[1],具有优于大豆蛋白的食品功能性和生物活性。工业生产中主要的制备方法是复合酶解法,利用内切酶将大豆蛋白水解成分子量较小的肽,再由外切酶将疏水性氨基酸从多肽链的末端切下来。但酶解法产肽率相对较低,成本较高,而且得到的终产品往往带有明显的苦味[2],限制了酶解法在多肽生产中的应用。目前常用的脱苦方法有活性炭吸附[3],超滤[4],β-环糊精包埋[5],蛋白酶优选[6],但这些方法都有一定的弊端,比如增加生产成本以及必需氨基酸的损失。
发酵法是一种集制备与脱苦于一体的高效方法[7],肽段在微生物代谢活动中产生的混合酶作用下释放,同时微生物也借助多肽提高生长代谢及产酶能力,循环协作,效率更高[8],而且产品的风味、色泽等感官特性均优于酶法水解的产物[9],增强了其在食品中的应用。同时,固态发酵法具有节水节能,低能耗的优点,有利于现代规模化生产。本实验通过实验确定了高产大豆肽的工艺,并对肽粗品进行抗氧化能力的测定,旨在为大豆肽的工业生产和应用提供理论依据。
1 材料与方法
1.1 主要原材料
大豆分离蛋白(蛋白质86.51%),大豆肽粉(浅黄色粉末,吸湿性强,短肽含量156.05 mg/g)购自北京山松生物制品有限公司。
枯草芽孢杆菌(Bacillus subtitles)1398:由天津科技大学食品学院菌种保藏室提供。
1.2 化学试剂与培养基
1,1-二苯基-2-苦基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),Gly-Gly-Tyr-Arg 标准品:美国Sigma公司产品。
菌种计数及传代培养基:牛肉膏0.5%,蛋白胨1.0%,NaCl 0.5%,pH 7.2,固体时加琼脂2.0%。121 ℃灭菌15 ~20 min。
种子培养基:牛肉膏0.5%,蛋白胨1.0%,NaCl 0.5%,pH 7.2,121 ℃灭菌15 ~20 min。
1.3 实验方法
1.3.1 肽含量的测定
取0.1 g 干燥并研磨好的发酵产物,加入2.5 mL蒸馏水,于60 ℃水浴条件下浸提30 min。取等体积的10% TCA 加入到浸提液中,4 000 r/min 离心15 min,去除酸不溶性蛋白和长链肽沉淀。取3.0 mL 上清液于1 号试管中,0 号试管加3 mL 蒸馏水做参比,然后向2 支试管中分别加入2.0 mL 双缩脲试剂,充分混匀,静置10 min,1 000 r/min 离心10 min,在可见光分光光度计上,调节波长为540 nm,测定吸光度。重复操作3 次。

式中:c—多肽的浓度;n—稀释倍数;v—多肽液的体积;w—多肽的质量。
1.3.2 平均肽链长度的测定[10]
采用甲醛滴定法,在水解度较高时,水解度与平均肽链长度关系大约表示为:
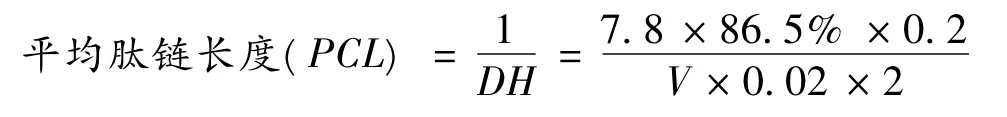
1.3.3 粗多肽抗氧化能力的测定
将干燥的发酵产物溶于10 倍水溶液中,于55 ℃水浴锅中恒温浸提60 min,将上层溶液先用定性滤纸抽滤,得到较为澄清的肽混合液,再用0.22 μm 微孔滤膜进行微滤,得到粗多肽溶液。将此溶液进行真空旋转蒸发,得到粗肽浓缩液,再分装至平皿中进行冻干,并进行抗氧化能力的测定(DPPH·[11]、O2-·[12]、·OH[13]清除能力)。
2 结果与讨论
2.1 发酵法制备大豆蛋白活性肽工艺优化
2.1.1 蔗糖添加量对大豆肽的影响
以大豆分离蛋白为基础培养基,分别添加0.5%、1.0%、1.5%、2.0%、2.5%的蔗糖进行单因素实验。
由图1 可知,平均链长随着蔗糖添加量的增加先增加后减少,而肽含量先略微增加后显著下降,过量的碳源不但不能完全被微生物所利用,而且会影响菌种产酶水解蛋白的能力,使短肽水解成单个氨基酸的趋势增强,而蛋白水解成短肽的趋势减弱,当蔗糖添加量达到2.0%后,短肽水解成单个氨基酸的程度大于蛋白水解成肽的程度,使得短肽含量和平均链长均显著下降。综合两个指标的考虑,选择蔗糖添加量为1.0%为最优。

图1 蔗糖添加量对大豆肽的影响Fig.1 Effect of sucrose content on soybean peptides
2.1.2 水分添加量对大豆肽的影响
选择40%、60%、80%、100%、120%的水分添加量[14],接种量2.0%,36 ℃发酵培养48 h,进行加水量的单因素实验。
由图2 可知,随着水分添加量的增加,大豆蛋白逐渐被水解成更短的肽链,而肽含量先增加后有降低的趋势,2 个指标均在加入多于60%的水后变化不大,说明水分添加量不足会严重影响菌种生长及代谢能力,而水分添加量达到60%以后,短肽水解成单个氨基酸的程度略大于蛋白水解成短肽的程度。水分添加量60%条件下,氧气含量比较适合菌种的生长和酵解作用且能耗小不易污染,所以选择水分添加量60%为最佳值进行下面的单因素实验。

图2 水分添加量对大豆肽的影响Fig.2 Effect of water content on soybean peptides
2.1.3 接种量对大豆肽的影响
加入确定量的蔗糖和水,选择1.0%、2.0%、3.0%、4.0%、5.0%的接种量,在36 ℃条件下发酵48 h,进行接种量的单因素实验。
由图3 可知,随着接种量的增加,蛋白逐步被酵解成短肽,在接种3.0%时达到最短,肽含量变化则呈先上升后下降的趋势,同样在接种3.0%时达到最大。说明接种量小,过量的碳氮源不能被充分利用,造成浪费。但接种量过大,水分及养分不能满足细菌的生长代谢,菌种之间也会相互抑制,造成酶解产肽量显著下降。所以选择接种量3.0%为最佳的接种量。

图3 接种量对大豆肽的影响Fig.3 Effect of inoculation dose on soybean peptides
2.1.4 发酵温度对大豆肽的影响
加入确定量的蔗糖和水,接种3.0%的枯草芽孢杆菌,分别在24、28、32、36、40 ℃条件下发酵48 h,进行发酵温度的单因素实验。
由图4 可知,枯草芽孢杆菌在28 ~36 ℃生长良好,温度低于28 ℃,菌种生长代谢缓慢,产肽量较小,高于28 ℃后,含肽量逐渐减小。而平均链长随着温度的升高先减小后增加,在32 ℃时达到最小值。说明32 ℃条件下菌种生长代谢处于最佳状态,能够最大程度的产生较短的小肽,超过这一温度,菌种生长代谢作用受抑制,内切作用大于外切作用。综合2 个指标考虑,选择32 ℃为最优条件。

图4 发酵温度对大豆肽的影响Fig.4 Effect of incubation temperature on soybean peptides
2.1.5 发酵时间对大豆肽的影响
加入确定量的蔗糖和水,接种确定量的枯草芽孢杆菌,在一定温度下发酵24、36、48、60、72 h,进行发酵时间的单因素实验。
由图5 看出,随着发酵时间的延长,菌种逐渐将蛋白分解成短肽甚至单个氨基酸,肽含量在36 h 时达到最大。而平均链长不断减小,到48 h 后基本不变,说明时间过长,菌种进入衰亡期,产酶能力下降。综合两个指标,选择发酵36 h 为最佳。以此为依据设计正交实验。

图5 发酵时间对大豆肽的影响Fig.5 Effect of incubation time on soybean peptides
2.1.6 优化发酵工艺的正交实验
经过分析上面单因素实验结果,设计了5 因素4水平正交实验,实验结果见表1。

表1 L16(45)正交实验设计及结果Table 1 L16(45)orthogonal experimental design and results
根据正交实验结果,各个因素对肽含量的影响顺序依次为:接种量>蔗糖添加量>水分添加量>发酵温度>发酵时间。最优条件为:蔗糖添加量0.5%,水分添加量70%,接种量2.0%,32 ℃条件下发酵32 h。进行验证性实验,测得短肽含量为252.95 mg/g。
各个因素对平均肽链长度的影响顺序依次为:水分添加量>发酵温度>蔗糖添加量>接种量>发酵时间,最优条件为:蔗糖添加量2.0%,水分添加量80%,接种量3.0%,32 ℃条件下发酵48 h。水分添加量对平均肽链长度的影响最显著,水分既是微生物生长代谢必需的物质,又是酶水解蛋白质的必要条件,水分添加量过低,对菌种的生长代谢和酶的水解作用都不利,但过高的水分又会使氧气含量下降,不利于菌的生长。进行验证性实验,测得平均肽链长度为4.0。

表2 方差分析表Table 2 Table of variance analysis (n=5)
综合2 个指标考虑,以肽含量为终指标时用料更省,发酵周期更短,更利于工业生产需要。
2.2 各样品的抗氧化能力
向体内补充抗氧化剂,清除过多的自由基或中止体内自由基反应,可防止线粒体肿胀和抑制膜的脂质过氧化反应、蛋白质交连、多糖的降解等的发生,对保护生物膜结构与功能的完整性,抑制自由基诱发的疾病和增强体质以及治疗疾病都有重要意义。各样品的DPPH·、O2-·和·OH 清除率见表3。

表3 样品DPPH·、O2-·和·OH 清除能力Table 3 DPPH·,O2-· and ·OH clearance capacity of each sample
由表3 看出,市售肽与发酵肽均有一定的DPPH·、O2-·和·OH 清除能力,且发酵肽3 种自由基清除率较市售品分别提高了119.53%,26.02% 和65.56%。说明发酵法制备大豆肽这一工艺更好的激发和保留了其中的抗氧化活性成分,有效提高了肽的自由基清除能力。
3 结论
本试验以大豆肽含量以及平均肽链长度为指标,通过单因素实验和正交实验,对发酵法制备大豆肽的工艺进行了优化。确定最优工艺条件:蔗糖添加量0.5%,水分添加量70%,接种量2.0%,32 ℃条件下发酵32 h,此条件下测得短肽含量为252.95 mg/g;蔗糖添加量2.0%,水分添加量80%,接种量3.0%,32 ℃条件下发酵48 h,此条件下测得平均肽链长度为4.0。发酵肽的DPPH·,O2-·和·OH 清除率分别为45.18%,55.50%和57.63%,较市售肽分别提高了119.53%,26.02%和65.56%。结果表明,发酵法制备大豆肽这一工艺有效的提高了肽的产率以及样品的抗氧化能力。
[1] 赵芳芳.大豆肽的生物学功能研究[D].北京:中国农业大学,2004.
[2] 庞宗文,李敏,李树波,等. 产蛋白酶毛霉的分离筛选及发酵豆粕产大豆肽的初步研究[J]. 现代食品科技,2010,26(9):956 -961.
[3] 万琦,陆兆新,高宏. 脱苦大豆多肽产生菌的筛选及其水解条件的优化[J]. 食品科学,2003,24(2):29 -31.
[4] Helbig N B,Ho L,Christy G E,et a1. Debittering of skim milk hydrolysates by adsorption for incorporation into acidic bevervages[J]. J Food Sci,1980,45(2):331 -335.
[5] Hou L,Wang J,Zhang D. Optimization of debittering of soybean antioxidant hydrolysates with β-cyclodextrins using response surface methodology [J]. J Food Sci Technol,2013,50(3):521 -527.
[6] Nishiwaki T,Yoshimizu S,Furuta M,et a1. Debittering of enzymatic hydrolysates using an aminopeptidase from the edible basidiomycete Grifola frondosa [J]. J Biosci Bioeng,2002,93(1):60 -63.
[7] Ichimura T,Hu J,Aita D Q,Maruyama S. Angiotensin Iconverting enzyme inhibitory activity and insulin secretion stimulative activity of fermented fish sauce[J]. J Biosci Bioeng,2003,96(5):496 -499.
[8] Frias J,Song Y S,Martinez -Villaluenga C,et a1. Immunoreactivity and amino acid content of fermented soybean products[J]. J Agric Food Chem,2008,56(1):99 -105.
[9] Tan T W,Zhang M,Wang B W,et a1. Screening of high lipase producing Candid and production of lipase by Fermentation[J]. Process Biochemistry,2003,39(4):459-465.
[10] 李建杰,荣瑞芬. 复合酶解制备核桃多肽工艺条件的优化[J]. 中国油脂,2011,36(1):22 -26.
[11] Naciye Erkan,Guler Ayranci,Erol Ayranci. Antioxidant activities of rosemary (Rosmarinus Officinalis L)extract,blackseed (Nigella sativa L.)essential oil,carnosic acid,rosmarinic acid and sesamol[J]. Food Chemistry,2008,110(1):76 -82.
[12] Chobert J M,Bertrand-Hard C,Nicolas M G. Solubility and emulsifying properties of caseins and whey proteins modified enzimatically by trypsin [J]. J Agri Food Chem,1988,36(5):883 -892.
[13] 王振宇. 红松松仁抗氧化肽的制备及抗氧化活性评价[J]. 食品与发酵工业,2010,36(7):78 -82.
[14] 张吉鹍. 多菌种组合固态发酵法生产大豆肽蛋白饲料[J]. 江西饲料,2011(1):1 -4.

