不同贮藏温度下大目金枪鱼鲜度及组胺变化*
刘书臣,廖明涛,赵巧灵,林森森,戴志远,2
1(浙江工商大学水产品加工研究所,浙江 杭州,310012)
2(浙江省水产品加工技术研究联合重点实验室,浙江 杭州,310012)
金枪鱼(tuna),又名鲔鱼、吞拿鱼,是一种生活在海洋中上层,分布在太平洋、大西洋和印度洋的热带、亚热带和温带广阔水域的高度跨洋性的洄游鱼类[1]。金枪鱼肉质柔嫩鲜美,蛋白质含量高,氨基酸配比优越,富含DHA、EPA 等具有生物活性的高度不饱和脂肪酸,是世界营养学会推荐的3 大营养鱼之一,有“海底鸡”的美誉。大目金枪鱼是金枪鱼属中产量仅次于黄鳍金枪鱼的种类,占全球金枪鱼产量的10%左右,年产量约45 万吨,常以生鱼片、罐头的形式食用,具有极高的发展潜力。
鱼类和甲壳类水生动物具有易腐败的特性,许多指标已经被用来对鱼类的鲜度进行判定,包括感官评定、K 值、TVB-N 和菌落总数等[2-4]。金枪鱼除了具有易腐败的特性以外,其体内还含有较多的游离组氨酸,当鱼捕捞后,若不能进行迅速、正确的处理,在产组胺菌的作用下,鱼肉中的组氨酸经过脱羧作用会产生大量的组胺[5-6],组胺摄入量达8 ~40 mg 即可引起人体轻微中毒。已有的研究表明,温度对组胺的产生影响非常大[7]。目前国内外有关金枪鱼保鲜的研究较少,现有的研究主要集中在冻藏中的质量变化方面,而且关于温度对大目金枪鱼组胺变化影响的研究也极为少见。随着我国远洋渔业的发展和人民生活水平的提高,大目金枪鱼的消费需求越来越高,有关大目金枪鱼鲜度和组胺变化的研究显得尤为重要。本研究以大目金枪鱼背部肌肉为研究对象,以感官评定、K 值和菌落总数为指标研究温度对大目金枪鱼鲜度变化的影响,同时研究不同贮藏温度下大目金枪鱼肉中组胺的变化。旨在帮助消费者食用安全优质的金枪鱼,同时为金枪鱼的精深加工提供一定的理论依据。
1 材料与方法
1.1 实验材料
大目金枪鱼背部肌肉,购自宁波丰盛食品有限公司,放于-50℃冰箱冻藏备用。
1.2 主要试剂与仪器
组胺标准品、ATP 关联物(ATP、ADP、AMP、IMP、HxR、Hx)标准品、丹磺酰氯,均购自Sigma 公司;甲醇、乙腈为色谱纯,购自美国TEDIA 公司;其余试剂均为市售分析纯。
冰箱,青岛海尔股份有限公司;2695 高效液相色谱仪,美国waters 公司;Mili-Q 超纯水机Gradient 型,美国Millipore 公司;Ultra-Turrax T18 basic 均质机,德国IKA;RC-6 Plus 高速冷冻离心机,美国热电仪器有限公司;SW-CJ-IFD 超净工作台,上海博讯实业有限公司医疗设备厂。
1.3 实验方法
1.3.1 样品贮藏实验
取冻藏于-50℃冰箱的冷冻鱼块放入40℃、4%的盐水中预解冻5 min,用布片吸去鱼块表面的水分,放入4℃冷藏室进行1 h 均温处理[1]。将处理后的金枪鱼块切成5 ×2 ×0.5 cm 的鱼片,然后置于不同条件下进行贮藏实验,以鱼肉中心温度达到各贮藏温度时开始实验。0℃每2 天取样,4℃每天取样,15℃每12 h 取样,25℃每6 h 取样,用于感官评定,菌落总数、K 值和组胺含量的测定。所有分析均取3 个平行样。
1.3.2 感官评定
金枪鱼片的感官评定参照Nejib Guizani[8]的方法,并作修改。根据实验需要,从色泽、质地和气味3方面进行感官评价。由6 位经过培训的感官评定人员组成感官评定小组,对金枪鱼片的色泽、质地、气味进行评价并打分,综合评分为1 ~7 分,7 分品质最好,1 分最差,4 分为可接受界限,低于4 分则表示不能食用。
1.3.3 菌落总数测定
称取25 g 金枪鱼肉于225 mL 生理盐水中,无菌条件下均质,制成10-1稀释液,再进行梯度稀释制成10-2~10-7稀释液,根据样品腐败程度取合适倍数的稀释液各1 mL 于无菌平皿,并将冷却至46℃的平板计数培养基倾注平皿,于30 和15℃分别培养3 d 和5 d 后进行嗜温菌和嗜冷菌的计数。
1.3.4 K 值测定
参考Yokoyama 的方法略有改动[9]。
ATP 关联物的提取:准确称取5.0 g 搅碎后的金枪鱼肉于50 mL 离心管中,加入10 mL 10%高氯酸溶液,均质,在4℃下离心(8 000 r/min,10 min),取上清液。再用10 mL 5%高氯酸溶液重复提取2 次,离心,合并上清液。用KOH 溶液将其调至pH6.4,于4℃下静置30 min。过滤除去高氯酸钾结晶后,用超纯水定容至50 mL,再用孔径为0.22 μm 的薄膜过滤,整个过程在0 ~4℃条件下进行。
ATP 关联物的HPLC 测定:色谱柱Sunfire C18,用pH6.4 的0.05 mol/L K2HPO4和0.05 mol/LKH2PO4(v∶v,1∶1)混合液平衡、洗脱,进样量10 μL,流速0.8 ml/min,检测波长254 nm。根据标准品的保留时间定性,采用外标法进行定量。
最终分解产物HxR 和Hx 所占总的ATP 关联物的百分数即为鲜度指标K 值,可按下面公式计算:
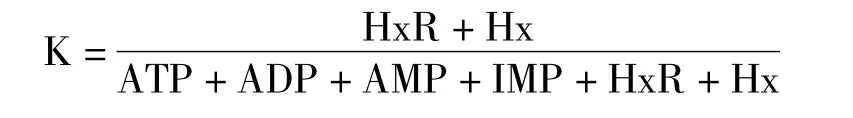
式中ATP、ADP、AMP、IMP、HxR、Hx 分别代表腺苷三磷酸、腺苷二磷酸、腺苷酸、肌苷酸、次黄嘌呤核苷、次黄嘌呤的浓度(μg/mL)。
1.3.5 组胺测定
根据出入境检验检疫行业标准(SNT2209 -2008)进出口水产品中有毒生物胺的检测方法-高效液相色谱法进行测定。
2 结果和分析
2.1 K 值变化
大目金枪鱼背部肌肉在0、4、15 和25℃下贮藏的K 值变化如图1 和图2 所示,金枪鱼肉的初始K值为14%。一般认为作为生鱼片的新鲜鱼K 值在20%以下,K 值≤60%作为加工原料的鲜度标准[10]。0℃下贮藏的鱼肉K 值呈缓慢的线性增长(2.6% /d,r2=0.97),在第16 天时达到57%,其贮藏的优质期为2 d,货架期为16 d;在4℃条件下,K 值增长速度较快(6.3% /d,r2=0.98),优质期为1 d,货架期为6 d,第8 天时K 值达到64%;15℃条件下的K 值变化与0℃、4℃条件下不同,K 值增长迅速(18.6% /d,r2=0.98),经过60 h 鱼肉中的K 值就达到64%,不能食用,优质期为12 h;25℃下贮藏的金枪鱼肉的K 值增长极为迅速(46.7% /d,r2= 0.96),36h 后达到87%,货架期仅为24 h,优质期为6h。金枪鱼肉的初始K 值比较高,可能是由于金枪鱼采用的是钓杆和围网捕捞方式,在捕获的过程中鱼挣扎剧烈,进而影响了鱼肉的初始K 值[8]。
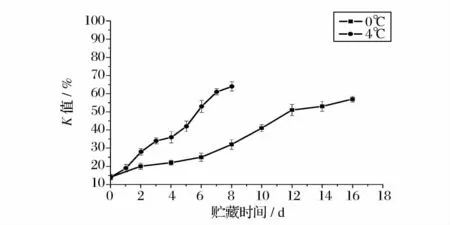
图1 大目金枪鱼在0℃、4℃下贮藏的K 值变化Fig.1 Changes of K value in big eye tuna during storage at 0,4℃

图2 大目金枪鱼在15℃、25℃下贮藏的K 值变化Fig. 2 Changes of K value in big eye tuna during storage at 15℃、25℃
金枪鱼肉的K 值在0℃、4℃下的缓慢增长和15℃、25℃下的迅速增长的差异体现了温度对K 值变化的影响。鱼死后其体内的ATP 发生分解,分解按ATP→ADP→AMP→IMP→HxR→Hx 途径进行。肌苷酸(IMP)的分解对K 值的影响较大,IMP 是在5-核苷酸酶的作用下分解的,而这种酶在0℃条件下只能维持大约6d 的稳定,之后就会慢慢失活。0℃和4℃条件下鱼肉K 值增长缓慢就是由于低温降低了5-核苷酸酶的活性导致的,本实验结果与Boyle[11]研究的冷藏鱼肉K 值变化结果相似。Fraser[12]的研究表明,在5 ~25℃下IMP 的分解和HxR 的生成速度很快,这正好解释了在15℃和25℃下金枪鱼肉K 值迅速增长的现象。大目金枪鱼在0℃下的货架期比Nejib Guizani[8]研究的黄鳍金枪鱼(12d)和Chang[13]所研究的海鲈鱼(8d)要长;但优质期远低于Ehira[14]研究的日本黑鲷鱼(12 d)。
2.2 菌落总数变化
大目金枪鱼背部肌肉在0、4、15 和25℃下贮藏期间的菌落总数变化如图3 和图4 所示。四个贮藏温度下金枪鱼肉中的嗜温菌和嗜冷菌的菌落总数均呈增长趋势,而且贮藏时间和贮藏温度对菌落总数的增长影响差异性显著(P<0.05)。在0℃和4℃贮藏条件下,贮藏初期低温抑制了鱼肉中微生物的生长,菌落总数变化比较平缓,嗜温菌占据优势地位;随着贮藏时间的延长,蛋白质、糖类等物质的分解为微生物的增长提供了良好的条件,微生物适应低温环境,生长速度加快,嗜冷菌的增长速度高于嗜温菌的增长速度,并逐渐占据优势。15℃和25℃下贮藏的鱼肉中,嗜温菌和嗜冷菌的增长速度明显高于0℃、4℃下贮藏的鱼肉,在经历了短暂的延滞期之后就进入了对数生长期,嗜温菌始终占据优势地位。我国国标(GB18406.4 -2001)规定的水产品中细菌总数应≤106个/g(cfu/g),以菌落总数106cfu/g 为货架期终点,0、4、15 和25℃下贮藏的大目金枪鱼货架期分别为14 d、6 d、24 h 和12 h。
新鲜金枪鱼肉中的菌落总数表明了鱼类从热带和亚热带海域中捕捞时嗜温菌是占主导地位的,这一结果与Shewan[15]发现的从印度洋温水海域中捕获的鱼类中嗜温性的革兰氏阳性菌占优势是一致的。本研究中,4 个贮藏温度下鱼肉货架期的显著差异表明了低温能有效抑制微生物的生长,但并不能使微生物死亡,在适应了低温条件后微生物的增长速度逐渐加快,这一结果与李学英[16]研究的大黄鱼菌落总数变化结果相似。
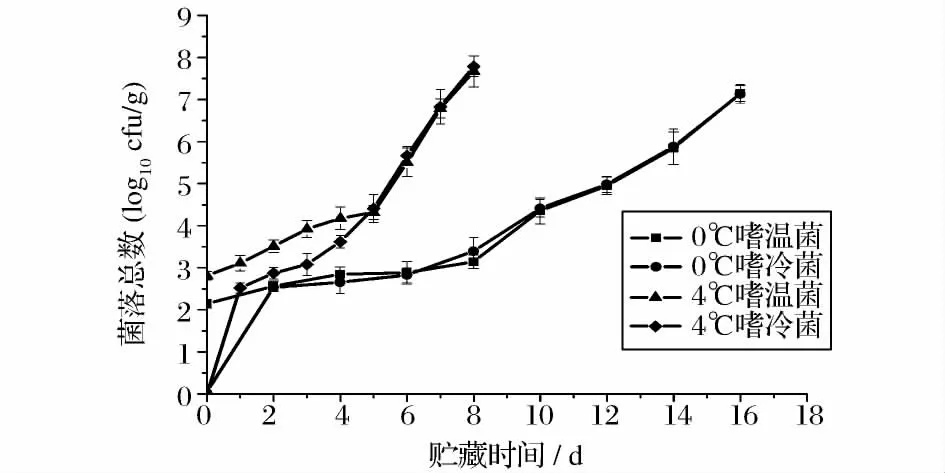
图3 大目金枪鱼在0℃、4℃下贮藏的菌落总数变化Fig.3 Changes of total viable count in big eye tuna during storage at 0℃、4℃

图4 大目金枪鱼在15℃、25℃下贮藏的菌落总数变化Fig.4 Changes of total viable count in big eye tuna during storage at 15℃、25℃
2.3 感官评定分析
大目金枪鱼在0、4、15 和25℃下贮藏期间的感官评定结果如图5 和图6 所示。温度对感官评定结果的影响显著(P<0.5),在0、4、15 和25℃下贮藏的大目金枪鱼被感官拒绝的时间分别为10 d、5 d、36 h和12 h。鱼肉被感官评定员判定为不可食用的时候,0℃和4℃鱼肉中的菌落总数并未超过我国海水鱼类卫生标准规定的二级鲜度(106cfu/g)指标,鱼肉这么早的被感官评论员拒绝说明不仅菌落总数对鱼肉的货架期有影响,其他的一些因素包括菌的种类、鱼肉自溶、生化特性以及贮藏条件也对鱼肉货架期有影响。图7 所示为不同贮藏温度下大目金枪鱼肉感官评定结果与K 值含量之间的关系。感官评定得分随着K 值的增长而降低,两者之间有良好的线性关系,R2=0.935 9。这一结果与Neijib Guizani[8]的研究结果相似,Neijib Guizani 研究发现黄鳍金枪鱼在0、8 和20℃贮藏过程中K 值变化与感官评定之间存在一定的线性关系。
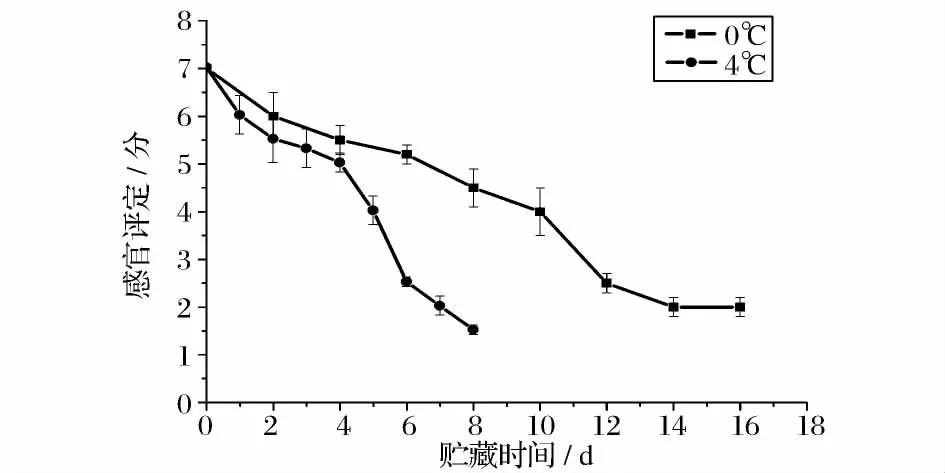
图5 大目金枪鱼在0℃、4℃下贮藏过程中的感官评定分析Fig.5 Sensory evaluation of big eye tuna during storage at 0,4℃
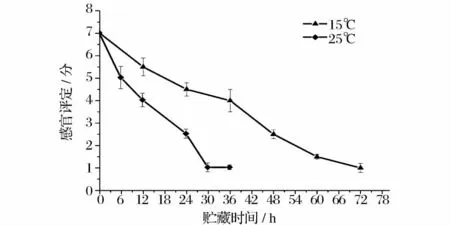
图6 大目金枪鱼在15℃、25℃下贮藏过程中的感官评定分析Fig.6 Sensory evaluation of big eye tuna during storage at 15,25℃
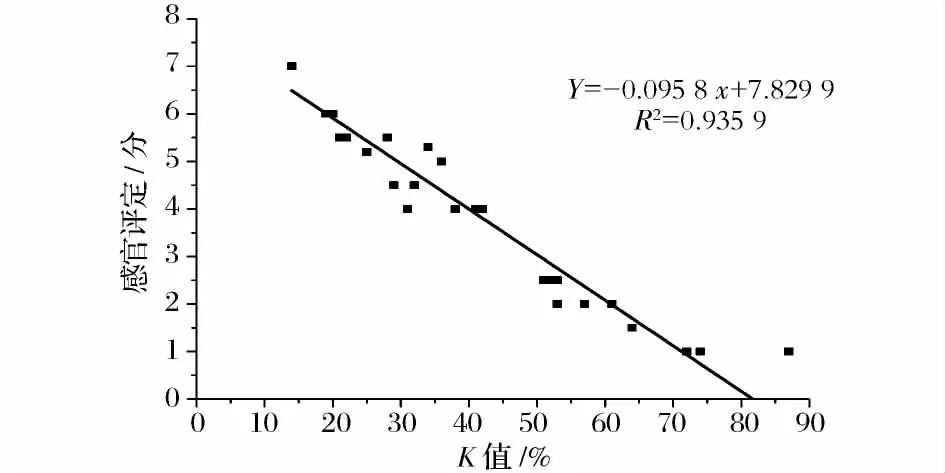
图7 不同温度下鱼肉感官评定结果与K 值的关系Fig.7 Relationship between sensory scores of big eye tuna and K values at different temperatures
2.4 组胺含量变化
大目金枪鱼背部肌肉在0、4、15 和25℃下贮藏期间的组胺含量变化如图8 和图9 所示。0℃贮藏条件下,金枪鱼肉在第12 天时开始产生组胺,16 d 后组胺含量为9.8 mg/100 g。4℃条件下,鱼肉在贮藏初期也未检测到组胺,在贮藏5d 之后组胺开始产生,第8 天时组胺含量达到17.2 mg/100 g。大目金枪鱼背部肌肉在15℃贮藏条件下组胺含量增长较快,24 h后鱼肉中组胺含量为12.1 mg/100 g,72 h 之后达到88.6 mg/100 g。25℃条件下鱼肉中组胺的增长速度最快,经过36 h 贮藏之后,鱼肉中组胺含量达到
23 2.5 mg/100 g。
以国标(GB2733 -2005)规定的海水鱼组胺含量少于30 mg/100 g 为判定指标,大目金枪鱼背部肌肉在15℃和25℃条件下贮藏的货架期分别为48 h 和24 h;而0℃和4℃条件下组胺含量到贮藏期结束都没有超标。这一显著性差别与温度和微生物的生长有密切的关系,能够产生组胺的微生物大多为嗜温菌,在0℃和4℃下这些微生物的生长受到抑制,组胺脱羧酶的活性降低,产组胺的能力下降,组胺增长缓慢;Okuzumi[17]研究发现能够产生组胺的微生物如Proteus morganii 等在20 ~30℃下增长速度非常快,因此产组胺微生物在15℃和25℃下快速繁殖是大目金枪鱼组胺增长迅速的主要原因。本实验结果与Lopez-Sabater[18]的研究结果相似,Lopez-Sabater 研究发现在20℃条件下,蓝鳍金枪鱼肉组胺增长速度较快,保质期仅仅为1 d,在8℃条件下鱼肉的保质期为4 d。而Nejib Guizani[8]研究发现黄鳍金枪鱼在0℃贮藏条件下鱼肉中的组胺含量逐渐降低,经过17d 的贮藏期之后,组胺从初始的2.78 mg/100 g 降为0.61 mg/100 g。Sato[19]等认为组胺的产生不仅仅与产组胺菌有关,还跟组胺降解菌有关,在5℃条件下鱼肉中组胺在达到最高浓度后会逐渐降低直到消失。而本实验中不同温度下鱼肉中的组胺含量均未出现降低趋势,这可能与鱼肉中微生物和实验条件的差异有关。
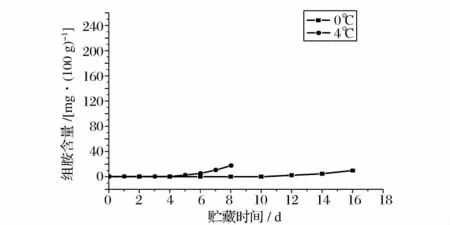
图8 大目金枪鱼在0℃、4℃下贮藏的组胺含量变化Fig.8 Changes in content of histamine in big eye tuna during storage at 0℃、4℃
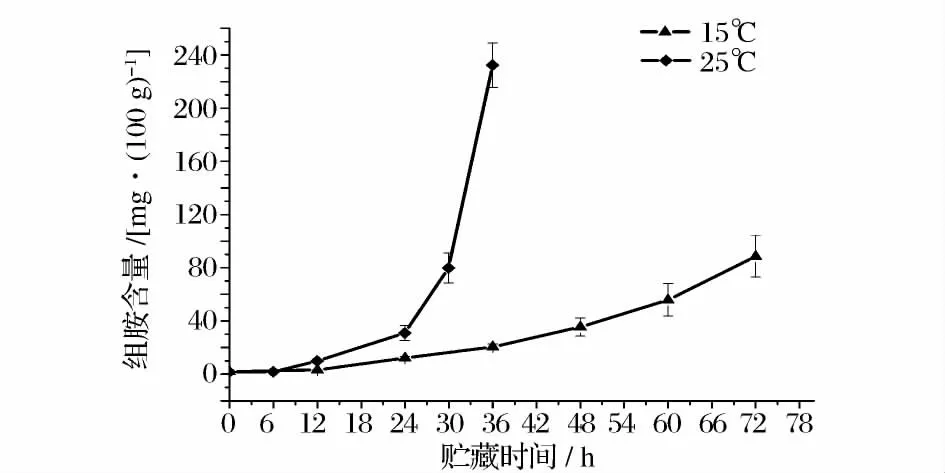
图9 大目金枪鱼在15℃、25℃下贮藏的组胺含量变化Fig.9 Changes in content of histamine in big eye tuna during storage at 15℃、25℃
3 结论
实验结果表明,贮藏温度对大目金枪鱼背部肌肉的鲜度变化影响显著,综合K 值、菌落总数等生化指标和感官评定结果,大目金枪鱼背部肌肉在0、4、15和25℃下贮藏的货架期分别为10 d、5 d、24 h 和12 h。感官评定得分随着K 值的增长而降低,两者变化之间具有良好的线性关系。温度对大目金枪鱼背部肌肉组胺变化影响较大,低温能抑制产组胺菌的生长,降低组胺脱羧酶的活性,鱼肉组胺含量增长缓慢,而15℃和25℃下鱼肉中组胺增长迅速,分别在第48 h 和24 h 超过30 mg/100 g。以上研究表明低温贮藏能减缓鲜度降低的速率,延长大目金枪鱼的货架期,同时也能抑制组胺的增长,防止组胺中毒事件的发生。
[1] 苗振清,黄锡昌. 远洋金枪鱼渔业[M]. 上海:科学技术文献出版社,2003.
[2] Gram L,Huss H H. Microbiological spoilage of fish and fish products[J]. International Journal of Food Microbiology,1996,33(1):121 -137.
[3] Malle P,Poumeyrol M A. A new chemical criterion for the quality control of fish:trimethylamine/total volatile basic nitrogen(%)[J]. Journal of Food Protection,1989,52(6):419 -423.
[4] Saito T,Arai K,Matsuyoshi M. A new method for estimating the freshness of fish[J]. Bulletin of the Japanese Society of Scientific Fisheries,1959,24(9):749 -750.
[5] Shalaby A R. Significance of biogenic amines to food safty and human health [J]. Food Research International,1996,29(7):675 -690.
[6] Chang S C. Determination of histamine and bacterial isolation in swordfish fillets (Xiphias gladius)implicated in a food borne poisoning[J]. Food control,2008,19(1):16-21.
[7] Arnold S H,Price R J,Brown W D. Histamine formation by bacteria isolated from skipjack tuna (Katsuwonus pelamis)[J]. Bulletin of the Japanese Society of Scientific Fisheries,1980,46(8):991 -995.
[8] Nejib Guizani. The effect of storage temperature on histamine production and the freshness of yellowfin tuna (Thunnus albacares)[J]. Food Research International ,2005,38(2):215 -222.
[9] Yokoyama Y,Ssakaguchi M,Kawai F,et a1. Changes in concentration of ATP-related componds in various tissues of oyster during ice storage[J]. Nippon Suisan Gakkaishi,1992,58(11):2 125 -2 136.
[10] 沈月新. 水产食品学[M]. 北京:中国农业出版社,2001:80.
[11] Boyle J,Lindsay R,Stuiber D. Adenine nucleotide degradation in modified atmosphere chill-stored fresh fish[J]. Journal of Food Science,1991,56(5):1 267 -1 270.
[12] Fraser D,Pitts D,Dyer W. Nucleotide degradation and organoleotic quality in fresh and thawed mackerel held at and above ice temperature[J]. Journal of the Fisheries Research Board of Canada,1968,25 (2):239 -253.
[13] Chang K,Chang J,Shiau C,et al. Biochemical,microbiological,and sensory changes of sea bass (Lateolabrax japonicus )under partial freezing and refrigerated storage[J]. Journal of Agricultural and Food Chemistry,1998,46(2):682 -686.
[14] Ehira S,Uchiyama H. Freshness-lowering rate of cod and sea bream viewed from changes in bacterial count,total volatile base and trimethylamine-nitrogen,and ATP related compounds[J]. Bulletin of the Japanese Society of Scientific Fisheries,1974,40(5):479 -487.
[15] Shewan J. The bacteriology of fresh and spoiling fish and the biochemical changes induced by bacterial action[J].Proceedings of the Conference on Handling,Processing and Marketing of Tropical Fish ,1997,5:51 -66.
[16] 李学英,许钟,郭全友,等. 大黄鱼冷藏过程中的鲜度变化[J]. 中国水产科学,2009,16(3):442 -450.
[17] Okuzumi M,Yamanaka H. Changes in numbers of histamine – forming bacteria on/in common Mackerel stored at various temperatures[J]. Bulletin of the Japanese Society of Scientific Fisheries,1984,50 (4):653 -657.
[18] Lopez-Sabater E,Rodriguez-Jerez J. Sensory quality and histamine formation during controlled decomposition of tuna (Thunnus thynnus)[J]. Journal of Food Protection,1995,59(2):167 -174.
[19] Sato T,Fujii T. Changes in numbers of histamine-metabolic bacteria and histamine content during storage of common mackerel [J]. Fisheries Science,1994,60(3):299 -302.

