马齿苋多糖提取工艺优选及活性初筛*
米热班古·木太力甫,敬思群
(新疆大学生命科学与技术学院,新疆 乌鲁木齐,830046)
马齿苋(Portulace deraceaL.)属马齿苋科马齿苋属1 年生肉质草本植物[1-3]。马齿苋全草含有L-去甲肾上腺素、多巴明以及少量多巴、脂肪酸、氨基酸类、维生素、黄酮类和多糖[4-6]。具有明显的抗癌抗衰老、治疗糖尿病、降血脂、预防冠心病、高血压、肥胖症、抑制肿瘤细胞生长及延长细胞寿命的作用[7-9]。研究表明,马齿苋多糖是马齿苋的主要功能成分之一[10-11]。文中对马齿苋多糖的提取工艺及其抗氧化活性进行了研究。
1 材料与方法
1.1 主要材料、试剂与仪器
新鲜马齿苋,新疆源森农业开发有限公司提供;纤维素酶(40 000 U/g),购于杰诺生物科技有限公司;三氯甲烷、正丁醇、丙酮、浓H2SO4、KI、苯酚、Na2HPO4、柠檬酸等化学试剂,均为分析纯;AL104 分析天平,Mettler-Toledo Group;FW-100 粉碎机,北京市永光明医疗仪器厂;RE-52AA 旋转蒸发器,上海亚荣生化仪器厂;AnkeTDL-5-A 离心机,上海安亭科学仪器厂FZ102;SIM 真空冷冻干燥设备,德国西门子公司;KQ-250DE 型数控超声波清洗器,昆山市超声仪器有限公司;722S 型分光光度计,上海安亭科学仪器厂;VER-TEX70 型红外光谱分析仪,BRUKER 公司。
1.2 马齿苋多糖提取工艺流程
马齿苋→清洗、自然干燥→粉碎过80 目筛→石油醚脱脂→加酶超声辅助提取→离心取上清液→Sevage 法除蛋白→减压浓缩→乙醇沉淀→过滤洗涤→冷冻干燥→马齿苋多糖干粉
1.2.1 操作要点
新鲜马齿苋原料经挑选清洗、自然干燥后用万能粉碎机粉粹并过80 目筛得马齿苋粉待用。称取6 g马齿苋粉置于索氏提取器中,加入石油乙醚(60 ~90℃)200 mL,90℃回流脱脂7h;脱脂之后加入体积分数80%乙醇,90℃回流2 次(每次2 h),除去单糖、多酚、低聚糖和皂苷等小分子物质;乙醇挥发后,在添加一定量的纤维素酶时按照不同的浸提时间、浸提温度和超声功率进行马齿苋多糖提取。将得到的马齿苋多糖溶液经离心取上清液,用旋转蒸发仪真空浓缩,加95%的乙醇析出多糖,沉淀物用蒸馏水复溶后再加95%的乙醇醇析,反复3 次,将沉淀用无水乙醇洗涤,真空干燥,得马齿苋水溶性多糖。采用Sevage法[12]去除提取马齿苋多糖中的蛋白质,少量蒸馏水溶解马齿苋多糖,按粗多糖溶液与三氯甲烷-正丁醇(体积比4∶1)混合液以体积比5∶1 混合,充分振荡30 min 静止分层,4 200 r/min 离心15 min,将中间液面白色物质和下层的有机溶剂除去。用旋转蒸发器将上清液减压浓缩至原液的1/4 ~1/5,向浓缩液加入4倍体积的无水乙醇析出多糖,在室内放置过夜,然后5 000 r/min 离心15 min,收集沉淀,沉淀物用蒸馏水复溶后再加体积分数95%乙醇醇析,反复3 次,将沉淀物再分别以无水乙醇、丙酮、乙醚回流洗涤,得棕黄色粗提物经冷冻干燥后即得马齿苋粗多糖。
1.3 马齿苋多糖提取得率的计算
多糖含量测定采用硫酸-苯酚比色法,其标准曲线制作方法参考文献[13],得线性回归方程为:Y=0.064X-0.001(Y:吸光度,X:糖含量)。r=0.996 5,线性范围0.0 ~1.0 mg/mL。
1.3.1 马齿苋多糖提取得率的计算
W/% =m1/m2×100,式中:W为马齿苋多糖的提取得率,%;m1为提取得到的马齿苋多糖质量,g;m2为原料质量,g。
1.4 不同单因素对加酶超声辅助提取马齿苋多糖的影响
将用2.5%纤维素酶酶解后的提取液经灭酶后,在超声功率为70 W,温度为60℃的条件下,分别提取10、15、20、25 和30 min,研究超声时间对马齿苋多糖提取率的影响;将用2.5%纤维素酶酶解后的提取液经灭酶后,在超声功率为70 W,时间为20 min 时,分别在30、40、50、60 和70℃的温度条件下提取,研究超声温度对马齿苋多糖提取率的影响;将用2.5%纤维素酶酶解后的提取液经灭酶后,在超声时间为20 min,温度为60℃条件下,提取的超声功率分别为50、60、70、80 和90 W,研究超声功率对马齿苋多糖提取率的影响。
1.5 马齿苋多糖的光谱分析[14]
分别取2 mg 加酶超声处理和传统水提醇沉处理的2 组马齿苋多糖干燥样品,与200 mg 干燥的KBr粉末在红外灯下于玛瑙钵中轻轻研磨均匀,研磨均匀的粉末经压片机压成薄片后即可上机测定。测定条件:在500 ~4 000 cm-1内,扫描累积次数64 次,分辨率4.0 cm-1,采集样品的红外光谱谱图。
1.6 多糖抗氧化活性的测定
1.6.1 总抗氧化能力的测定
操作方法按总抗氧化能力(T-AOC)测定试剂盒说明书进行。
总抗氧化能力(U/mg 样液)= (ODU - ODC)/0.01 ÷30 ×N÷Cprot,式中:ODU 为测定管吸光度值;ODC 为对照管吸光度值;N 为反应体系稀释倍数(反应液总体积/取样体积);Cprot 为待测样液浓度(mg/mL)。
1.6.2 对·OH 的清除作用[15]
按艾百拉·热合曼等的方法进行测定。
1.6.3 马齿苋多糖对DPPH 的清除率
将多糖母液稀释到浓度分别为0.01、0.03、0.05、0.1、0.2、0.4、0.6、0.8、1.0 mg/mL,取各浓度样液2 mL,分别加入2 mL 2 ×10-4mol/L 的DPPH乙醇溶液,摇匀后室温下反应30 min,在517 nm 处测定吸光值Ai,空白组以等体积无水乙醇代替DPPH溶液,对照组以等体积蒸馏水代替多糖溶液,并以等体积蒸馏水和无水乙醇混合液作空白调零,并以Vc为阳性对照。对DPPH 的清除率计算公式[16]:
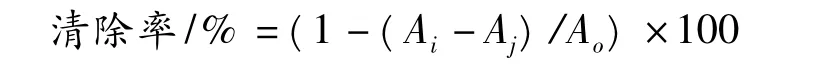
式中:Ao,为对照组吸光值;Ai,为样品组吸光值;Aj,为空白组吸光值。
2 结果与分析
2.1 酶用量确定
在温度45℃时,调节pH 为3.5,酶解2.0h 的条件下,分别以1.0%、1.5%、2.0%、2.5%、3.0%的添加量加纤维素酶,考察酶用量对马齿苋多糖提取率的影响。结果如图1 所示。
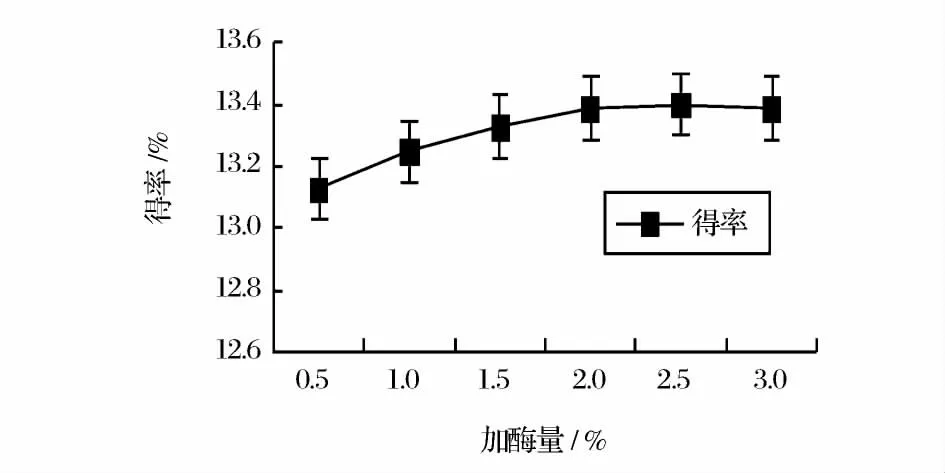
图1 加酶量对马齿苋多糖提取得率的影响Fig.1 Effect of cellulase amount on the extraction yield of purslane polysaccharides
由图1 可知,随着纤维素酶用量的增加,马齿苋多糖提取率在酶用量为2.5%时最大,但多糖提取率的增加不明显,这可能是因为酶添加量增加,其他成分也被纤维素酶酶解溶出,使多糖得率反而下降。
2.2 加酶超声辅助提取马齿苋多糖的单因素试验
由图2 可知,随着超声时间的延长,马齿苋多糖的提取得率不断增加,当超声时间在20min 后随着时间的继续延长,提取得率增长趋势变缓,因此最适超声时间为20min;由图3 可知,马齿苋多糖的提取得率在30 ~70℃之间随着温度的升高而逐渐增加,在60℃时达到最大值后随着温度的继续升高提取得率有下降趋势。温度过高提取率反而下降的原因可能是超声温度过高时马齿苋多糖结构会发生部分变性,影响提取率,因此最适超声温度为60℃;由图4 可知,随着超声功率的增加,马齿苋多糖的提取得率提高,在70W 时马齿苋多糖的提取得率达到最大值,增大功率,马齿苋多糖提取得率反而下降,这可能是因为超声功率太大会导致其他成分也被分解出来和影响多糖结构被破坏,则提取得率降低。因此,最适超声功率为70W。

图2 超声时间对马齿苋多糖提取得率的影响Fig.2 Effect of ultrasonic treatment time on the extraction yield of purslane polysaccharides
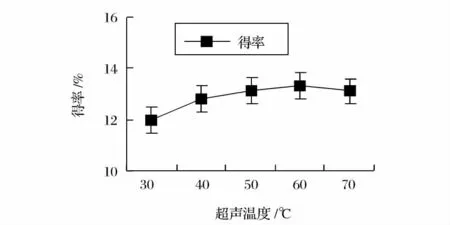
图3 超声温度对马齿苋多糖提取得率的影响Fig.3 Effect of temperature on the extraction yield of purslane polysaccharides
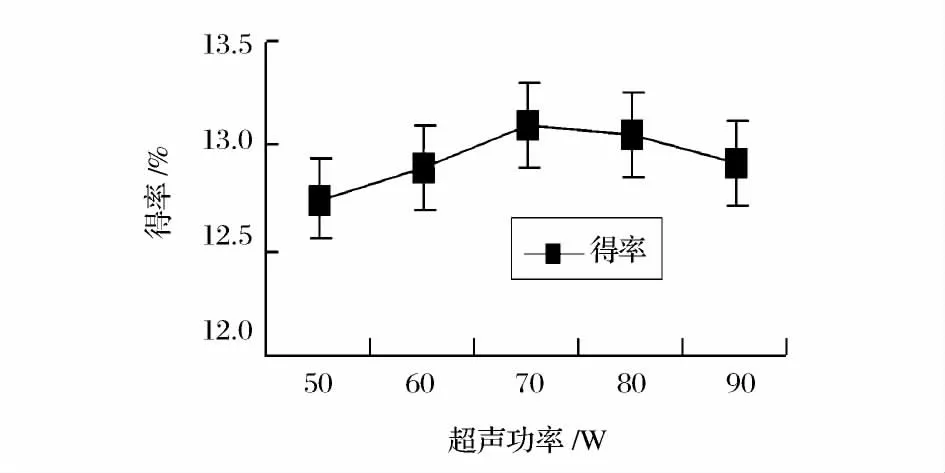
图4 超声功率对马齿苋多糖提取得率的影响Fig.4 Effect of ultrasonic power on the extraction yield of purslane polysaccharides
2.3 加酶超声辅助提取马齿苋多糖的正交试验
在纤维素酶提取马齿苋多糖单因素试验的基础上,选取超声时间、温度、功率以及酶用量为试验因素,以提取率和纯度为试验指标,选用L9(34)正交表进行试验。每个试验组合重复3 次,结果取其平均值。用正交设计助手Ⅱv3.1.1 统计软件进行结果分析,结果见表1 和表2。

表1 正交试验结果表Table 1 Orthogonal experiments result
由表1 知,各因素对提取得率的影响顺序为A >B >C,即超声时间>超声温度>超声功率。比较k值的大小可以看出,马齿苋多糖提取工艺的优化条件是A2B2C1,即超声时间20 min,超声温度60℃,超声功率70 W。验证试验得到马齿苋多糖提取得率为18.40%;而在本实验室经试验,用传统水提醇沉工艺在提取温度95℃,提取时间2 h,料液比1 ∶12(g∶mL),浸提次数3 次的条件下得到马齿苋多糖的提取得率仅为9.87%,可见利用加酶超声技术可提高马齿苋多糖提取得率。

表2 对提取率的方差分析表Table 2 Variance analysis of the extraction rate
由表1、表2 可知,超声时间对提取得率在所考察的范围内影响显著,而超声温度和功率对提取得率在所考察的范围内影响不显著,因为马齿苋角质层比较厚并且纤维素含量普遍较高,其多糖分离出来的影响较大,其次超声温度和功率变化会引起其解离状态的变化。超声波可以破碎阻碍多糖溶出的细胞壁,可使植物结构变得松散,使多糖便于溶出,缩短提取时间和周期,有利于植物多糖的浸出。
2.4 加酶和超声技术对马齿苋多糖结构影响评价[17
在500 ~4 000 cm-1波段范围内分别扫描加酶超声处理和采用传统水提醇沉提取得到的2 种马齿苋多糖样品,将红外光谱谱图进行叠加就得到叠加效果图(图5)。

图5 两组马齿苋多糖红外光谱叠加效果图Fig.5 Overlay effect of two groups polysaccharide in the infrared spectrum
由图5 中可以看出,2 组光谱图的重叠效果很好,说明2 组多糖分子结构不存在显著差异,所以酶解和超声技术对马齿苋多糖结构无显著影响。又可知纤维素酶只对马齿苋肥厚的特殊表皮有溶解作用而没有改变马齿苋多糖的结构(红色为未经加酶超声处理,黑色为经过加酶超声处理的马齿苋多糖)。
2.5 马齿苋多糖的抗氧化活性的测定
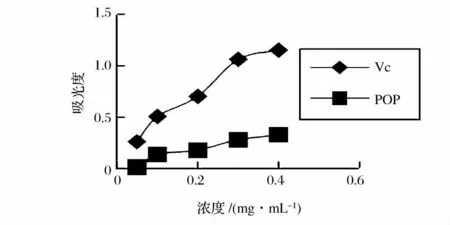
图6 马齿苋多糖总抗氧化能力的测定Fig.6 Determination of the total antioxidant capacity of the purslane polysaccharide
由图6 可知,Vc 和马齿苋多糖的总抗氧化能力都随着浓度的增大吸光度也逐渐增大,样品液浓度和Vc 浓度都在0.05 ~0.4 mg/mL 时马齿苋多糖的吸光度值小于Vc 的吸光度,总体来看马齿苋多糖的总抗氧化能力比Vc 的总抗氧化能力弱;由图7 可知,随着马齿苋多糖浓度的增加,马齿苋多糖清除自由基能力增强,马齿苋多糖和Vc 清除率达到50%所需浓度(IC50)分别约为0.460、0.219 mg/mL。这说明马齿苋多糖的自由基清除力与马齿苋多糖浓度相关,它对·OH 自由基有清除作用,但弱于Vc;由图8 可知,马齿苋多糖对DPPH·清除能力随着马齿苋多糖浓度增大,清除DPPH·能力呈一定的量效关系。马齿苋多糖对DPPH·的清除效果稍弱于Vc,其IC50为0.492mg/mL,而Vc 的IC50为0.331 mg/mL。
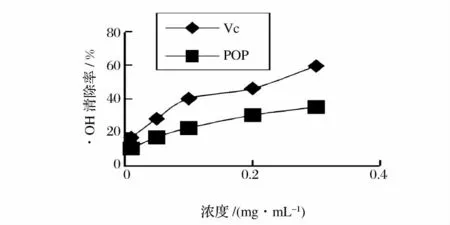
图7 马齿苋多糖对·OH 的清除率Fig.7 Scavenging activities of purslane polysaccharides against the hydroxyl free radicals
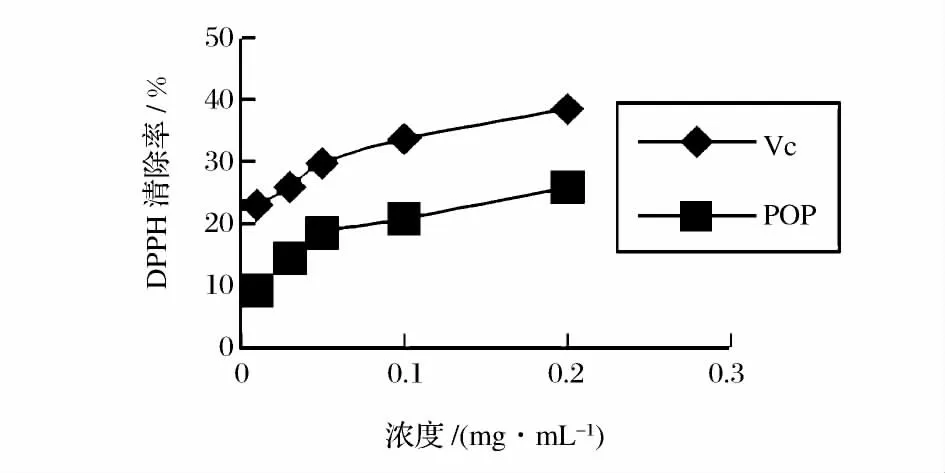
图8 马齿苋多糖对DPPH 的清除率Fig.8 Scavenging activities of purslane polysaccharides against the DPPH free radicals
3 结论
加酶超声提取马齿苋多糖的最佳工艺条件为:加酶量为2.5%,提取温度为60℃,提取时间20 min,提取功率70W,在此条件下,多糖提取得率为18.40%。采用加酶超声技术均可提高马齿苋多糖提取得率,但对马齿苋多糖的结构没有显著影响,因此利用加酶超声辅助提取马齿苋多糖手段是高效可行的。本实验室结果表明马齿苋多糖具有较好的抗氧化性,且在试验的浓度范围内,该多糖总抗氧化能力、对·OH 和DPPH 的清除作用呈现出线性关系。马齿苋多糖对各种形式的活性氧均有清除作用,并且清除率与浓度有关。
[1] 石丽敏,郭勇,楼削成. 食药两用植物马齿苋的研究现状[J]. 黑龙江农业科学,2010(1):115 -116.
[2] Chen Juan,Shi Yan-ping,Liu Jing-yan.Determination of noradrenaline and dopamine in Chinese herbal extracts from Portulace oleracea L. by high-performance liquid chromatography[J].Journal of Chromatography ,2003,1 003(1):127 -132.
[3] Liu Li-xia,Peter Howe,Zhou Ye-fang,et al.Fatty acids and β-carotene in Australian purslane (Portulace oleracea)varieties[J]. Journal of Chromatography A,2000,893(1):207 -213.
[4] Obied W A,Mohamoud E N ,Mohamed O S A .Portulaca oleracea nutritive composition and clinic-pathological effects on Nubian goats[J].Small Ruminant Research,2003,48(1):31 -36.
[5] Zhang Ji-you,Chen Xing-guo,Hu Zhi-de,et al. Quantification of noradrenaline and dopamine inPortulace oleraceaL.by capillary electrophoresis with laser-induced fluorescence detection[J].Analytic Chimica Acta,2002,471(2):203 -209.
[6] 丁怀伟,姚佳琪,宋少江. 马齿苋的化学成分和药理活性研究进展[J]. 沈阳药科大学学报,2008,25(10):831-836
[7] 李凤林,余蕾. 马齿苋多糖降血糖与血脂作用研究[J]. 中国食品添加剂,2011(1):64 -68.
[8] Gang Xie,Igor A,Schepetkin,et al.Fraction and characterization of biological-active polysaccharides from Artemisia tripartite[J].Phytochemistry,2008,69(6):1 359 -1 371.
[9] 郑华艳,王戬. 马齿苋的开发利用[J]. 农牧产品开发,2000(7):22 ~23.
[10] 吴光杰. 响应曲面法优化马齿苋多糖提取工艺[J].食品与机械,2010,26(3):129 -133.
[11] 李玉萍,叶军,苏虎. 马齿苋多糖的研究进展[J]. 食品科学,2007,28(7):538 -541.
[12] 徐任生. 天然产物化学[M]. 北京:科学出版社,1997:475.
[13] 敬思群,关延新. 温桲果实中多糖含量测定及纯化[J]. 食品科学,2008,29(3):229 -232.
[14] 敬思群,张晓鸣. 复合酶法超声辅助提取高寒香菊花多糖[J]. 食品与发酵工业,2012,38(1):214 -217.
[15] 艾百拉·热合曼等. 浓缩葡萄汁在红花籽油贮藏中的抗氧化效果[J]. 食品工业,2011(6):21 -23.
[16] Singh R P,Chidambara Murthy K N.Studies on the antioxidant activity of pomegranate(Punica granatum)peel and seed extracts using in vitro models[J].Journal of Agricultural and Food Chemistry,2002,50(1):8l-86.
[17] 乐俊明. 近红外光谱分析法测定烟草化学成分[J].贵州农业科学,2005,33(3):62 -63.

