小鼠骨片间充质干细胞分离培养及鉴定
马予洁 陈 津 黄梁浒 王庆华 郭子宽 谭建明
间充质干细胞(mesenchymal stem cell,MSC)是再生医学重要的种子细胞,在许多疾病治疗中呈现出令人振奋的治疗效果。MSC首先是由Friedenstein等[1-2]从骨髓中利用其贴壁生长的特性成功分离出来。这种方法后来被许多研究者用来分离人和实验动物来源的骨髓MSC[3-6]。小鼠是用量最大、用途最广、品种最多的实验动物,已广泛应用于生物医学各领域的科学实验。然而令人烦恼的是实验者很难成功的从小鼠骨髓分离到高纯度的MSC,或者很难实现MSC的连续多次体外传代扩增培养[7]。究其原因,是因为小鼠骨髓量很少,MSC含量极少,同时混有大量造血细胞的优势生长,严重影响了MSC的分离培养[7]。研究发现,MSC存在于许多组织中[8],本研究将尝试从小鼠骨片中分离MSC,并建立其分离培养的方法。
材料与方法
一、材料
1.实验动物:C57BL/6小鼠购自军事医学科学院动物实验中心,雄性,7 d龄。所有实验在符合动物实验伦理要求下进行。
2.主要试剂及仪器:αMEM基础培养基(美国Gibco公司),胎牛血清(美国Stem cell公司),D-60 mm细胞培养皿(美国Costar公司),0.2﹪胶原酶、β甘油磷酸钠、地塞米松、胰岛素、1-甲基-3异丁基-黄嘌呤、吲哚美辛、维生素C、油红O(美国Sigma),碱性磷酸酶染色试剂盒(美国Sigma),胰蛋白酶(美国 Amresco公司),PE、FITC或PERCP标记抗小鼠单克隆抗体CD29,CD34,CD45,CD90,Scal1(美国 BD 公司),CO2培养箱(美国Thermo公司),眼科镊,眼科剪。
二、方法
1.小鼠骨片MSC分离培养:C57小鼠经脱颈处死后,75﹪酒精浸泡消毒10 min。用眼科剪横向剪开皮肤和肌肉,用眼科镊拨开露出小鼠胫骨和股骨,剥离胫骨和股骨,从胫骨头和股骨头处剪断,放入预先放有培养基的培养皿中。用1 ml注射器吸取基础培养基反复冲洗骨髓腔内的骨髓直至骨片呈白色。将骨片剪碎,加入胶原酶Ⅰ(2 mg/ml)2 ml,37℃消化 1~2 h,加入胎牛血清终止消化。加入αMEM洗涤骨片,将骨片转移到新的培养皿中,加入新鲜配制的含胎牛血清10﹪(v/v)和双抗0.1﹪(v/v)的完全培养基,37℃、5﹪CO2培养箱培养3~4 d。加入0.25﹪胰酶消化3 min,收获MSC,按1:3传代培养,每2~3 d更换培养基1次。残留的骨片可继续培养获得更多的原代MSC。收获P2,P3代细胞进行实验研究。
2.流式鉴定:收获P2代小鼠MSC,经PBS洗涤2次,加入PE、FITC或PERCP标记抗小鼠CD29,CD34,CD45,CD90,Scal1单克隆抗体避光孵育30 min,加入PBS洗涤2次,1500 rpm离心5 min,重悬细胞,进行流式测定。FlowJ 7.6软件进行数据分析。
3.成骨诱导分化及鉴定:取P3代小鼠MSC,以每孔2×104细胞数种植于24孔板中,60﹪~ 70﹪融合时,更换为成骨诱导培养基,含胎牛血清10﹪(v/v),β甘油磷酸钠10 mmol/L,地塞米松10-7mol/L,维生素C 50 μmol/L。每3~4 d更换培养基1次,诱导2~3周后进行碱性磷酸酶染色鉴定。步骤为吸弃培养基,4﹪多聚甲醛固定30 min,去离子水洗涤2次,加入ALP染料混合液,室温孵育30 min,去离子水洗涤2次,每次2 min,加入苏木素复染10 min,去离子水洗涤,倒置相差显微镜下观察。
4.成脂诱导分化及鉴定:取P3代小鼠MSC,以每孔2×104细胞数种植于24孔板中,60﹪~ 70﹪融合时,更换含胎牛血清10﹪(v/v),地塞米松10-6mol/L,胰岛素10 ng/ml,1-甲基-3异丁基-黄嘌呤0.5 μmol/L,吲哚美辛10-4mol/L的成脂诱导培养基,每3~4 d更换培养基1次,2周后进行油红O染色鉴定成脂细胞。步骤为吸弃培养基,PBS洗涤1次,加入4﹪多聚甲醛固定30 min,70﹪异丙醇洗涤2次,加入2﹪油红O室温下染色10~15 min,弃去油红O染料,异丙醇洗涤残留油红O,倒置显微镜下观察细胞内脂滴。
结 果
1.小鼠骨片分离清洗:小鼠胫骨和股骨较小,约牙签大小,可见骨腔内红色骨髓(图1a),用 1 ml注射器吸取 αMEM培养基冲洗髓腔骨髓后,颜色变白(图1b)。
2.小鼠骨片MSC原代培养:小鼠骨片培养2 d后就可以看见骨片边缘爬出长梭形细胞,3 d后爬出细胞越来越多,并成集落样生长(图2)。消化细胞进行传代后,可获得纯度较高的MSC,并且细胞增殖速度较快,3 d就可达到90﹪融合。获得的MSC可以连续传代数代,仍然保持良好的细胞形态和增殖能力(图3)。残留的骨片还可以继续作为原代MSC的来源继续培养,经过数次培养后,骨片逐渐疏松,除MSC外,残留骨细胞(图4)。
3.流式鉴定结果:流式细胞仪结果显示,获得的细胞表达Scal1(92.7﹪),CD29(98.4﹪),CD90(91.6﹪)等MSC标志物,不表达CD34(1.57﹪),CD45(3.99﹪),CD11b(0.63﹪)等造血细胞标志物(图5)。符合小鼠MSC的标准。
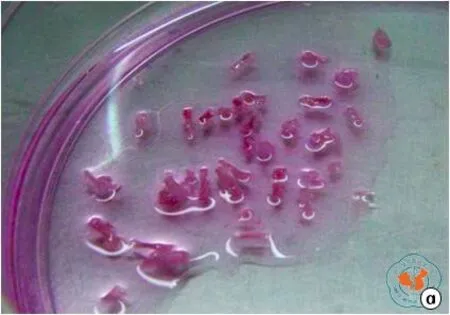
图1 小鼠骨片分离

图2 倒置相差显微镜下观察小鼠骨片MSC原代培养(×100)

图3 倒置相差显微镜下观察小鼠骨片MSC传代培养(×100)
4.向成骨细胞诱导分化结果:小鼠骨片MSC经成骨诱导培养基诱导2周后,经碱性磷酸酶(ALP)染色提示细胞内有大量酶颗粒形成,与成骨细胞活性相关的碱性磷酸酶表达阳性(图6)。说明获得的细胞可以成功的诱导分化成骨细胞。
5.向脂肪细胞诱导分化结果:获得的细胞经成脂诱导培养基诱导4~5 d后,倒置相差显微镜观察可见胞浆内出现圆形脂滴,并且随着诱导时间的延长,脂滴逐渐增多增大。诱导2周后,可见大多数细胞内充满脂滴。经脂肪细胞特异性油红O染色,呈红色油滴样(图7)。证实获得的细胞可以成功诱导成脂肪细胞。

图4 倒置相差显微镜下观察残留骨片培养(×100)
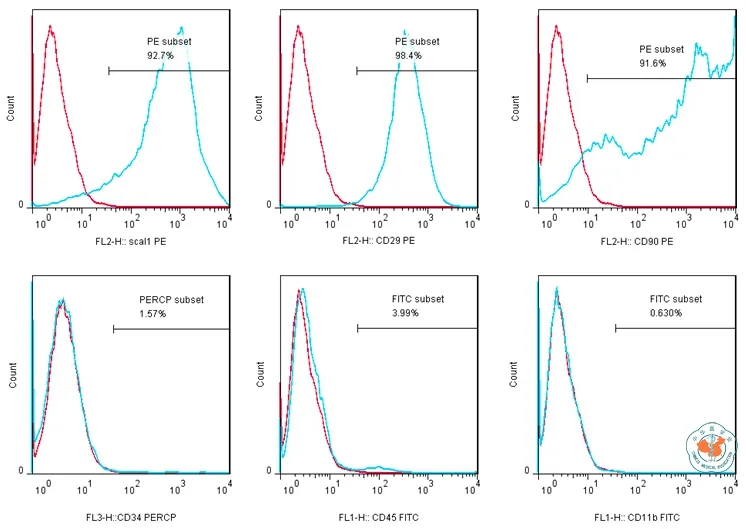
图5 小鼠骨片MSC表面标志流式检测结果

图6 倒置相差显微镜下观察小鼠骨片MSC向成骨细胞诱导分化结果(ALP染色×100)
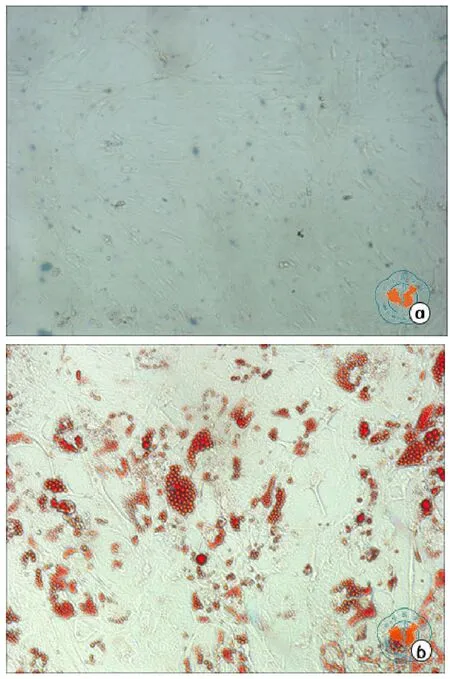
图7 倒置相差显微镜下观察成脂诱导结果(油红O染色×100)
讨 论
MSC因其具有分化潜能、免疫调控、分泌细胞因子等功能成为再生医学重要的种子细胞之一。目前已经被广泛用于多种疾病治疗的实验研究,包括移植物抗宿主病、糖尿病、脊髓损伤、肺和关节疾病等[9]。小鼠因其品系纯,应用于科学研究中所获的实验结果敏感性高,一致性强,重复性高等优点,已被广泛应用于生物学、医学、兽医学、生理学、遗传学、胚胎发生学等领域的科学实验。小鼠还具有容易实现基因敲除[10]、体积小、繁殖快、经济等优点,作为动物模型越来越受到研究者的重视[11]。研究者已经采用小鼠成功制作许多人类疾病的动物模型如糖尿病、卵巢癌、肥胖、白内障、创伤、甚至HIV模型[12]等,为开展干细胞治疗疾病的实验研究提供了重要基础[11,13-15]。然而研究者在采用传统方法分离小鼠骨髓MSC时却遇到了难题,很难成功的分离高纯度的MSC,或者很难实现在体外长时间继代培养[7]。一些研究者采用大鼠或人源的MSC作为供者细胞,替代小鼠来源MSC来研究治疗效果,以解决小鼠MSC来源不足的问题。虽然MSC的免疫原性很低,但依然不能排除异种来源细胞对实验研究效果的影响。为避免上述问题对实验研究的影响,建立能获得足量、稳定的小鼠来源MSC对研究者具有重要意义。
MSC是骨髓腔中的基质细胞,是构成骨髓造血微环境的重要成分,因此骨实质中可能存在大量的MSC[16]。研究发现,在骨髓腔边缘或骨实质中还存在更原始的MSC,表达成熟MSC不表达神经干细胞的标志[16]。本研究通过清洗骨髓腔内骨髓,去除造血细胞的影响,成功从小鼠骨片中分离出高纯度的MSC,并成功进行体外传代培养。获得的细胞高表达MSC标志Scal1,CD29,CD90,不表达造血系统细胞标志物CD11b,CD34,CD45。并具有多向分化的能力,可以成功诱导成脂肪细胞、骨细胞。
所以通过骨片法可以获得小鼠来源MSC,并且纯度高,增殖能力更强,能够实现在体外较长时间的继代培养,为实验研究提供了很好的种子来源。同时还可以利用许多转基因小鼠如绿色荧光小鼠等,分离获得具有特殊功能的MSC(表达绿色荧光),以及利用一些基因敲除小鼠获得某基因缺失的特殊MSC,为进一步开展实验研究提供更丰富的种子来源。
1 Friedenstein AJ, Piatetzky-Shapiro II, Petrakova KV.Osteogenesis in transplants of bone marrow cells[J]. J Embryol Exp Morphol, 1966, 16(3):381-390.
2 Friedenstein AJ, Gorskaja JF, Kulagina NN. Fibroblast precursors in normal and irradiated mouse hematopoietic organs [J]. Exp Hematol, 1976, 4(5):267-274.
3 Kadiyala S, Young RG, Thiede MA, et al. Culture expanded canine mesenchymal stem cells possess osteochondrogenic potentialin vivoandin vitro[J]. Cell transplantation, 1997,6(2):125-134.
4 Martin DR, Cox NR, Hathcock TL, et al. Isolation and characterization of multipotential mesenchymal stem cells from feline bone marrow[J]. Exp Hematol, 2002, 30(8):879-886.
5 Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adult human mesenchymal stem cells[J].Science, 1999, 284(5411):143-147.
6 Wakitani S, Saito T, Caplan AI. Myogenic cells derived from rat bone marrow mesenchymal stem cells exposed to 5-azacytidine[J]. Muscle Nerve, 1995, 18(12):1417-1426.
7 Phinney DG, Kopen G, Isaacson RL, et al. Plastic adherent stromal cells from the bone marrow of commonly used strains of inbred mice:variations in yield, growth, and differentiation[J]. J Cell Biochem, 1999, 72(4):570-585.
8 陈津, 郭子宽, 王立生, 等. 大规模间充质干细胞培养技术评估[J]. 中国医药生物技术, 2013, 8(4):274-284.
9 Sensebe L, Bourin P, Tarte K. Good manufacturing practices production of mesenchymal stem/stromal cells[J].Hum Gene Ther, 2011, 22(1):19-26.
10 Mcmurray F, Moir L, Cox RD. From mice to humans[J].Current diabetes reports, 2012, 12(6):651-658.
11 Platt TL, Reeves VL, Murphy MP. Transgenic models of Alzheimer's disease:better utilization of existing models through viral transgenesis[J]. Biochim Biophys Acta, 2013,1832(9):1437-1448.
12 Dudek TE, No DC, Seung E, et al. Rapid evolution of HIV-1 to functional CD8(+) T cell responses in humanized BLT mice[J]. Sci Transl Med, 2012, 4(143):143ra98.
13 Heymann MC, Rösen-Wolff A. Contribution of the inflammasomes to autoinflammatory diseases and recent mouse models as research tools[J]. Clin Immunol, 2013,147(3):175-184.
14 Jungraithmayr W, Jang JH, Schrepfer S, et al. Small animal models of experimental obliterative bronchiolitis[J]. Am J Respir Cell Mol Biol, 2013, 48(6):675-684.
15 Soler MJ, Riera M, Batlle D. New experimental models of diabetic nephropathy in mice models of type 2 diabetes:efforts to replicate human nephropathy[J]. Exp Diabetes Res, 2012:1-9.
16 Mendez-Ferrer S, Michurina TV, Ferraro F, et al.Mesenchymal and haematopoietic stem cells form a unique bone marrow niche [J]. Nature, 2010, 466(7308):829-834.

