胶束毛细管电泳-二极管阵列快速分离和检测5种“瘦肉精”类药物
(中国科学院大学生命科学学院, 北京100049)
1 引 言
当前,食品安全问题日益突出,在众多食品污染物中,“瘦肉精”倍受关注。“瘦肉精”泛指能降低脂肪、提高瘦肉率的一类药物,通常属于β-兴奋剂(β-Agonists),又叫β-激动剂或β-受体激动剂,全称β-肾上腺素能兴奋剂(β-Adrenergic Agonist)。克伦特罗(又称克喘素、双氯醇胺或苯甲醇胺)、莱克多巴胺、沙丁胺醇(又称舒喘宁)、西马特罗(又称息喘宁)、特布他林是5种最常见的“瘦肉精”(见表1)。
“瘦肉精”可提高家禽和牲畜肌肉的生成速度[1],用于促生长目的时剂量一般都超过 5 μg/g,当添加到饲料中的药量超过此剂量时,就达到“同化剂量”。该类药物易在畜禽体内尤其是肝脏组织中蓄积,当人体中累计摄入剂量超过一定值或一次食入高残留量(>0.1 μg/g)的内脏组织如肝、肾、肺时,易导致β-兴奋剂毒副作用,出现头晕、心悸、手指震颤等中毒症状,此类药物造成的威胁已成为重大的食品安全问题。许多国家和地区都明令禁止在畜牧业中使用“瘦肉精”,以保证消费者的权利和安全。在我国,禁止使用任何类型“瘦肉精”。又因该类药物用于人体可以降低体重和增加骨骼肌肉力量[2],加之其促蛋白同化作用及可以兴奋中枢神经系统,被非法用于体育运动中,已被世界反兴奋剂机构(WADA)列为禁药。
1.1 盐酸克伦特罗
“瘦肉精”中影响最广的是盐酸克伦特罗 (Clenbuterol, CLB),又称“克仑特罗”,化学名为“2-[(叔丁氨基)甲基]-4-氨基-3,5二氯苯甲醇盐酸盐”,可舒张支气管、改善通气、舒张和松弛子宫平滑肌。最初主要用于人类哮喘和动物肺部疾病,又称氨哮素、双氯醇胺,还具有抗炎和神经营养性作用以及诱导神经保护作用[3]。因偶然发现其具有促进蛋白同化作用,且比合成代谢类固醇药物有更高的选择性,可减少脂肪的形成,提高瘦肉和脂肪的比率,而在畜禽生产中曾被用作“营养再分配剂”及“促生长剂”,克伦特罗也是至今最有效和应用最广的“再分配剂”。

表1 5种常见“瘦肉精”的基本信息
1.2 莱克多巴胺
莱克多巴胺(RAC,商品名培林)也属常见的“瘦肉精”。1999年底,美国食品药品监督管理局(FDA)批准其作为猪饲料添加剂。它毒性低、代谢快、较少蓄积,更安全高效。如今,美洲和亚洲的20多个国家允许其使用,但规定猪肉上市前,残余量须低于50 ppb(相当于每kg猪肉中含50μg),以免造成中毒。还有国家或机构允许其使用,但残余量允许范围更低。
联合国粮农组织和世界卫生组织的食品添加剂联合专家委员会(Joint FAO/WHO Expert Committee on Food Additives, JECFA)及其它国家根据自己国民饮食的习惯等制定了自己牛肉和猪肉的最高残留允许量(Maximum Residue Limits, MRL)标准(见表2)。

表2 莱克多巴胺在各国的最大残留容许量标准 单位:μg/kg
1.3 检测方法
生物样品中β-兴奋剂残留量的检测具有重要意义,不仅可以用于药物代谢动力学的研究,还可以为饲养业及体育运动中滥用β-兴奋剂提供证据。但因其在生物样品中的含量很低,检测限要达到ng/mL的水平,这对样品的前处理提出了很高的要求,检测也具有一定的难度。
目前已经开发了一些方法用于分析“瘦肉精”,主要是气相色谱法(GC)与高效液相色谱(HPLC)法,所用检测器主要为质谱(MS)检测器和紫外(UV)检测器,少量为薄层色谱法(TLC)[4]和免疫分析(IA)法[5]。分析涉及的生物样品有血、尿、肝脏及毛发等[6]。
标准检测方法方面,国标及欧盟检测多为质谱法。我国卫生部和国家标准化管理委员会制订了多种β-兴奋剂的检测标准,如动物性食品样品中的克伦特罗采用GC-MS定量分析,检测限为0.5 μg/kg[7];饲料中的沙丁胺醇、莱克多巴胺等多种β-兴奋剂采用LC-MS进行定量分析,其检测限均为10 μg/kg。我国现行部分相关标准中瘦肉精的检测方法见表3。

表3 我国现行部分标准中β-兴奋剂的检测方法

续表1
目前市售快速检测卡多为定性检测。基于胶体金(硒)纸片的“瘦肉精”快速检测卡应用了竞争抑制免疫层析的原理,检测对象主要是血液和尿液。该类试剂条、卡检测结果的误差很大,易使消费者产生误解。
谷峰等[8]对β-兴奋剂的检测方法进行了综述,认为酶联免疫分析法是目前克伦特罗最佳残留筛选检测法,HPLC法、GC-MS和HPLC-MS法是检测饲料及动物组织中克伦特罗残留的最终确认方法。但是质谱法等只在专业机构进行,并且成本高,检测过程长,不具备向普通市民推广的基础。
毛细管电泳法应用于快速分离和测定“瘦肉精”在文献中已有报道。毛细管电泳(Capillary Electrophoresis, CE)又称高效毛细管电泳分析法(High Performance Capillary Electrophoresis, HPCE)是一种功能强大的分离、分析方法,是分离科学中继高效液相色谱(High-Performance Liquid Chromatography, HPLC)之后的又一重大进展,是近几年来分析化学中发展最为迅速的领域之一。
毛细管电泳(CE)极具吸引力,具有诸多优点:分离效率高(理论塔板数已达106~107/m);分析时间短(一般在30min内即可完成一次电泳操作);消耗的溶剂或样品体积小;重现性较好;成本低;方法开发比较容易、可以很方便地与质谱等多种检测手段集成[9-12],可采用多种模式来改变选择性,扩大应用范围;操作简便,易于实现自动化;分离在水相介质中进行,没有或很少产生有机废液,污染少,还可提供正交的,互补的分析。分析目标涵盖无机离子、有机分子、对映体、生物大分子、细胞等,在分析化学、生物化学、分子生物学、环境化学和医药等多个领域有着广泛的应用前景[13]。胶束毛细管电动色谱(MECC)是基于胶束增溶和电动迁移的新型液体色谱,在缓冲液中加入离子型表面活性剂形成胶束,溶质分子在胶束相和水相分配存在差异从而可实现分离,这种模式拓宽了普通毛细管区带电泳(CZE)的应用范围,改善了电泳分离的选择性[14],可用于中性物质的分离或者区分手性化合物。
在检测器选择方面,电化学检测器通常在样品净化处理较好时可以得到较高的灵敏度,但不稳定,重现性差且不能作为梯度洗脱条件下的检测器。质谱检测器尤其是二级质谱则作为特异性检测器,二级质谱可以弥补色谱分离的不足,对样品处理的要求也大大降低。质谱检测器灵敏度高,特异性好,但价格昂贵,仪器不普及[6]。UV检测器价格便宜,最为普及,但其选择性不佳,在分离效果不好时易受干扰,且灵敏度不高。二极管阵列检测器(Diode array detector,DAD),利用多元阵列检测器进行多通道同时检测多波长,在一定程度上可以弥补紫外固定波长检测器选择性不好的缺陷,自动扫描检测器则有更大的优越性:它既可提供色谱图,又可提供光谱图,能为化合物的鉴定提供定性资料。二极管阵列检测器结构较为简单,运行可靠,性能优良,是一类极有发展前景的分析仪器检测器[15],是具有很高光强度和需要最佳信噪比的应用所选择的检测器。
二极管阵列检测器在许多方面胜过其它检测器,其主要特点有[15]:(1)扫描速度快,同时将机械驱动部分减少到最小限;(2)能采用比较光谱法确定峰纯度;(3)可鉴定色谱峰;(4)可绘制三维色谱图;(5)可提高选择性;(6)适用于微柱分析。二极管阵列检测器能高灵敏度地在极短时间内对全波长范围内扫描,使波长测量更准确、可靠,得到的三维图谱是传统机械式波长扫描装置无法做到的。目前,二极管阵列检测器已成为分析化学、医学诊断、在线过程控制及工业在线检测等光谱测量仪器重点选择的关键部件之一。
不同化合物光谱特征各不相同,如果色谱峰是由均匀的同一种物质产生,那么在色谱峰流出的各时间点,不同波长的比值为定值。图1显示同时检测两个波长(信号A和信号B)的色谱图,Ratio A:B是两个波长(A/B)的比值图。纯物质的色谱图比值恒定,显示为一条直线,不纯的比值图是有明显波动[16]。
A:不纯物质峰B:纯物质峰

图1 鉴定峰纯度的方法原理图
段建平等[17]利用毛细管区带电泳-紫外检测方法可同时测定饲料中西马特罗、盐酸克伦特罗与沙丁胺醇。王伟宇等[18]使用小型化的毛细管电泳-电化学检测技术测定猪尿和猪饲料中的克伦特罗、莱克多巴胺和沙丁胺醇,在7 min内可实现3种分析物的分离检测。郑妍鹏等[19]建立了可用于检测猪内脏中盐酸克伦特罗含量的毛细管电泳电导检测方法,采用醋酸/醋酸氨缓冲体系为运行电泳介质,在最佳实验条件下,盐酸克伦特罗的线性范围为1.2~20 μg/mL,检测限为0.6 μg/mL。1997年文献报道[20]采用毛细管电泳结合二极管阵列(DAD)检测3种β-兴奋剂,但是其实验方法还有很大改进空间,其检测结果与我们的结果也有明显差异。
本研究最优条件下可以在14 min之内对检测的5种“瘦肉精”进行分离检测。样品实际消耗少,将该法应用于样品的测定,快速、简便、可靠。
2 实验部分
2.1 仪器和试剂
P/ACE MDQ毛细管电泳仪(美国Beckman公司),弹性无涂层石英毛细管柱,内径75 μm,长60.2 cm(有效分离长度为50 cm,美国Beckman公司)。纯水机(PURELAB Classic, ELGA Lab Water, UK),超声波清洗机(天津市瑞普电子仪器公司),pH计(丹佛仪器(北京)有限公司),瑞士梅特勒电子天平(梅特勒-托利多(上海)有限公司),高速离心机(美国Sigma公司)。
沙丁胺醇和克伦特罗购自中国药品生物制品检定所,莱克多巴胺、特布他林均购自德国(Dr. Ehrensterfer GmbH),西马特罗购于加拿大(Toronto Research Chemicals Inc.),各标准品均按说明使用。模拟尿样来自健康志愿者。
2.2 溶液的配制
制备0.l mol/L硼砂(Na2B4O7)、5 mol/L NaOH、1 mol/L HCl储备液,取适量储备液,精确调节pH值并加入SDS配成所需的运行缓冲液。用超纯水配制5种β-兴奋剂标准品均为1.0 mg/mL浓度的储备液,低温避光保存。其它不同浓度的系列标准品溶液用运行缓冲溶液稀释得到。其它试剂均为分析纯。
2.3 样品的预处理
采集的尿液应保存于4℃~8℃冰箱中,尿液应经离心处理,取上清液备用。进样前为防止杂质过多,可将样品稀释5倍,并以0.45 um聚丙烯滤膜过滤。
2.4 毛细管电泳检测条件
按要求配制实验所需各种缓冲溶液,试液与运行缓冲液均经0.45 μm聚丙烯滤膜过滤,并经10000 r/min高速离心脱气5 min。每天电泳操作前毛细管均依次用甲醇-水(60:40)、0.1 mol/L NaOH、超纯水及运行缓冲液冲洗5 min。每次进样分析开始前, 均依次用0.1 mol/L NaOH,超纯水和对应的运行缓冲液冲洗5 min。分析过程中,样品分析一次用运行缓冲液冲洗一次,连续电泳分离最多3次后及时更换运行缓冲液,尽量保证两缓冲液瓶中缓冲液组分和高度一致,以保证分析的精度。本实验采用压力进样,20psi(Pounds per square inch)×5s,正极进样,负极柱上以二极管阵列(DAD)检测器190~600nm检测。
实验在恒温(25℃)、恒湿(相对湿度60%)的实验条件下进行。
3 结果与讨论
3.1 基本原理
由5种“瘦肉精”化学结构式可以看出,其都含有苯环,而苯环上的共轭双键会有紫外吸收,故可以采用紫外检测器或二极管阵列(DAD)检测器检测。本实验中采用二极管阵列检测器在190到600 nm范围内全波长扫描其对光的吸收。对比发现,各种物质在200 nm附近均有较强的吸收,故采用了200 nm下吸收峰面积进行定量。
影响毛细管电泳分析结果的因素主要包括毛细管的电渗流、进样和信号采集、处理等。其中进样方式优化、毛细管预处理条件的选择、电极电解作用的影响、温度控制和后期的信号处理尤为重要[21]。
图2为P/ACE MDQ毛细管电泳仪电泳图界面。

图 2 P/ACE MDQ毛细管电泳仪电泳图界面(右上为固定时间点处不同波长下的吸收,右下为三维谱图)
3.2 缓冲液的选择
缓冲溶液的类型、浓度(离子强度)、pH 是毛细管电泳分离条件选择的重要考虑因素,其会影响到电渗流、分离速度、分离选择性、分离度。缓冲溶液的选择一般无严格规律可循。但要满足一些基本条件:有一定的pH调节范围和足够的缓冲容量;尽可能选择浓度高而产生电流小的缓冲溶液;缓冲溶液的表观淌度接近样品组分的表观淌度;对如多元醇、糖等,可选择有络合能力的缓冲溶液,如硼酸盐缓冲溶液。
电渗是可控制组分的迁移方向和速度,进而影响分离效率和重现性,因此电渗的控制是电泳研究的关键。
v=μeoE=(ε0εζ4πη)E
式中,v为迁移率,μeo为电渗流, E 为电场强,ε0为真空介电常数,ε为缓冲液介电常数 ,ζ为 Zeta 电势,η为粘度。
如上公式所示,一般所有能改变ξ、ε和η的任何直接或间接的因素都可能用来控制电渗,直接因素如分离电场、粘度、介电常数和电动势等;间接因素有:缓冲液的组成和pH、温度、管壁性质、外加电磁场等。其中温度和缓冲液的组成通过影响粘度、介电常数和管壁的ξ等来影响电渗。外加电磁场则通过改变管壁表面的电荷数量及其分布来改变电渗。
离子强度(浓度)的变化,引起溶液粘度、扩散系数以及Zeta电势的变化,从而影响分离效率和分离度。
实验考察了氨盐、磷酸盐和硼酸盐等碱性体系对测定的影响。发现硼酸盐体系作缓冲溶液的分离效果最好,峰形和灵敏度较好。这可能是因为硼是缺电子原子,可以与化合物中带孤对电子的氨配位形成络合阴离子,增加样品溶解度,减少了因吸附造成的拖尾等影响。
3.3 缓冲液pH的影响
考察硼酸盐(Na2B4O7-NaOH)缓冲溶液的pH值(pH 9.2~11.5,用5 mmol/L NaOH调节)对分离检测的影响,结果如下。
运行缓冲液的pH值在CE中起着关键的作用,因为其会改变ζ-电位(ζ),电渗流(EOF)以及分析物的总体电荷,并最终影响迁移时间和被分析物的分离。另外,改变缓冲溶液的pH,可改变某些组分的离子化状态,改变其带电性质和数量,使淌度发生变化,而分析物离子状态比中性状态时在胶束中分配减少,从而影响选择性。对于石英毛细管,在pH<2.5时,硅羟基基本不解离,电渗接近于零;而pH>10时,硅羟基解离基本完全,电渗变化很小;在pH=4~10之间,硅羟基的解离度随pH上升而迅速增加,电渗亦迅速增强。实验重点考察了pH值的影响,以获得最佳的条件。
实验对比了运行缓冲液为10 mM的硼酸盐缓冲液(加入10 mM SDS)的pH值范围从6至11.8对检测的影响。结果显示,pH值低于8.0,检测不到明显的峰,pH9.0、10.0、11.0可见标准物检出,进一步细化对比pH9.2(此为未加入NaOH时pH值)、10.0、10.5、11.0、11.5几个pH梯度。推测提高缓冲溶液的pH,使电渗流增加,缩短分析时间;另外,改变缓冲溶液的pH,可改变某些组分的离子化状态,改变其带电性质和数量,使淌度发生变化,而分析物离子状态比中性状态时在胶束中分配减少,从而影响选择性。两种作用综合的结果,在所检测的碱性范围内随pH增大,迁移时间有的延长有的变化不明显。
由图3可见,pH从9.2上升10.0时,除CIM外的分析物迁移时间变化显著,原因可能在于其解离常数可能均在pH9.2以上,pH大于其解离常数后,其带电荷数量变化明显。同时CLB峰面积有明显上升。pH从10.0上升到11.5时,各分析物峰面积未见明显增强,除CLB外其它4种分析物迁移时间变动较小,推测其解离后取代的酚基去质子化带负电荷,使各分析物因为带嵌入到胶束中的作用受抑制,整体电泳速度下降,与因为离子强度变化引起的电渗流增强作用相互抵消。pH10.5时分离度和峰形、峰高都较好,分离时间较短,因此,选择pH为10.5的最适pH值,分析物能较好地分离。
整体上CLB迁移时间受pH影响比其它分析物更明显。

图3 不同pH缓冲液电泳谱图的比较
3.4 缓冲液浓度的影响
考察硼酸盐(Na2B4O7-NaOH)缓冲溶液浓度(5~30 mmol/L)对分离检测的影响,结果见图4。
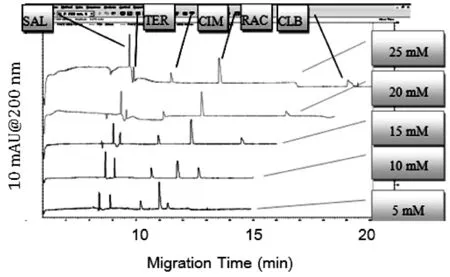
图 4 不同缓冲溶液的浓度下电泳谱图比较
缓冲液中的离子主要起导电作用并影响分离效率,是电泳条件选择的关键因素之一。离子一般通过影响双电层的厚度来影响电渗,离子浓度上升,双电层厚度减小,电渗下降。离子还可通过与管壁作用以及影响溶液的粘度、介电常数、离子活度等来影响电渗。离子强度(浓度)的变化,引起溶液粘度、扩散系数以及ζ电势的变化,而且还会影响胶束的聚集数,从而影响分离效率和分离度。
实验考察硼酸盐(Na2B4O7-NaOH)缓冲溶液5种浓度(5、10、15、20、25mM)(pH 10.5,加入10mM SDS)对检测的影响。
缓冲液的浓度低于10mM时CLB等分析物峰面积较小,且与RAC相距过近,不能得到很好的分离。当缓冲液的浓度升高时,峰面积无明显变化,而迁移时间整体延长,较高的缓冲液的浓度也可能会引起的焦耳热的增加,造成基线不稳。因此,该体系中选择了10 mM的硼酸盐缓冲液(pH10.5)作为最佳的运行缓冲液。
3.5 表面活性剂(SDS)浓度的影响
缓冲溶液添加剂可用于改善分离效率和分离选择性,缓冲溶液添加剂包括:表面活性剂、有机溶剂、中性盐类、手性选择剂。其中表面活性剂通过亲水端或疏水端与样品组分作用,影响组分的电泳性质,从而改变体系的分离选择性,与毛细管内壁作用,减小内壁的吸附作用,或改变电渗流的大小和方向。十二烷基硫酸钠(SDS)是一种阴离子表面活性剂,在实验中可具有如下作用:增大溶解度,形成胶束,可以使壁表面负电荷增加,Zeta电势增大,电渗流增大。
由于这5种β-兴奋剂在侧链上都具有一个共同的β-羟胺基团,但芳基部分上的取代基彼此各不相同,如CLB和CIM苯胺取代基团,SAL,TER和RAC苯酚取代基团。5种β-兴奋剂在胶束相和水相之间分配可能存在差异,故考虑采用MECC法分离,通过在缓冲介质中加入SDS增大容量因子,并形成胶束,实现分离。
SDS在样品的分离中起决定性作用,加入的浓度必须高过其临界胶束浓度(在23℃~28℃时。SDS的临界胶束浓度为7~10 mM)。实验考察了10 mM的硼酸盐缓冲液(pH10.5)分别加入0、5、10、15、20、25、30mM SDS对检测的影响,结果显示,在无SDS或SDS的浓度<5 mM的介质中,样品无法分离检出;SDS的浓度在5 mM时,SAL和TER样品峰相互重叠或相距过近;当SDS的浓度增大到10 mM时,5种样品可以实现完全分离;继续增大SDS的浓度,样品的分离度增大,但迁移时间、背景噪音和焦耳热也增加,峰会展宽,因此选择在缓冲液中加入10 mM的SDS。图5为不同SDS的浓度下电泳谱图比较。

图 5 不同SDS的浓度下电泳谱图比较
3.6 分离电压的影响
对分离电压对分析物迁移时间的影响也进行了研究。对于一个给定的分离长度,分离电压决定电场强度,从而会影响带电分析物的迁移速度和电渗流的速度,这反过来又决定分析物的迁移时间。
实验中,考察了16、20、24、28 kV(间隔4 kV)分离电压的区别。高分离电压下所有分析物的迁移时间缩短,同时,出现杂峰或分离不明显,也加大了基线噪音并导致分离效率下降。分离电压太低,峰信号也较低,且出峰时间较长,造成了较差的分辨率和更长的分析时间。
在实验的基础上,选择20 kV电压,出峰较快,且峰形较好。
3.7 毛细管柱温度的影响
毛细管柱温度是毛细管电泳中对分离有重要影响的参数。对于一个给定的分离长度、分离电压,温度主要影响溶液的粘度,从而影响电渗流的速度,进而影响分析物的迁移时间、分离度和分辨率。
实验中,考察了10 mM的硼砂缓冲液(pH10.5加入10 mM SDS)15℃、20℃、25℃、30℃、35℃温度条件对检测的影响。如图6所示,温度对迁移时间有着非常显著的影响,随着温度的升高,溶液粘度下降,电泳和电渗速度都增加,迁移时间明显降低;但是温度过高时,则更容易产生气泡,样品扩散加强也导致样品峰信号减弱。另外,迁移时间过短易导致分辨率下降,为了保证实验的重现性和可对比性,应该严格保证实验条件下的毛细管柱温度。从分辨率优先于分离时间的角度考虑,控制毛细管柱温为25℃。

图 6 不同毛细管柱温度下电泳谱图比较
3.8 有机溶剂对检测的影响
甲醇、乙醇、乙腈、丙酮等水溶性有机溶剂由于能影响和调节溶质分子在胶束内外两相的分配而常被用作胶束毛细管电泳缓冲溶液添加剂。另外,由于样品具有疏水基团,加入有机溶剂还可以增大样品在缓冲溶液中的溶解度。实验考察了4种溶剂(10%和20%两个浓度下)对样品溶液的影响,结果表明:甲醇、乙醇加入易使某些峰信号降低或者基线不稳,乙腈和丙酮均可明显改善峰形,20%浓度下还可以明显缩短迁移时间。推测其原因是有机溶剂改善SDS对各样品组分的包合作用。增强相对电迁移速率的同时,减少所检测的药物分子的负电荷密度,进而降低了本身反方向的电泳速度。
乙腈的加入可以增强电渗流。本实验进一步验证乙腈对检测的影响发现:随着乙腈体积分数的增加,样品的迁移时间先增加(0~15%),后降低(15%~20%),样品的峰高在乙腈体积分数为15%后降低。这可能是因为随着有机溶剂的增加,样品的分配系数和体系的粘度降低,同时导致溶液的介电常数增加。这两种相反的趋势,使样品的迁移时间出现先增加后降低的现象。样品的峰高降低可能是因为乙腈改变了SDS的临界胶束浓度,当乙腈的体积分数较小时,增强了胶束形成。当乙腈的体积分数增大到一定程度时,阻碍了胶束形成,使样品的峰面积降低。但是添加有机溶剂也会使得迁移时间缩短后某些物质峰相距过近,使直接稀释样品的药物峰难于分辨,而对于有机溶剂萃取的样品则不会存在这样的问题,故可以视情况考虑有机溶剂的添加与否。图7为添加两种浓度的乙腈后电泳谱图比较。图8为添加两种浓度的丙酮后电泳谱图比较。

图 7 添加两种浓度的乙腈后电泳谱图比较

图 8 添加两种浓度的丙酮后电泳谱图比较
3.9 线性范围、检出限和精密度
配制了一系列不同浓度的沙丁胺醇、特布他林、莱克多巴胺和西马特罗对照品溶液,在优化的实验条件下考察其线性范围及检出限,结果见表4。10 mg/L 的沙丁胺醇、特布他林、莱克多巴胺和西马特罗重复20次进样,峰面积和迁移时间相对标准偏差(RSD)分别低于9.3% 和8.1%。
3.10 样品测定与加标回收实验
在优化的实验条件下按照外标法进行定量,将尿液样品稀释5倍并在其中加入一定量的标准样品进行加标回收实验。结果见表5。

表4 线性范围、回归方程和检出限

表5 样品测定与加标回收实验
注:回收测得含量为3次测量结果的平均值。
由图9可见,一次进样,在分离体系中同时得到5种样品的检测峰。加标样品同标准品检测峰的迁移时间基本相同。因此对于上述化合物,采用胶束毛细管电泳检测系统,在分离谱图上通过迁移时间的比较可以进行样品峰的确证。若不一致,则为杂质峰。

图 9 标准品、实际样品的胶束毛细管电泳分离检测结果图
4 结论
采用基于胶束电动毛细管色谱(MECC)和二极管阵列(DAD)检测5种β-兴奋剂,该方法简单而可靠。在最佳条件下,5种β-兴奋剂的检测限为0.1~0.2 μg/ mL的(S/N>3),14 min之内可实现基线分离。通过分析尿样加标样品验证了其适用性。
有文献报道使用高效液相色谱串联质谱法检测β-兴奋剂,可以达到μg/L数量级以下,与之相比毛细管电泳方法作为一种药物残留检测方法虽具有自己的优点,但使用二极管阵列(DAD)检测器,检测限还有待提高。本实验中DAD谱图比较判断5种药物峰均为纯物质峰,故未在结果中详细论述。使用激光诱导荧光(LIF)检测器还可提高仪器灵敏度[22],检测限可达ng/mL,但是需要衍生化处理。另外,有机溶剂对于检测结果的影响非常明显,无论峰形和峰面积都可能随着有机溶剂的加入而显著变化,对于实际中各种形式的具体样品,值得再深入、细致地研究。
[1] Enache T A, Oliveira-brett A M. Phenol and-substituted phenols electrochemical oxidation pathways [J]. Journal of Electroanalytical Chemistry, 2011, 655(1): 9-16.
[2] Martineau L, Horan M A, Rothwell N J, et al. Salbutamol, a beta2-adrenoceptor agonist, increases skeletal muscle strength in young men [J]. Clinical Science, 1992,(83): 615-621.
[3] Gleeson L C, Ryan K J, Griffin E W, et al. The beta2-adrenoceptor agonist clenbuterol elicits neuroprotective, anti-inflammatory and neurotrophic actions in the kainic acid model of excitotoxicity [J]. Brain Behav Immun, 2010, 24(8): 1354-1361.
[4] Zhou J, Yao H, Shao H, et al. Enantioseparation of β-Agonists with Carboxymethyl-β-Cyclodextrin by Ce [J]. Journal of Liquid Chromatography & Related Technologies, 2012, 35(1): 50-58.
[5] Collins S, O'keeffe M, Smyth M R. Multi-residue analysis for beta-agonists in urine and liver samples using mixed phase columns with determination by radioimmunoassay [J]. Analyst, 1994, 119(12): 2671-2674.
[6] 黄传峰, 李晓华, 吴宜群. 克伦特罗检测方法进展 [J]. 中国卫生检验杂志, 2002, 12(5): 634-636.
[7] 中华人民共和国卫生部与中国国家标准化管理委员会. GB/T 5009. 192—2003.动物性食品中克伦特罗残留量的测定 [S]. 北京:中国标准出版社, 2003.
[8] 谷峰, 薛飞群. 克伦特罗检测方法研究进展 [J]. 中国兽药杂志, 2002, 36(6): 45-48.
[9] Yang W. Integrated Affinity Column/Capillary Electrophoresis Microdevices for Biomarker Analysis [D]; Brigham Young University, 2010.
[10] Schappler J, Veuthey J L, Rudaz S. 18 Coupling CE and microchip-based devices with mass spectrometry [J]. Separation Science and Technology, 2008, (9): 477-521.
[11] Huang L, Lin J M, Yu L, et al. Improved simultaneous enantioseparation of beta-agonists in CE using beta-CD and ionic liquids [J]. Electrophoresis, 2009,30(6): 1030-1036.
[12] Chen Q, Fan L Y, Zhang W, et al. Separation and determination of abused drugs clenbuterol and salbutamol from complex extractants in swine feed by capillary zone electrophoresis with simple pretreatment [J]. Talanta, 2008, 76(2): 282-287.
[13] Suntornsuk L. Capillary electrophoresis in pharmaceutical analysis: A survey on recent applications [J]. Journal of chromatographic science, 2007, 45(9): 559-576.
[14] 李志良, 林润国, 林辉概等. 胶束动电毛细管色谱: 一种新的分离技术 [J]. 分析仪器, 1991, (2): 46-50.
[15] 罗强, 刘文涵, 张清义. 光电二极管阵列检测器在分析仪器中的应用 [J]. 浙江工业大学学报, 2001, 29(4): 374-377.
[16] Papadoyannis I N, Gika H. Peak purity determination with a diode array detector [J]. Journal of liquid chromatography & related technologies, 2005, 27(6): 1083-1092.
[17] 段建平, 陈红青, 陈颖等. 毛细管区带电泳法同时测定饲料中西马特罗, 盐酸克伦特罗和沙丁胺醇 [J]. 色谱, 2005, 23(3): 261-263.
[18] 王伟宇, 张玉莲, 邢晓平,等.小型化毛细管电泳-电化学检测法测定猪尿和猪饲料中的β-兴奋剂 [J]. 色谱,2008, 26(2): 228-231.
[19] 郑妍鹏, 曾红惠. 猪内脏中盐酸克伦特罗的毛细管电泳电导检测 [J]. 中山大学学报: 自然科学版, 2002, 41(5): 57-59.
[20] Efstatiade M, Baiulescu G. Application of electroseparation methods in β-agonist drugs characterization [J]. Analytical letters,1997, 30(15): 2755-2764.
[21] 郭怀忠, 毕开顺, 孙毓庆. 影响毛细管电泳分析结果重现性的因素及其控制 [J]. 分析仪器, 2005, (2): 42-45.
[22] Zhou J, Xu X, Wang Y. Competitive immunoassay for clenbuterol using capillary electrophoresis with laser-induced fluorescence detection [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2007, 848(2): 226-231.

