ITO电极上Tris促进[Ru(bpy)3]2+对次黄嘌呤的电催化氧化
蔡雪萍, 许 旋, 甘桂莲, 李 红
(华南师范大学化学与环境学院,广东广州 510006)
ITO电极上Tris促进[Ru(bpy)3]2+对次黄嘌呤的电催化氧化
蔡雪萍, 许 旋, 甘桂莲, 李 红*
(华南师范大学化学与环境学院,广东广州 510006)
研究了在铟锡氧化物(ITO)电极上三羟甲基氨基甲烷(Tris)促进[Ru(bpy)3]2+(bpy = 2,2′-联吡啶)对次黄嘌呤(Hx)的电催化氧化作用. 结果表明,加入Tris明显地增强了[Ru(bpy)3]2+对Hx的电催化氧化,扫描速度、溶液pH和Hx浓度对Hx电催化氧化均有明显的影响,Hx电催化氧化产物能与Tris发生后续的化学反应,[Ru(bpy)3]2+对Hx的催化氧化是基于后续化学反应增强均相电催化反应(EC′C)的机理. 在10 mmol·L-1Tris/50 mmol·L-1NaCl (pH 7.2)缓冲溶液中,Hx的电催化氧化电流在0.10~0.15 mmol/L区间随Hx浓度线性地增大,检测限为0.12 μmol/L (S/N=3).
次黄嘌呤; 多吡啶钌(II)配合物; 电催化氧化; 伏安检测
次黄嘌呤(Hx)是生物体内的代谢产物,它的分析检测一方面可以应用于食品中鱼肉新鲜度的评价[1],另一方面可以诊断病人是否患了由于尿酸过高而引起的痛风[2],因此Hx的传感分析在生物学、食品科学和临床医学等领域具有应用潜力[3]. 目前,Hx的检测方法主要包括高效液相色谱法[4]、毛细管电泳法[5]、离子交换色谱法[6]、质谱法[7]、电化学法[8]及相应的联用技术[9]. 色谱法通常具有检测灵敏度高和抗干扰能力强的优势,但是它需要昂贵的仪器,操作繁琐[10]. 电化学法因具有操作简单、成本低、灵敏度高等优点,被认为是目前值得重点发展的方法. 由于Hx在一般的固体电极上难于直接氧化,需要通过修饰Pt、Ag等纳米颗粒和黄嘌呤氧化酶来提高电极对Hx催化氧化活性[11],因此仍存在化学修饰电极被Hx氧化产物毒化的问题[12].
多吡啶钌配合物具有良好的电化学性能,已被作为媒介体应用于碱基和DNA的催化氧化研究及其光电传感分析[13]. RULSING等[14]把钌(II)配合物修饰到电极上,并作为电化学指示剂分析DNA的氧化损伤. THORP小组曾研究了钌(II)配合物和更高价态钌配合物在ITO电极上对DNA及鸟嘌呤的电催化氧化,提出了均相电催化(EC′)氧化机理[15].作者研究了[Ru(bpy)3]2+对鸟嘌呤和Hx在旋转Pt电极上的电催化氧化[16-17]. 有关钌配合物作为Hx氧化媒介体的研究涉及较少,尤其是利用后续化学反应促进Hx的电催化氧化研究尚未见文献报道. 为此,本文选[Ru(bpy)3]2+作媒介体,Hx作为被电催化氧化和分析的对象,Tris作为缓冲剂和后续化学反应物,应用电化学法、XPS和荧光光谱法研究在ITO电极上Tris促进[Ru(bpy)3]2+对Hx的电催化氧化作用及反应机理.
1 实验部分
1.1 试剂与仪器
Tris和[Ru(bpy)3]Cl2·6H2O购自Sigma公司,Hx(纯度≥99.0%)及其它试剂均为分析纯. 溶液用二次重蒸水配制,除非特别说明,Hx电催化氧化研究在含10 mmol·L-1Tris/50 mmol·L-1NaCl (pH 7.2)缓冲溶液中进行,[Ru(bpy)3]2+溶液的浓度为0.2 mmol/L. 实验在(25±2) ℃下进行.
实验主要仪器包括CHI660d电化学工作站(上海辰华仪器公司)、RF-2500荧光光谱仪(日本 Hitachi)、EscaLab 250 X-射线光电子能谱仪(XPS,美国Thermo Fisher Scientific)和PHS-3C型酸度计(上海雷磁仪器厂). XPS分析以表面污染C1s(284.8 eV)为标准进行能量校正;电化学实验采用三电极系统,工作电极为ITO电极,由深圳南玻显示器件公司提供,薄膜电阻为20 Ω/cm2,几何面积为0.72 cm2,对电极为铂片,参比电极为饱和甘汞电极(SCE).
1.2 基于[Ru(bpy)3]2+发光膜的制备
为了研究Hx对固体膜中[Ru(bpy)3]2+光致发光的影响,固定1.0 mmol/L [Ru(bpy)3]2+比例(60 μL),加入100 μL 0.2 mmol/L Hx并充分混合,滴加到ITO电极表面上(面积固定),自然晾干后放至烘箱中40 ℃干燥2 h.
2 结果与讨论
2.1 Tris增强[Ru(bpy)3]2+对Hx的电催化氧化
在0.25~1.25 V电位区间(图1),曲线1上出现了一对基于Ru(III)/Ru(II)反应的氧化还原峰,氧化峰和还原峰电位分别为1.136、1.048 V,条件电位Eo’为1.092 V,氧化峰电流与还原峰电流基本相等. 另外,图2显示扫速对峰电位基本没有影响,当扫速为0.02 V/s时,峰电位差为65 mV,氧化峰电流则随扫速的平方根增大而线性地增大(插入图),表明缓冲溶液中[Ru(bpy)3]2+氧化生成[Ru(bpy)3]3+反应基本符合可逆反应的特征,其与ITO电极间的电荷交换是一个快速的电极过程,结果为[Ru(bpy)3]2+对Hx电催化氧化奠定了基础.
当[Ru(bpy)3]2+体系中存在0.1 mmol/L Hx(图1),曲线2对比于曲线1,氧化峰电流明显增大,电位负移了14 mV,还原峰消失,曲线3显示了单独Hx在该电位区间在ITO电极上并不能发生氧化,说明[Ru(bpy)3]2+对Hx在ITO电极上的氧化具有明显的电催化作用,其催化过程可用反应(1)和(2)表示:
(1)
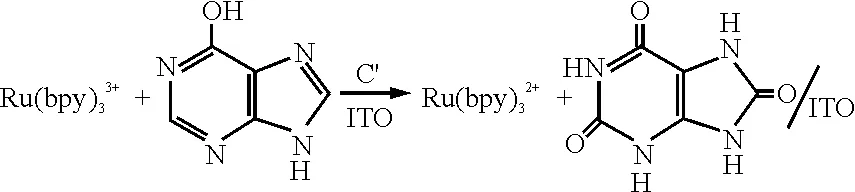
(2)
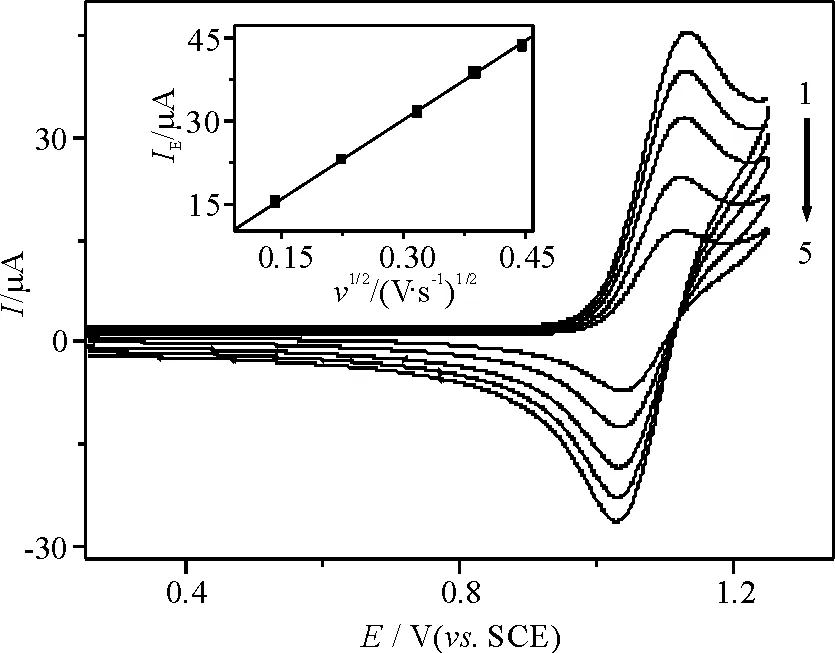
其中,反应(1)代表[Ru(bpy)3]2+在ITO电极上发生的电化学反应,(2)则代表(1)中的氧化产物与Hx反应再生成[Ru(bpy)3]2+,而Hx假定发生6e反应生成尿酸[18]. 另外,Hx的氧化峰电流随着溶液中Tris浓度的增加而增大(图3),在无Tris存在时,[Ru(bpy)3]2+对Hx的电催化氧化程度较低,Tris在该电位区间并不能发生氧化(图1曲线1),表明Tris的加入能明显地增强[Ru(bpy)3]2+对Hx的电催化氧化.
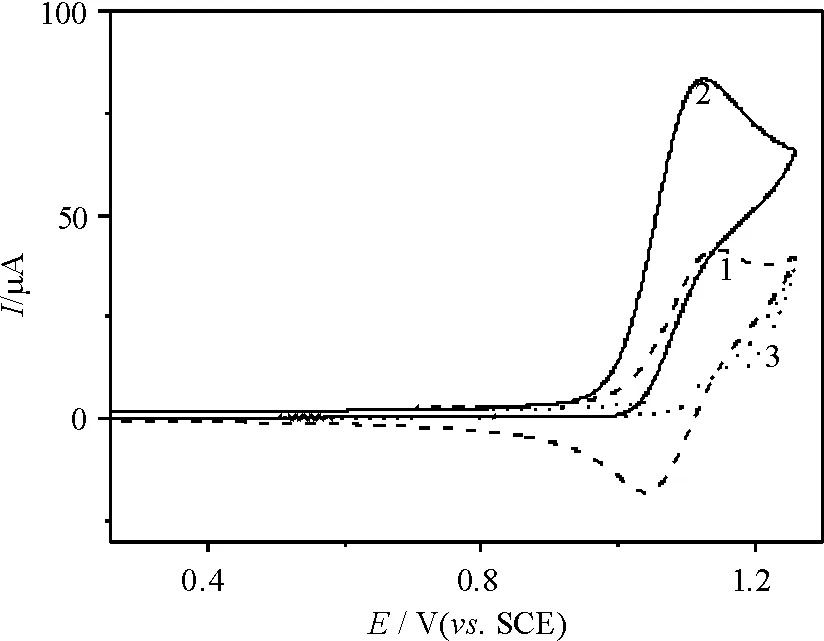
图1 [Ru(bpy)3]2+(1)、[Ru(bpy)3]2+/0.1 mmol·L-1 Hx(2)和0.1 mmol·L-1 Hx(3)在ITO电极上的循环伏安曲线,扫速:0.1 V·s-1
(1)0.20 V/s; (2)0.15 V/s; (3)0.10 V/s; (4)0.05 V/s; (5)0.02 V/s
注:插入图为氧化峰电流(IE)与扫速平方根的关系曲线
2.2 Tris促进[Ru(bpy)3]2+对Hx电催化氧化的反应机理
为了阐明Hx电催化氧化的反应机理,研究了[Ru(bpy)3]2+与Hx分子间的识别作用及扫描速度、溶液pH值、Hx浓度的影响.
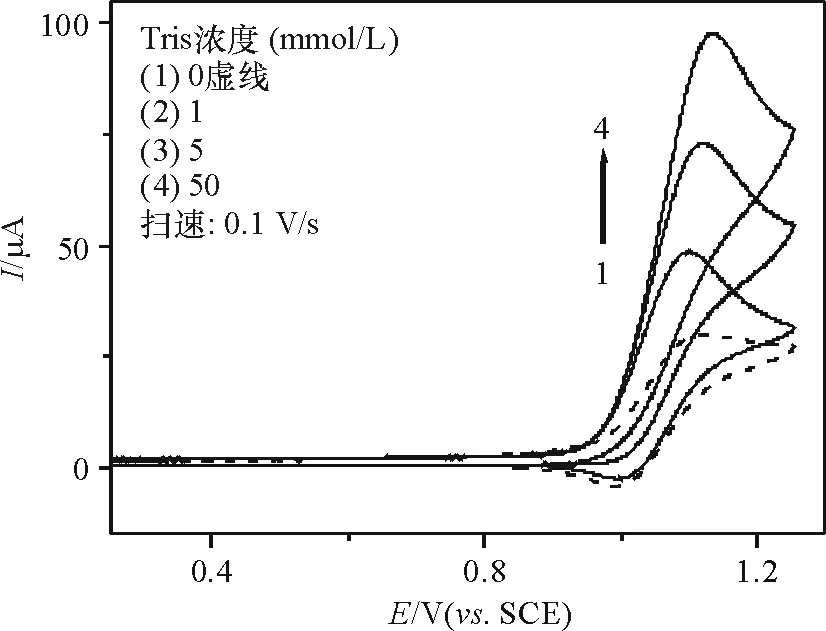
图3 [Ru(bpy)3]2+/Hx在不同Tris浓度下的循环伏安曲线
2.2.1 [Ru(bpy)3]2+与Hx分子间的识别作用 依据反应式(1)和(2)推知,[Ru(bpy)3]2+与Hx存在良好的分子间识别作用. 为了避免溶剂水对[Ru(bpy)3]3+光致发光的影响,图4显示了固相膜中Hx对[Ru(bpy)3]2+光致发光的影响. 在450 nm光的激发下,ITO表面上的[Ru(bpy)3]2+在约576 nm呈现一个清晰的发射峰. 当在[Ru(bpy)3]2+体系引入Hx时,发射峰位置基本不发生变化,但[Ru(bpy)3]2+的发光强度增大,表明[Ru(bpy)3]2+与Hx间存在较强的相互作用,Hx可能通过π-π堆积作用增强了[Ru(bpy)3]2+的发光[18],为[Ru(bpy)3]2+对Hx电催化氧化提供了有利的条件.
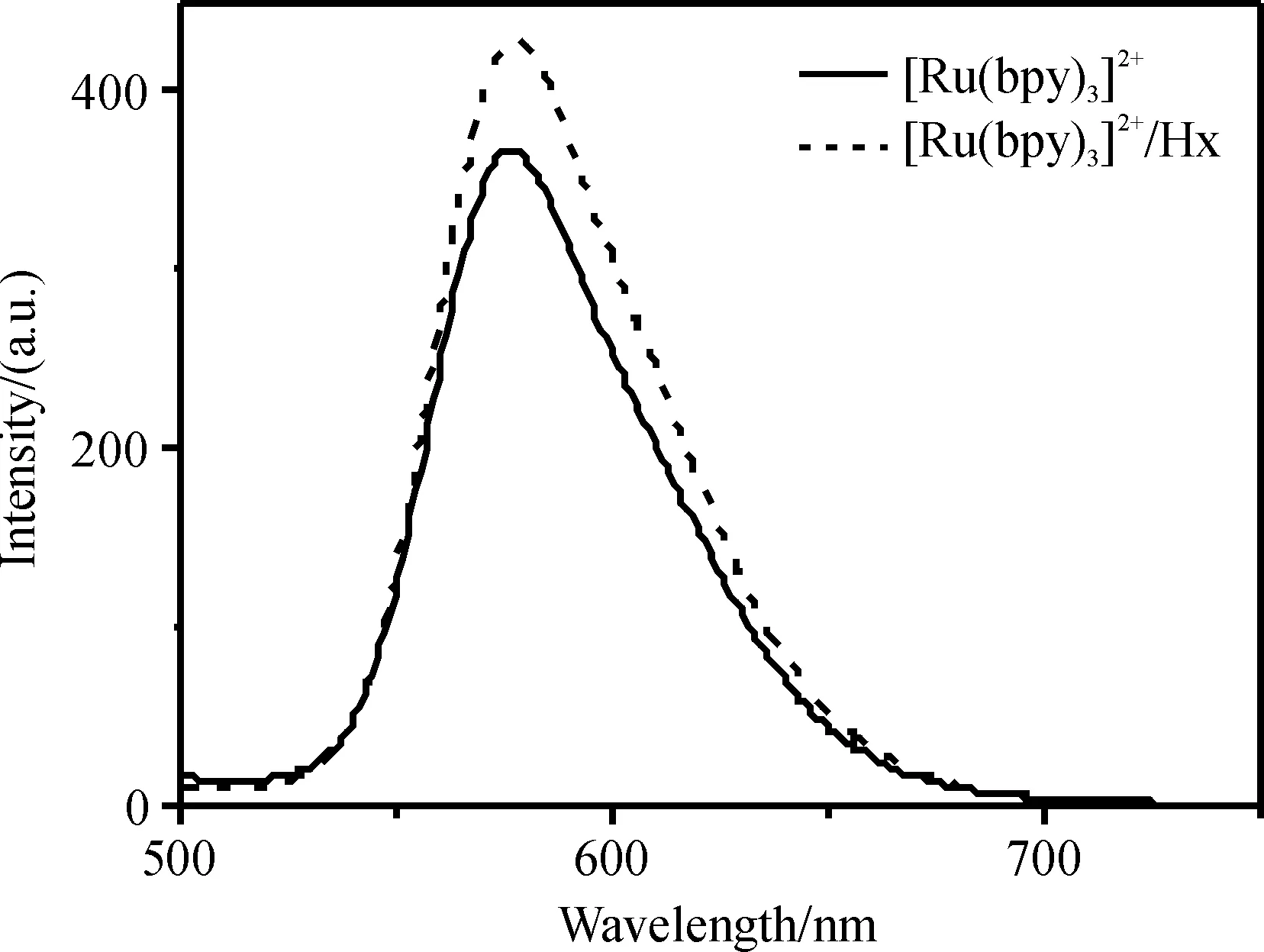
图4 ITO上[Ru(bpy)3]2+和[Ru(bpy)3]2+/Hx的荧光光谱
2.2.2 扫描速度的影响 当扫速从0.02 V/s增大至0.20 V/s(图5),氧化峰电流依次增大. 为了更好地说明扫速对Hx电催化氧化的影响,分别以IC′和IE代表[Ru(bpy)3]2+有无Hx存在时在ITO电极上的氧化峰电流,而IC′/IE则可代表[Ru(bpy)3]2+对Hx的电催化氧化效率. 从图5插图可见,IC′/IE随着扫速的增大而减小,表明扫速越慢,[Ru(bpy)3]2+氧化生成的[Ru(bpy)3]3+越有足够的时间与Hx发生化学反应,导致[Ru(bpy)3]2+对Hx的电催化氧化效率增大,由此可推测,相对于反应(1),反应(2)可能是Hx电催化氧化过程的速度控制步骤.

(1)0.20 V/s; (2)0.15 V/s; (3)0.10 V/s; (4)0.05 V/s; (5)0.02 V/s
2.2.3 pH的影响 Hx的电催化氧化在酸性条件下基本不受溶液pH的影响(图6),但在碱性条件下氧化峰电位随pH增大而负移,表明合理地增大溶液pH,有利于Hx的电催化氧化. 由于Hx的pKa约为8.9[19],在较高pH下[Ru(bpy)3]2+与Hx间的相互作用较强,有利于均相化学反应(2)的进行. 但考虑到在接近中性条件下Hx不仅有较好的电催化氧化效果,而且表现出明显的均相电催化的特征,除非特别说明,溶液pH仍采用7.2.
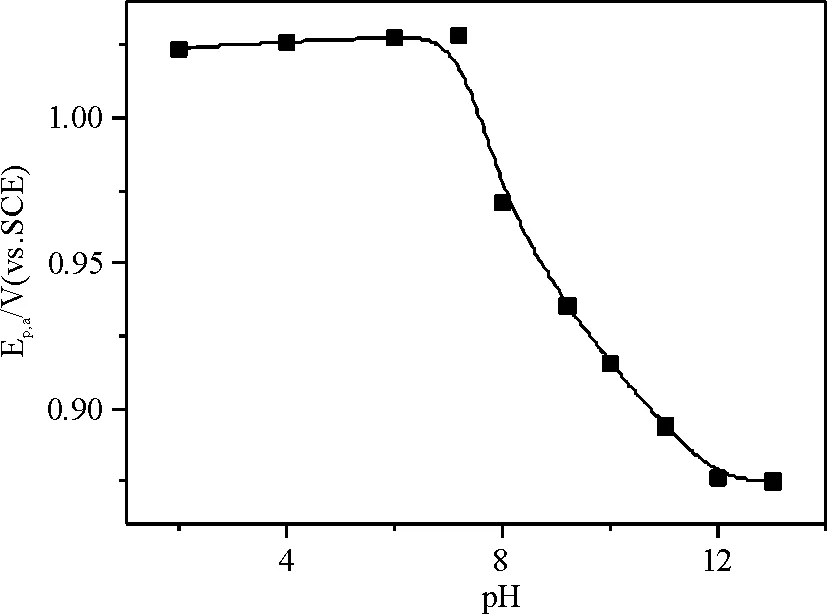
图6 pH对Hx电催化氧化峰电位的影响
2.2.4 Hx浓度的影响 适当地增大Hx浓度有利于反应(2)的进行(图7),Hx的电催化氧化峰电流随着Hx浓度增大而增大,还原峰电流减小直至消失,表现出更明显的电催化氧化特征,为Hx的伏安检测奠定基础.
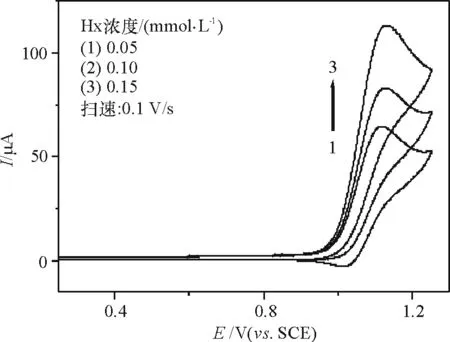
图7 [Ru(bpy)3]2+在不同Hx浓度下的循环伏安曲线
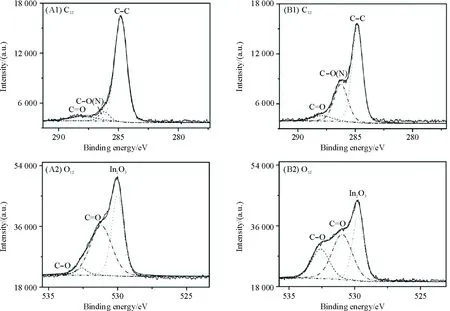
图8 在无(A1、A2)与Tris(B1、B2)存在下获得的Hx电催氧化产物的X-射线光电子能谱

(3)
2.3基于Hx电催化氧化的伏安检测
Hx的电催化氧化电流随Hx浓度增大而增大(图9),在0.10~0.15 mmol/L区间呈现良好的线性关系,相关系数为0.991,相对标准偏差为4.04% (n=3),检测限为0.12 μmol/L(S/N=3),可以应用于Hx的微量检测.
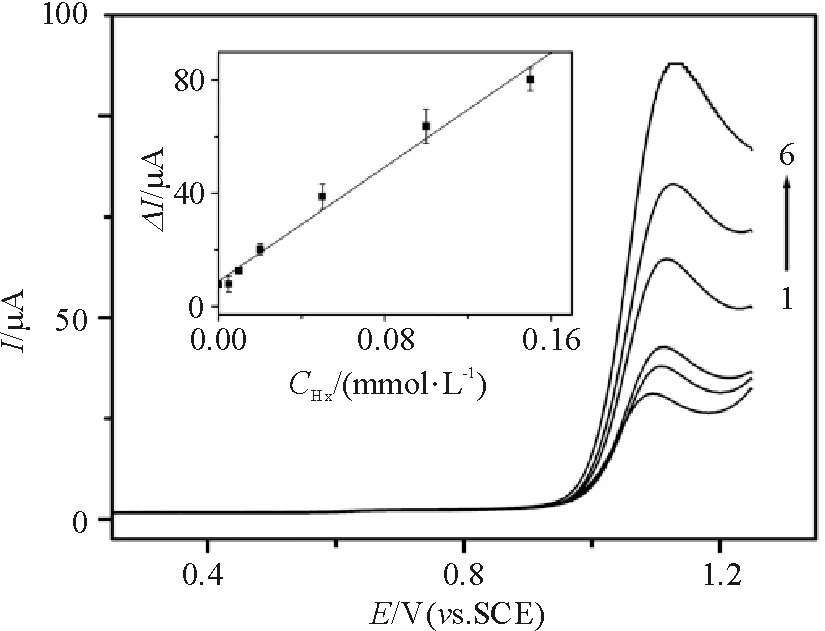
Hx浓度(mol/L): (1) 0.002; (2) 0.01; (3) 0.02; (4) 0.05; (5) 0.10; (6) 0.15, 扫速: 0.1 V/s
3 结论
Tris的加入明显地增强了[Ru(bpy)3]2+对Hx的电催化氧化,结合扫描速度、溶液pH和Hx浓度对Hx电催化氧化的影响及荧光光谱和XPS分析,阐明了Tris增强[Ru(bpy)3]2+对Hx的电催化氧化是基于EC′C反应机理,可应用于制作Hx的电流型电化学传感器,实现Hx的微量检测. Hx氧化呈现的催化电流在0.10~0.15 mmol/L区间随Hx浓度线性地增大,相关系数为0.991,检测限为0.12 μmol/L(S/N=3). 这些结果有助于理解氧化还原媒介体对嘌呤类衍生物的电催化氧化机理,为生物传感器的构建提供新思路.
[2] YAMAMOTO T, MORIWAKI Y, TAKAHASHI S. Effect of ethanol on metabolism of purine bases(hypoxanthine, xanthine, and uric acid)[J]. Clin Chim Acta, 2005, 356(1/2): 35-57.
[3] 凌云, 王新宴, 雍炜, 等. 高效液相色谱法检测肉类食品中4种嘌呤碱[J]. 分析化学, 2008, 36(6): 724-728.
[4] FARTHING D, SICA D, GEHR T, et al. An HPLC method for determination of inosine and hypoxanthine in human plasma from healthy volunteers and patients presenting with potential acute cardiac ischemia[J]. J Chromatogr B, 2007, 854(1/2): 158-164.
[5] SOGA T, OHASHI Y, UENO Y, et al. Quantitative metabolome analysis using capillary electrophoresis mass spectrometry[J]. J Proteome Res, 2003, 2(5): 488-494.
[6] 侯升杰, 明玉. 阳离子交换色谱法同时测定啤酒和鲱鱼精脱氧核糖核酸中的碱基和核苷[J]. 分析化学, 2011, 39(3): 405-408.
[7] GAO J L, LEUNG K S Y, WANG Y T, et al. Qualitative and quantitative analyses of nucleosides and nucleobases in Ganoderma spp. by HPLC-DAD-MS[J]. J Pharm Biomed Anal, 2007, 44(3): 807-811.
[8] ZEN J M, LAI Y Y, ILANGOVAN G, et al. Electrocatalytic oxidation of hypoxanthine on a Nafion/lead-ruthenium oxide pyrochlore modified electrode[J]. Electroanalysis, 2000, 12(4): 280-286.
[9] PEI J, LI X. Xanthine and hypoxanthine sensors based on xanthine oxidase immobilized on a CuPtCl6chemically modified electrode and liquid chromatography electrochemical detection[J]. Anal Chim Acta, 2000, 414(1/2): 205-213.
[10] FARTHING D, SICA D, GEHR T, et al. An HPLC method for determination of inosine and hypoxanthine in human plasma from healthy volunteers and patients presenting with potential acute cardiac ischemia[J]. J Chromatogr B, 2007, 854(1/2): 158-164.
[12] KUMAR A S, SWETHA P. Ru(DMSO)4Cl2nano-aggregated Nafion membrane modified electrode for simultaneous electrochemical detection of hypoxanthine, xanthine and uric acid[J]. J Electroanal Chem, 2010, 642(2): 135-142.
[13] TAN C P, LIU J, CHEN L M, et al. Synthesis, structural characteristics, DNA binding properties and cytotoxicity studies of a series of Ru(III) complexes[J]. J Inorg Biochem, 2008, 102(8): 1644-1653.
[15] ARMISTEAD P M, THORP H H. Oxidation kinetics of guanine in DNA molecules adsorbed onto indium tin oxide electrodes[J]. Anal Chem, 2001, 73(3): 558-564.
[16] CHEN M J, WENG X M, HE L Q, et al. Electrocatalytic activity of [Ru(bpy)3]2+toward guanine oxidation upon incorporation of surfactants and SWCNTs[J]. J Appl Electrochem, 2011, 41(7): 795-801.
[17] YAN X, LI H, XU Z, et al. Electrocatalytic activity of [Ru(bpy)3]2+for hypoxanthine oxidation studied by rotating electrode methods[J]. Bioelectrochemistry, 2009, 74(2): 310-314.
[18] CONWAY A C, GOYAL R N, DRYHURST G. Electrochemical oxidation of hypoxanthine[J]. J Electroanal Chem, 1981, 123(2): 243-264.
[19] NIKLASSON F. Simultaneous liquid-chromatographic determination of hypoxanthine, xanthine, urate, and creatinine in cerebrospinal fluid, with direct injection[J]. Clin Chem, 1983, 29: 1543-1546.
Keywords: hypoxanthine; polypyridyl ruthenium(II) complex; electrocatalytic oxidation; voltammetric detection
Tris-EnhancedElectrocatalyticOxidationofHypoxanthineby[Ru(bpy)3]2+onanITOElectrode
CAI Xueping, XU Xuan, GAN Guilian, LI Hong*
(Department of Chemistry and Environment, South China Normal University, Guangzhou 510006, China)
The electrocatalytic oxidation of hypoxanthine (Hx) by [Ru(bpy)3]2+(bpy = 2,2′-bipyridine) on an indium-tin oxide (ITO) electrode upon incorporation of tris(hydroxymethyl)aminomethane (Tris) has been investigated. The addition of Tris is found to obviously promote the electrocatalytic oxidation of Hx by [Ru(bpy)3]2+on the ITO electrode. The electrocatalytic oxidation of Hx is influenced by scan rate, pH value and Hx concentration. The XPS analysis reveals the presence of following chemical reactions between the oxidized products of Hx and Tris. Taken together, the electrochemical oxidation of Hx in Tris-containing buffer solutions is attributed to an EC′C mechanism, which is a special type of following chemical reaction coupled to the homogeneous electrocatalysis. In buffer solutions containing 10 mmol·L-1Tris/50 mmol·L-1NaCl (pH 7.2), the electrocatalytic currents increase linearly with increasing Hx concentration in the range from 0.1 μmol·L-1to 0.15 mmol·L-1. The detection limit of Hx is 0.12 μmol·L-1(S/N=3).
2013-04-17
国家自然科学基金项目(21271075);广东省自然科学基金项目(10351063101000001)
*通讯作者:李红,教授,Email: lihong@scnu.edu.cn.
1000-5463(2013)05-0068-06
O657.1
A
10.6054/j.jscnun.2013.07.016
【中文责编:成文 英文责编:李海航】

