转基因番茄中外源目的蛋白提取液的筛选
钱昱霏,刘建国,白国辉,2,管晓燕,韩 琪,白朋元
(1.遵义医学院 口腔学院,贵州 遵义 563099;2.遵义医学院 医学与生物学研究中心,贵州 遵义 563099)
转基因番茄中外源目的蛋白提取液的筛选
钱昱霏1,刘建国1,白国辉1,2,管晓燕1,韩 琪1,白朋元1
(1.遵义医学院 口腔学院,贵州 遵义 563099;2.遵义医学院 医学与生物学研究中心,贵州 遵义 563099)
目的比较两种不同配方的蛋白提取液提取转基因番茄蛋白的效果。方法用A、B两种植物蛋白提取液提取相同防龋用转基因番茄蛋白,运用western blot、BCA法和间接ELISA法对提取出的转基因番茄外源目的蛋白进行检测。结果两种提取液提取的蛋白样品均在相对分子质量约为60 KDa处出现了低分子量蛋白条带,但植物蛋白提取液B所提取蛋白样品条带更清晰。蛋白提取液A、B分别提取的相同转基因番茄总蛋白为8.375 mg/mL和12.838 mg/mL,而其外源目的蛋白的含量分别是0.335 μg/mL和1.16 μg/mL,比值为2.25倍。经重复实验验证B液提取的目的蛋白在总蛋白含量的百分比较A液所提取的高,具有统计学意义(P<0.05)。结论植物蛋白提取液B提取转基因番茄中外源目的蛋白较提取液A更为高效并且省时。
转基因番茄;植物蛋白提取液;变异链球菌;外源目的蛋白
植物转基因技术是通过研究植物自身性状并改变其基因来调控植物的生长和发育的手段之一。目前国内外研究中发现转基因植物中外源目的蛋白的含量很低,如何提取并获得高效、高浓度的转基因植物外源目的蛋白已成为转基因检测技术的重点之一。本课题组前期运用番茄作为生物反应器,对表达了变异链球菌毒力因子表面蛋白 PAc与霍乱毒素B亚单位(CTB)嵌合基因的转基因番茄防龋疫苗进行了遗传稳定性、生态安全性和免疫动物安全性等系列研究[1-5]。本实验用两种不同配方的转基因植物蛋白提取液提取转基因番茄中的外源蛋白,比较两种提取液的提取效果。
1 材料与方法
1.1 材料和主要试剂 含外源重组基因pacA-ctxB的转基因番茄果实(本课题组前期培育);表面蛋白抗原PAc,抗PAc抗体(本课题组前期提取);增强型BCA蛋白浓度测定试剂盒(碧云天生物技术研究所);800CW标记山羊抗兔二抗(基因有限公司);辣根过氧化物酶标记山羊抗兔IgG(碧云天生物技术研究所)。
1.2 方法
1.2.1 植物蛋白提取液配制[6-7]分别按以下配方配制植物蛋白提取液A、B, 4℃保存(见表1)。
表1植物蛋白提取液配方
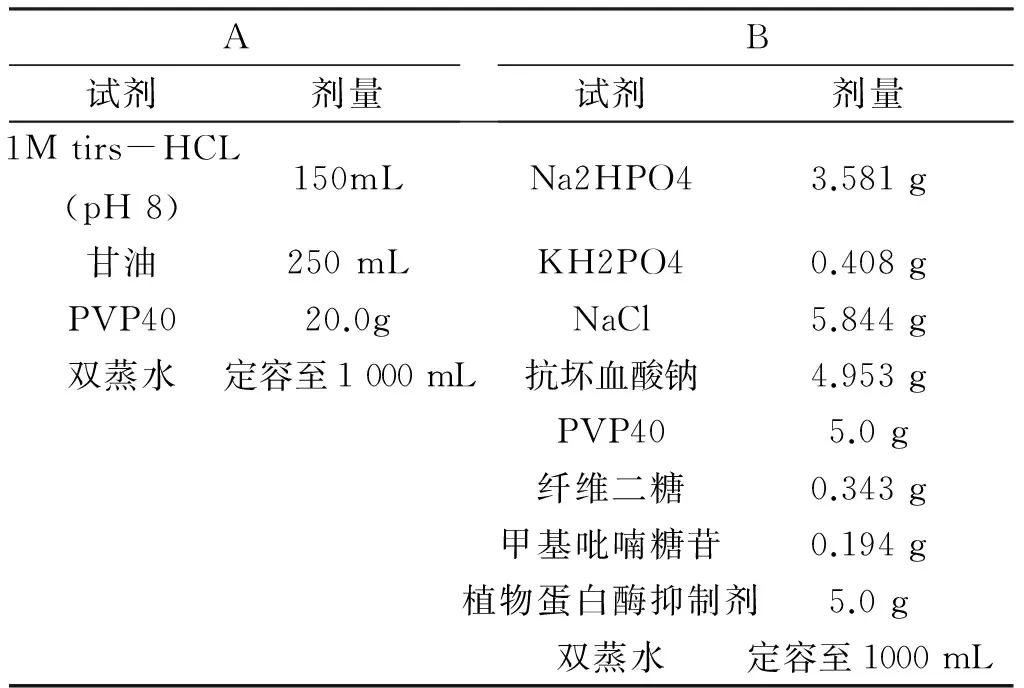
A试剂剂量B试剂剂量1Mtirs-HCL(pH8)150mLNa2HPO43.581g甘油250mLKH2PO40.408gPVP4020.0gNaCl5.844g双蒸水定容至1000mL抗坏血酸钠4.953gPVP405.0g纤维二糖0.343g甲基吡喃糖苷0.194g植物蛋白酶抑制剂5.0g双蒸水定容至1000mL
1.2.2 实验总流程 用本课题组前期培育的20株转基因番茄果实每株都用A、B两种提取液提取总蛋白后,Western blot 进行将筛选出含目的蛋白的5株转基因番茄做总蛋白和目的蛋白浓度的进一步研究,比较这5株样品分别用A、B液提取总蛋白,BCA法确定样品中总蛋白量,ELISA法确定样品中外源蛋白量,最后计算出目的蛋白浓度占可溶性总蛋白浓度的比例。该实验过程重复5次。
1.2.3 转基因番茄总蛋白的提取 将每株转基因番茄果肉取2 g,平均分为两份放入提前置于冰上的两个不同研钵中,每钵体中有果肉组织1 g。将每个研钵的果肉剪成小块,加入液氮研磨成粉,其中1个研钵中加入预冷的植物蛋白提取液A 3.5 mL匀浆后,静置4 h(操作均在冰上完成)使其充分裂解。4 ℃,14 000 rpm×15 min离心,取上清1 mL/只分装并标记,-20 ℃保存。另1个研钵加入同样预冷的植物蛋白提取液B 3.5 mL,用研杵顺时针用力适中充分匀浆,直接于4 ℃,14 000 rpm×15 min离心,上清过滤后,1 mL/只分装并标记,-20 ℃保存。共40份样品。
1.2.4 Western blot筛选目的蛋白表达的番茄植株 将转基因番茄蛋白溶液与蛋白上样缓冲液按比例混合后在沸水中水浴加热5 min,制成变性蛋白质样品,经SDS-PAGE电泳后转印(45 V,4 h)在PVDF膜上。抗PAc抗体为一抗,800 cw标记山羊抗兔二抗对目的蛋白进行Western blot分析。
1.2.5 总蛋白的含量测定 将含目的蛋白的转基因番茄蛋白样品用BAC法按产品说明进行检测及初步的定量。取5株含目的蛋白的转基因番茄蛋白样品根据BCA标准品稀释浓度梯度后测波长为562 nm时的线性方程,通过OD值计算出总蛋白浓度。
1.2.6 ELISA法测定目的蛋白的浓度 分别取PAc标准蛋白浓度梯度液、转基因番茄蛋白提取液和抗原包被液包被酶标板,每孔100 μL,各3孔,4 ℃孵育过夜。次日弃液每孔加入150 μL抗原包被液,室温放3 min后再各孔加入100 μL封闭液37 ℃湿盒湿育2 h。洗板,每孔加入100 μL抗PAc抗体(一抗,1:80)37 ℃湿盒湿育2 h。洗板,每孔加入100 μL HRP标记的山羊抗兔IgG-HRP(二抗,1:1000)37 ℃湿盒湿育1 h。洗板,每孔加入100 μL第五反应液,37 ℃暗反应15 min后每孔加入50 μL终止液终止反应。于酶标仪上记录波长490 nm处的线性方程,并通过样本OD值算出外源目的蛋白浓度。
1.2.7 数据处理 将含有外源目的蛋白PAcA-CTB的同植株用两种提取液分别提取的蛋白进行重复实验后,实验数据用SPSS17.0统计软件,采用独立样本t检验进行统计分析。
2 结果
2.1 转基因番茄目的蛋白的表达 将两种不同植物蛋白提取液所提取的相同转基因番茄果实蛋白样品进行Western blot检测,筛选出含有相对分子质量约为60kDa蛋白(即PAcA-CTB蛋白)的样品,共12株(见图1)。
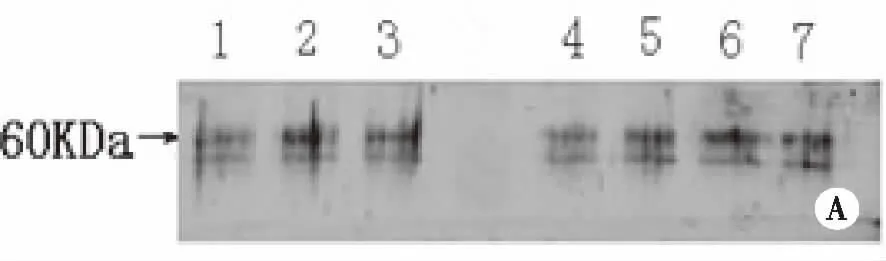
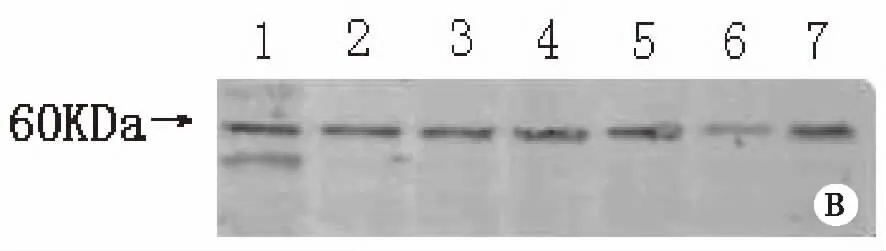
注:A:1-7:植物蛋白提取液A所提转基因番茄样本;B:1-7:植物蛋白提取液B所提转基因番茄样本。 图1 Western blot筛选表达了外源目的蛋白的转基因番茄植株
2.2 转基因番茄总蛋白的含量 根据BCA法检测的线性方程:Y=1.0822X+0.1249,相关系数R=0.9987,可见OD值随蛋白浓度增加而增大(见图2)。测得用A液提取的含PAcA-CTB蛋白的转基因番茄样本稀释60倍后的浓度为0.1 346 mg/mL,用B液提取的含PAcA-CTB蛋白的转基因番茄样本稀释70倍后的浓度为0.1 834 mg/mL,因此计算得出A液提取的含PAcA-CTB蛋白的转基因番茄样本总蛋白浓度为8.375mg/mL,B液提取的含PAcA-CTB蛋白的转基因番茄样本总蛋白浓度为12.838 mg/mL。
2.3 转基因番茄外源目的蛋白的表达量 用间接ELISA法检测的线性方程:Y=1.278X+0.1376,相关系数R=0.9839,显示OD值随蛋白浓度增加而增大(见图3)。其用A液提取的含PAcA-CTB蛋白的转基因番茄样本稀释5倍后的浓度为0.067 μg/mL,用B液提取的含PAcA-CTB蛋白的转基因番茄样本稀释5倍后的浓度为0.232 μg/mL,因此计算得出A液提取的含PAcA-CTB蛋白的转基因番茄样本总蛋白浓度为0.335 μg/mL,B液提取的含PAcA-CTB蛋白的转基因番茄样本总蛋白浓度为1.16 μg/mL。
根据2.2所得的转基因番茄总蛋白浓度可算出,用A液提取的含PAcA-CTB蛋白的转基因番茄外源目的蛋白所占的比例为0.004%,用B液提取的含PAcA-CTB蛋白的转基因番茄外源目的蛋白所占的比例为0.009%,后者为前者的2.25倍。
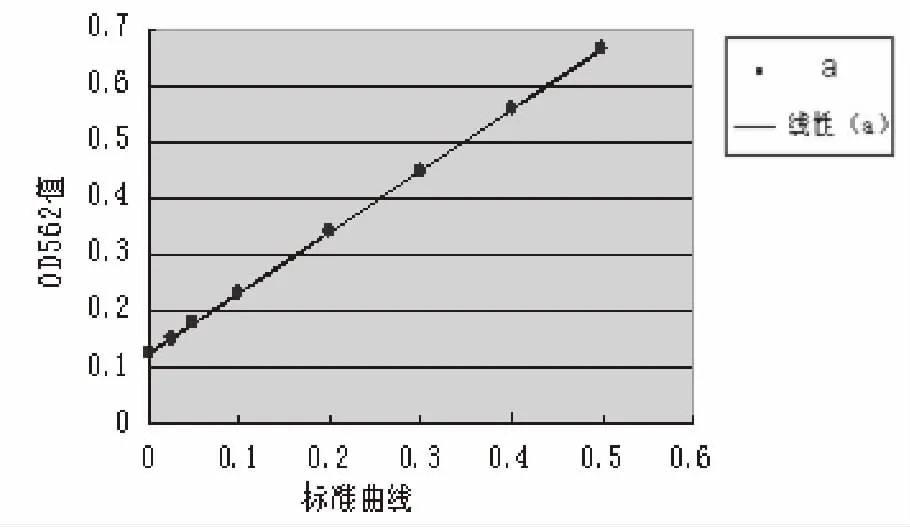
图2 转基因番茄的总蛋白曲线
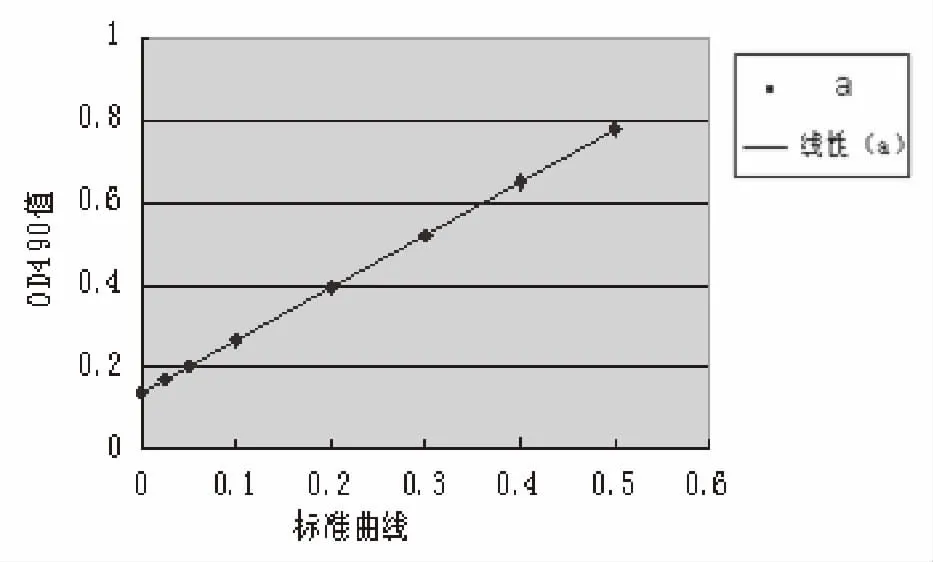
图3 转基因番茄的目的蛋白曲线
2.4 数据处理 进行5次重复实验后,将两种提取液分别提取的每株转基因番茄的总蛋白浓度和目的蛋白在总蛋白含量的百分比分别进行组间比较,又均值可看出,B液提取的总蛋白浓度和百分比含量的均值都比A液大,且运用独立样本t检验进行两两比较,结果均有统计学意义(P<0.05,见表2,3)。
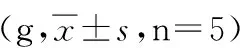

分组实验次数12345A8.119±0.0107.841±0.1128.375±0.2757.949±0.0968.350±0.298B12.859±0.00212.811±0.00112.838±0.02712.787±0.00312.803±0.004
注:A:用蛋白提取液A提取的蛋白组;B:用蛋白提取液A提取的蛋白组;P<0.05。
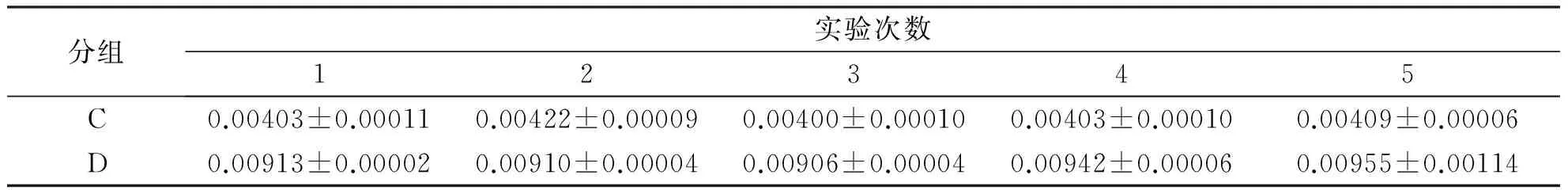
分组实验次数12345C0.00403±0.000110.00422±0.000090.00400±0.000100.00403±0.000100.00409±0.00006D0.00913±0.000020.00910±0.000040.00906±0.000040.00942±0.000060.00955±0.00114
注:C:用蛋白提取液A提取的蛋白组;D:用蛋白提取液A提取的蛋白组,P<0.05。
3讨论
3.1 两种植物蛋白提取液提取结果的比较 实验中运用两种不同蛋白提取液提取20株转基因番茄5次,并进行检测。western blot筛选出12株含目的蛋白的转基因番茄,均在相对分子质量约为60KDa处出现了低分子量蛋白条带,说明两种植物蛋白提取液均能提取出含PAcA-CTB蛋白的转基因番茄蛋白样品。B液所提取出的蛋白样品本身就相对A液所提取出的较浓稠,蛋白条带颜色较深、纵条纹干扰少并且更为清晰。再将5次测得的总蛋白浓度和目的蛋白占总蛋白浓度的百分比分别进行统计求出均值,发现两种提取液提取的同株番茄的总蛋白含量和目的蛋白占总蛋白含量的百分比的均值中都显示了后者大于前者(见表2,3),再将5次的实验结果进行两组之间的比较发现P<0.05,具有统计学意义。根据总蛋白浓度检测和ELISA间接法对外源目的蛋白检测得出含PAcA-CTB蛋白的转基因番茄外源目的蛋白所占的比例显示,B液所提取的含PAcA-CTB蛋白的转基因番茄外源目的蛋白比例是A液所提取的2.25倍。前期课题组就发现B液所提取的含PAcA-CTB蛋白的转基因番茄外源目的蛋白比例比A液所提取的蛋白样品外源目的蛋白高[6-7],由于本实验的转基因植物是本课题组前期种植结果后放置于-20℃保存一段时间,未能用新鲜的植株果实进行实验,故其蛋白可能因时间原因发生降解,得到的值可能相应降低。但本课题组前期的实验结果与该实验结果趋势是吻合的。
3.2 两种植物蛋白提取液的比较 提取植物蛋白的过程中应避免蛋白质的损失和降解,运用植物蛋白提取液充分溶解植物蛋白质是进行后续蛋白检测的先决条件。本实验中,就植物蛋白提取液所提取蛋白的过程里,将植物放入研钵加入液氮研磨成粉后加入提取液A则需要静置4h才能离心取上清,而加入提取液B只需充分匀浆后可即刻离心取上清,大大缩短了实验时间。
Tris-HCL缓冲液作用较多,被广泛用作核酸和蛋白质的溶剂,同时也是蛋白质电泳缓冲液的主要成分之一。此外,还可作为表面活性剂、硫化促进剂和一些药物。Tris也被用作滴定标准物。甘油主要用作保湿剂、保润剂、吸湿剂、润滑剂、柔软剂、软化剂、增稠剂、增塑剂、稀释剂、防冻剂等。聚乙烯吡咯烷酮(简称聚维酮;PVP)的用途广泛,是良好的澄清剂、吸附剂、着色稳定剂和肢体稳定剂。PVP40是PVP K40的简称,是聚乙烯吡咯烷酮(简称聚维酮)系列中分子量(K值)在40左右的高分子聚合物,与PVP K30的性质基本相同。只是K值增大了,聚合物的分子量也增大,溶液粘度相应提高。在蛋白质提取过程中,经常受植物组织中色素、酚类、醌类等次生代谢物质的干扰,我们通过在液氮中加入少量PVP,吸附组织中的色素和酚类物质,同时也可保证样品在液氮中的充分研磨[8],从而尽可能的去除上述的杂质。且大分子量的PVP能够提高蛋白的稳定性[9]。Na2HPO4、KH2PO4在化学分析中起缓冲剂的作用,NaCl则作为防腐剂。抗坏血酸离子是维生素C的药效基团,维生素C具有抗氧化作用,因此抗坏血酸钠在配方中则是作为抗氧化剂存在,能中和氧气和氧自由基[10]。植物的主要成分是纤维素,纤维素的基本结构则是纤维二糖。纤维二糖是由两个葡萄糖通过β-1,4-糖苷键连接而形成的二糖, 纤维二糖是纤维素水解的产物,也是纤维素的基本结构单元[11]。Shafeeq 等[12]指出运用纤维二糖在假设植物的碳水化合物的自然环境下对肺炎链球菌的转录层面进行调控,研究出纤维二糖对其操纵子有稳定作用。甲基吡喃糖苷是竞争性洗脱物。从两种配方的试剂可以看出提取转基因防龋用番茄中外源目的蛋白效果好的提取液B不仅运用了稳定剂、缓冲剂、防腐剂、还原剂和植物蛋白酶抑制剂,最重要的是根据植物自身的特点运用纤维二糖生成纤维素作为植物的“细菌”,利用自身分泌的纤维素酶来分解植物遗体。当亲和纯化一些糖蛋白时,用甲基吡喃糖苷可以把亲和在填料上的糖蛋白给竞争掉,从而洗脱下所要的目的糖蛋白 。从上述配方成分可看出B液配方较A液提取的蛋白样品更加的稳定。运用B液提取的转基因植物的蛋白样品外源目的蛋白丢失相对降低,且实验操作较为省时,并能从转基因植物中提取出高浓度的外源目的蛋白,为下一步的转基因植物检测应用奠定了基础。总之,植物蛋白提取液B提取的转基因番茄外源目的蛋白较提取液A更为高效并且省时。
[1] 刘建国,韩琪,白鹏元,等.防龋用转基因番茄中外源目的蛋白PAcA/CTB表达稳定性研究[C].南京:中华口腔医学会学术年会,2011.9.
[2]白朋元.防龋用转基因番茄和生菜中目的基因遗传传递的初步分析[D].遵义医学院硕士学位论文,2011.
[3]白国辉,刘建国,田源,等.防龋用转基因番茄生态安全性的评价研究[J].牙体牙髓牙周病学杂志,2011,21(5):245-249.
[4]白国辉,刘建国,田源,等.转基因番茄防龋疫苗急性和亚慢性毒性实验研究[J].贵州农业科学,2011,39(4):146-149.
[5]田源,刘建国,白国辉,等.转基因番茄防龋疫苗致突变和生殖毒性试验的研究[J].环境与健康,2011,28(5):393-396.
[6]白国辉.转基因番茄防龋疫苗安全性的初步研究[D].遵义医学院硕士学位论文,2010.
[7]韩琪.防龋用转基因番茄中外源目的蛋白表达稳定性研究[D].遵义医学院硕士学位论文,2011.
[8]陈蕊红,张改生,刘卫,等.小麦花药蛋白质组双向电泳技术体系的优化[J].核农学报,2008,22(4):404-409.
[9]陈麟凤,刘景汉,欧阳锡林,等. 人红细胞冻干保护剂配方及浓度的优化[J]. 中国实验血液学杂志,2009,17(5):1368-1372.
[10] 叶国,李丛华,杨霞,等.抗坏血酸钠凝胶增强冷光美白术后牙釉质与复合树脂即刻粘接强度的实验研究[J].第三军医大学学报,2012,34(18):1905-1909.
[11]赵越,武彬, 阎伯旭,等. 纤维二糖抑制外切纤维素酶水解作用机理的分析[J].中国科学,2003,33(5):454-460.
[12]Shafeeq S,Kuipers O P,Kloosterman T G.Cekkobiose-Mediated Gene Expression in Streptococcion pneumoniae:A Repressor Function of the Novel GntR-Tupe Regulator BguR[J]. PLoS One,2013,8(2):57586.
[收稿2013-01-14;修回2013-03-17]
(编辑:谭秀荣)
Screeningofextractionoftransgenictomatoexpressingtargetprotein
Qianyufei1,Liujianguo1,Baiguohui1,2,Guanxiaoyan1,Hanqi1,Baipengyuan1
(1.Stomatological School, Zunyi Medical University, Guizhou Zunyi 563099, China; 2.The center for medicine and biology, Zunyi Medical University, Guizhou Zunyi 563099, China)
ObjectiveTo compare two kinds of extraction method of transgenic tomato expressing target protein by optimizing the reagent formula.MethodsTwo kinds of plant protein extracting solution A and B were applied to extract genetically modified tomato protein for caries prevention. Western blot analysis, BCA assay and indirect ELISA method were performed to test exogenous protein level of transgenic tomato.ResultsThe protein samples extracted from two extracting solution were all appeared The low density protein bands with relative molecular weight of 60 KD were shown in the protein samples extracted from two extracting solution. The extracted protein sample bands of plant protein extracting solution B were thicker and more distinct than those in solution A. The total protein contents of transgenic tomato extracted from solution A and B were 8.375 mg/mL and 12.838 mg/mL, while exogenous target protein levels were 0.335 μg/mL and 1.16 μg/mL, respectively, with the ratio of 2.25 times. The percentage of purpose protein in total protein extracted from solution B through repeated experiments was more than that from solution A (P<0.05).ConclusionThe extraction method using plant protein extracting solution B is an efficient and timesaving mthod of transgenic tomato expressing target protein extraction.
Transgenic tomato; plant protein extracting solution; streptococcus mutans; exogenous purpose protein
S641.2
A
1000-2715(2013)02-0116-05
国家自然科学基金项目(NO:30160086,81260164);贵州省优秀科技人才省长专项基金项目(NO:黔省专合字[2006]44);贵州省科技攻关项目(NO:黔科合SY字[2012]3086);贵州省科技厅联合基金项目(NO:黔科合J字LKZ[2011]41)。
刘建国,男,教授,硕士生导师,研究方向:龋病和氟斑牙相关研究,E-mail:13087891001@163.com。

