增生性瘢痕不同时期成纤维细胞体外诱导分化的初步研究
龙 艳,王达利,魏在荣,郭常敏
(遵义医学院附属医院 烧伤整形外科,贵州 遵义 563099)
增生性瘢痕不同时期成纤维细胞体外诱导分化的初步研究
龙 艳,王达利,魏在荣,郭常敏
(遵义医学院附属医院 烧伤整形外科,贵州 遵义 563099)
目的体外分离培养人肉芽组织、1年及2年增生性瘢痕不同时期的成纤维细胞,探讨其成骨、成脂、成软骨分化潜能,为创面修复治疗提供新的供体细胞来源。方法采用机械法结合酶消化法分离培养肉芽组织、1年及2年增生性瘢痕成纤维细胞,倒置相差显微镜下观察细胞形态及增殖情况,并绘制成纤维细胞的生长曲线。免疫细胞化学法检测Vimentin和CK19的表达。通过向成骨、成脂、成软骨细胞诱导分化鉴定多向分化潜能。结果成纤维细胞主要以长梭形为主,呈放射状、旋涡状生长;肉芽组织成纤维细胞增殖活力最强。三种来源的成纤维细胞均表达Vimentin,不表达CK19,经诱导可向骨、脂肪、软骨细胞方向分化。结论人肉芽组织到增生性瘢痕不同时期的成纤维细胞具有多向分化潜能,可作为创面修复治疗及组织工程研究的理想供体细胞。
增生性瘢痕;肉芽组织;成纤维细胞;诱导分化
增生性瘢痕是皮肤创伤后过度愈合的一种必然的不良结果,可引起受累部位外形损毁和不同程度的功能障碍,一直是整形外科领域研究的热点之一。成纤维细胞(fibroblasts,FB)是创伤愈合的主要修复细胞[1],参与了创伤愈合的全过程,其生物学行为直接决定着创面愈合的质量与结果[2]。Lekic 等[3]将成纤维细胞比作损伤组织修复的工程师、建筑者和管理员。近来有研究表明成纤维细胞可能是间充质干细胞的“新外衣”,表现出间充质干细胞的生物学特性[4]。也有研究表明真皮来源的成纤维细胞可以向骨、脂肪、软骨等多种组织细胞分化[5]。本实验选取从肉芽组织到增生性瘢痕不同时期的成纤维细胞作为研究对象,对其进行免疫学鉴定及成骨、成脂、成软骨细胞方向诱导分化,探讨不同来源成纤维细胞的诱导分化潜力及其作为创面修复和组织工程供体细胞的可能性。
1 材料与方法
1.1 标本来源及制备 所有实验样品取自遵义医学院附属医院烧伤整形外科住院患者,并经患者及家属知情同意。人创面肉芽组织标本取自深度烧伤患者第14天的创面,年龄25岁,创面局部无感染,无全身其它器质性病变。1年及2年增生性瘢痕患者,年龄20~30岁,均为初次就诊,未接受过任何治疗,无全身其它器质性疾病,以手术治疗瘢痕病变,切取废弃瘢痕组织置于L-DMEM培养基(含青霉素100 U/mL,链霉素100μg/mL),转移至细胞培养室进行后续实验操作。
1.2 主要实验试剂 L-DMEM培养基(低糖)、胎牛血清、胰蛋白酶(含EDTA)、Ⅰ型胶原酶、中性蛋白酶、L-谷氨酰胺、青霉素、链霉素购于美国Gibco公司;bFGF购于美国Peprotech公司;免疫细胞化学小鼠抗人CK19单克隆抗体、小鼠抗人Vimentin单克隆抗体、二步法抗兔(鼠)通用型免疫组织化学检测试剂盒购于基因科技(上海)有限公司,人间充质干细胞成骨细胞、成软骨细胞、成脂肪细胞诱导培养基购于中国Cyagen公司。
1.3 不同来源成纤维细胞的分离与培养
1.3.1 肉芽组织成纤维细胞分离培养 严格无菌条件下用含100 U/mL青霉素、100μg/mL链霉素的D-PBS充分洗涤样品3~5次,手术剪剔除浅层污染的肉芽组织,D-PBS洗涤3次,尽量剔除血管成分,将样品剪成2 mm×2 mm×2 mm大小的组织块,D-PBS充分洗涤3次,再剪碎至糊状,并转移至含0.1%Ⅰ型胶原酶(1:2)离心管中,于37℃水浴恒温摇床振荡消化约2 h,用等体积含10%FBS的L-DMEM培养液终止消化,经200目孔径滤网过滤收集滤液,1 500 rpm离心10 min,弃上清,按1×105/mL细胞密度用含10%FBS、1%谷氨酰胺、100 U/mL青霉素、100 μg/mL链霉素的L-DMEM培养液,置于37℃、5%CO2饱和湿度孵箱内培养。48 h后首次换液,以后每2~3 d换液一次。待原代细胞生长汇合度达80%~90%时,采用0.125%胰蛋白酶-0.02% EDTA进行消化,细胞按1:2的比例进行传代培养(传代用培养基系在原代培养基的基础上添加5 ng/mL bFGF)。
1.3.2 1年和2年增生性瘢痕组织成纤维细胞分离培养 将瘢痕组织用含双抗的D-PBS清洗3~5次,除皮下组织,剪切成5 mm×5 mm左右的组织块,移入无菌玻璃瓶,用0.4%的中性蛋白酶于37℃消化25~30 min,剪去表皮,将真皮组织剪成糊状后用0.4%Ⅰ型胶原酶、37 ℃水浴摇床中消化3 h,用等体积的含FBS的L-DMEM培养液终止消化,过滤,离心后同上法按1×105/mL细胞密度接种培养细胞。
1.4 细胞形态观察及生长曲线绘制 原代培养24 h后倒置显微镜下首次观察细胞形态,以后每天观察,并拍照记录生长情况。取第3代细胞,消化、离心后,以2×104/mL的密度接种于24孔板,每孔1 mL。每天各取3孔消化倒置相差显微镜下计数,取平均值,连续培养8 d。以培养时间为横轴,细胞数为纵轴,分别绘制肉芽组织、1年及2年增生性瘢痕成纤维细胞生长曲线。
1.5 免疫细胞化学法检测Vimentin和CK19的表达 将第3代细胞用0.125%胰蛋白酶-0.02%EDTA消化,按2×104/cm2在无菌小培养皿中爬片,至细胞融合50%~80%时取出细胞爬片,以小鼠抗人Vimentin和CK19单克隆抗体作为一抗,二抗(IgG)为兔鼠通用型,采用ABC法进行免疫细胞化学检测,实验同时采用D-PBS代替一抗作为阴性对照分析。
1.6 成纤维细胞体外诱导分化 收集第3代细胞,参照诱导培养基说明书要求,制备细胞悬液并按规定浓度接种于6孔板,进行如下分化鉴定,加入常规培养基培养的细胞做阴性对照。
1.6.1 向成骨细胞诱导分化 细胞接种后常规培养基培养1 d,弃原培养基,每孔加入2 mL成骨诱导培养基,每隔3 d换液1次。诱导21 d后弃培养基,PBS清洗,4%中性甲醛固定,1%茜素红进行钙结节染色5 min,终止染色、镜检、拍照。
1.6.2 向成软骨细胞诱导分化 细胞消化后1 000 rpm离心5 min,细胞团块约2 mm,不可摇动或吹打细胞团,加入成软骨诱导培养液放入37℃、5%CO2的培养箱中孵育。3 d换液一次,每次1 mL,换液时轻弹离心管壁使细胞团块脱壁悬浮。诱导3周后弃培养基,PBS清洗,4%多聚甲醛固定,石蜡包埋切片,脱蜡,蒸馏水冲洗。阿利辛蓝染色液浸染30 min,终止染色、镜检、拍照。
1.6.3 向成脂肪细胞诱导分化 细胞接种后每隔3 d换液至细胞完全融合后弃原培养基,每孔加入2 mL成脂诱导分化完全培养基A,诱导3 d后更换为2 mL成脂诱导分化完全培养基B,24 h后再换回成脂诱导分化完全培养基A液。上述如此循环5次,再次用成脂诱导培养基B液诱导7 d,每隔3 d换液一次。弃原培养基,PBS清洗,4%多聚甲醛固定,油红O染色30 min,终止染色、镜检、拍照。
2 结果
2.1 成纤维细胞形态学观察 人创面肉芽组织来源的成纤维细胞接种8 h后开始贴壁,24 h完全贴壁后细胞逐渐伸展,细胞呈短梭形、多角形或不规则形。2~3 d后细胞数量迅速增加呈汇合状态。传代细胞开始贴壁时间约为2 h,细胞逐渐变为长梭形,胞质向外伸出伪足。细胞核呈卵圆形,居中,偶见双核。传代后细胞形态较为均一,排列规则,呈平行状、放射状、旋涡状生长(见图1A)。1年和2年人增生性瘢痕来源的成纤维细胞为贴壁生长的长梭型细胞,原代细胞呈多角形集落样生长,体积较小。2~3 d后细胞数迅速增加。细胞密度低时细胞之间排列疏松,有较大细胞间隙;细胞密度高时细胞相互平行排列,或呈放射状、编织状或漩涡状集落样生长。胞体狭长、透亮,胞浆丰富,胞核清晰;1年和2年增生性瘢痕成纤维细胞大小和形态无明显差异(见图1B、C)。

注:A:肉芽组织成纤维细胞 B:1年增生性瘢痕成纤维细胞 C:2年增生性瘢痕成纤维细胞。 图1 肉芽组织、1年及2年增生性瘢痕第3代成纤维细胞形态学观察(×100)
2.2 成纤维细胞增殖活力 细胞生长曲线显示,第1~2天细胞生长缓慢,第3~5天呈对数生长,增殖活跃,第6天到顶峰,第7~8天生长速度减慢进入平台期。
肉芽组织成纤维细胞增殖活力最强,1年增生性瘢痕成纤维细胞次之,2年增生性瘢痕成纤维细胞增殖活力较弱。

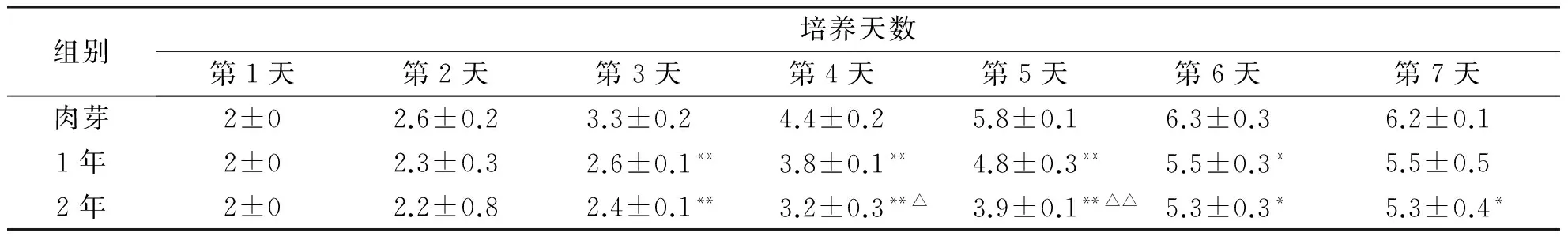
组别培养天数第1天第2天第3天第4天第5天第6天第7天肉芽2±02.6±0.23.3±0.24.4±0.25.8±0.16.3±0.36.2±0.11年2±02.3±0.32.6±0.1**3.8±0.1**4.8±0.3**5.5±0.3*5.5±0.52年2±02.2±0.82.4±0.1**3.2±0.3**△3.9±0.1**△△5.3±0.3*5.3±0.4*
注:与肉芽比较,*P<0.05,**P<0.01;与1年增生性瘢痕比较,△P<0.05,△△P<0.01。
2.3 免疫细胞化学检测波形蛋白和角蛋白19 免疫细胞化学染色结果显示:肉芽组织、1年和2年增生性瘢痕来源的成纤维细胞均为Vimentin阳性表达,不表达上皮细胞标志物CK19(见图 3)。
2.4 体外诱导分化检测
2.4.1 向成骨细胞诱导分化 成骨诱导约7 d细胞外基质见少量钙盐沉积,形成少量钙结节,随诱导时间延长,钙盐沉积增加,成骨诱导21 d细胞结节中心的细胞逐渐融合失去细胞结构,形成明显的骨化结节。进行茜素红染色呈阳性表达,镜下见大量大小不一的红色钙盐沉积,钙结节被染成暗红色(见图4)。

图2 肉芽组织、1年及2年增生性瘢痕成纤维细胞生长曲线

注:A: 成纤维细胞Vimentin阳性表达;B: 成纤维细胞CK19阴性表达。 图3 成纤维细胞免疫细胞化学Vimentin、CK19的表达情况(×200)

注:A:肉芽组织成纤维细胞细胞成骨诱导21 d茜素红染色阳性;B:1年增生性瘢痕成纤维细胞成骨诱导21 d茜素红染色阳性;C:2年增生性瘢痕成纤维细胞成骨诱导21 d茜素红染色阳性。 图4 肉芽组织、1年及2年增生性瘢痕成纤维细胞成骨诱导21 d茜素红S染色结果(×200)
2.4.2 向成脂肪细胞诱导分化 成脂肪诱导8 d后,形态逐渐由长梭形变为多角形和椭圆形,细胞体积逐渐增大,有小脂滴出现。随诱导时间的延长,小脂滴逐渐增多增大并逐渐聚集,27 d后多数细胞被诱导成为成熟的脂肪细胞,油红O染色呈阳性,细胞内出现橘红色颗粒,此颗粒为脂滴(见图5)。

注:A:肉芽组织成纤维细胞细胞成脂肪诱导27 d油红O染色阳性;B:1年增生性瘢痕成纤维细胞成脂肪诱导27 d油红O染色阳性;C:2年增生性瘢痕成纤维细胞成脂肪诱导27 d油红O染色阳性。 图5 肉芽组织、1年及2年增生性瘢痕成纤维细胞成脂肪诱导27 d油红O染色结果(×200)
2.4.3 向成软骨细胞诱导分化 软骨诱导剂诱导培养后,细胞形态逐渐由梭型转变为多角形、不规则形,诱导21 d后形成软骨细胞,阿利辛蓝染色呈阳性(见图6)。
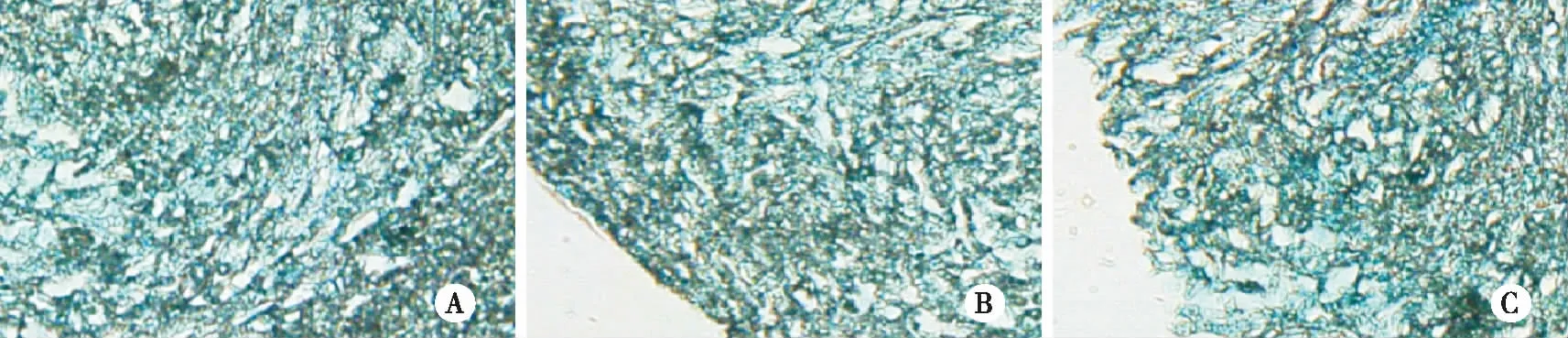
注:A:肉芽组织成纤维细胞细胞成软骨诱导21 d阿利辛蓝染色阳性;B:1年增生性瘢痕成纤维细胞成软骨诱导21 d阿利辛蓝染色阳性;C:2年增生性瘢痕成纤维细胞成软骨诱导21 d阿利辛蓝染色阳性。 图6 肉芽组织、1年及2年增生性瘢痕成纤维细胞成软骨诱导21天阿利辛蓝染色结果(×200)
3 讨论
增生性瘢痕一直是整形外科领域比较棘手的难题,至今为止,其形成机制仍不十分清楚,防治也一直是有待攻克的大难题。鉴于成纤维细胞的过度增殖在其发展过程中起着关键的作用,从组织工程角度入手解决这个世界难题,是科学家一直关注的焦点。构建组织工程首先需要大量高密度的种子细胞,应具备来源广泛、取材方便和对机体创伤小、体外增殖能力强及不易老化等特点。成纤维细胞是结缔组织中最常见的细胞,由胚胎时期的间充质细胞分化而来,在人体内分布范围最广,同时也是参与组织修复全过程最重要的一类细胞,体外增殖与合成能力旺盛,多次传代仍保持较强的增殖能力,取材与培养均十分简便,可视为人体内数量最大的“种子细胞库”[6]。近年来,成纤维细胞在创伤修复及组织再生方面研究较多且进展较快,深入探讨肉芽组织、1年和2年增生性瘢痕来源的成纤维细胞的多向分化潜能,可以深入了解创面愈合发生发展过程中成纤维细胞的生物学特性。由于增生性瘢痕本身被视为废弃组织,因其可在体外大规模扩增及生物学特性稳定等特性,那么增生性瘢痕来源的成纤维细胞是否可以变废为宝,是否有希望作为组织工程种子细胞呢?
本研究中分离、培养出的肉芽组织,1年和2年增生性瘢痕成纤维细胞均为贴壁生长的长梭行细胞。Vimentin是来源于间充质细胞的细胞骨架成分,被认为是最常见的间充质干细胞表型标志物[7],而细胞角蛋白CK19是上皮细胞的特征性标记物,本实验Vimentin阳性表达、CK19阴性表达,即排除了在原代培养时混杂入表皮干细胞干扰试验结果,结合细胞形态结构和生长情况证明分离培养的细胞是来源于间充质细胞且为高纯度的成纤维细胞。肉芽组织成纤维细胞、1年和2年增生性瘢痕成纤维细胞成骨诱导21 d茜素红染色阳性、成脂肪诱导27 d油红O染色阳性及成软骨诱导21 d后阿利新蓝染色阳性。说明肉芽组织、1年和2年增生性瘢痕来源的成纤维细胞在特定条件下均能向成骨、成软骨及成脂肪细胞多向分化,且该诱导培养体系稳定、可靠,为创面修复治疗及组织工程学提供理想种子细胞奠定了前期研究基础。
在本研究中,从肉芽组织到增生性瘢痕不同时期成纤维细胞,在特定条件下均能向成骨、成软骨及成脂肪细胞多向分化,增生性瘢痕来源成纤维细胞具有多向分化潜能的可行性得到进一步证实,加之来源方便,增殖能力强,有望为创面修复治疗及组织工程学提供理想种子细胞。
鉴于成纤维细胞参与组织修复全过程,在组织重构中发挥重要作用,成纤维细胞的多向分化潜能值得进一步研究。如果通过人为干预把增生性瘢痕成纤维细胞诱导成正常组织所需的细胞类型,改变增生性瘢痕成纤维细胞的生物学特性,构建复层皮肤逆转创面过度愈合形成增生性瘢痕这个不良结局,那么皮肤组织损伤则可以达到无瘢痕愈合,在整形外科领域为增生性瘢痕的治疗提供新的希望和前景。它能排出免疫排斥与过敏反应的顾虑,可望成为安全、微创、有效、自然、持久的医学美容方法。由于肉芽组织、1年和2年增生性瘢痕来源的成纤维细胞被诱导分化并进一步增殖所需条件和局部微环境的复杂性尚存在许多问题,如诱导后的细胞表型能否长时间维持以及不同培养条件等作用因素对诱导结果的影响等,故瘢痕来源的成纤维细胞在组织工程临床应用方面有待进一步研究。
[1] Usategui A,Del Rey M J,Pablos JL.Fbiroblast abnormalities in the pathogenesis of systemic sclerosis[J].Expert Rev Clin Immunol,2011,7(4):491-498.
[2]白晓智,胡大海,白丽,等.没药提取物对人成纤维细胞增殖与胶原mRNA表达影响的实验研究[J].中华烧伤杂志,2012,28(2):130-133.
[3]Lekic P C, Nayak B N, Al- Sanea R,et al.Cell transplantation in wounded mixed connectivet issues[J].Anat Rec A Discov Mol Cell Evol Biol,2005,287(2):1256.
[4]Haniffa M A,Collin M P,Buckley C D,et al.Mesenchymal stem cells: the fibroblasts' new clothes? [J].Haematologica,2009,94(2):258-263.
[5]Crider L,Kazhanie A,Yoon T J,et al.Isolation of a mesenchymal cell population from murine dermis that contains progenitors of multiple cell lineages[J].Faseb J,2007,2l(9):2050-2063.
[6]Han X,Han J,Ding F,et al.Generation of induced pluripotent stem cells from bovine embryonic fibroblast cells[J].Cell Res,2011,21(10):1509-1512.
[7]Johanna I,Hanna-Mari P, Jonna N,et a1.Novel function of vimentin in cell adhesion, migration and signaling[J].Experimental Cell Research, 2007, 313(10): 2050-2062.
[收稿2012-08-10;修回2013-01-26]
(编辑:谭秀荣)
Preliminarystudyoninvitrodifferentiationcapacitiesofhumanfibroblastsderivedfromgranulationtissueandhypertrophicscarsindifferentperiods
Longyan,Wangdali,Weizairong,Guochangmin
(Department of Burn and Plastic Surgery, The Affiliated Hospital of Zunyi Medical University,Guizhou Zunyi 563099,China)
ObjectiveTo investigate the differentiation capacities of human fibroblasts derived from granulation tissue and hypertrophic scars in different periods into osteocytes, adipocytes and chondrocytes and further provide new sources of donor cells for the wound repair treatment.MethodsFibroblasts derived from granulation tissue and 1-year and 2-year hypertrophic scars were isolated and cultured by mechanical method combined with enzymatic digestion method. The cells morphology were observed under phase-contrast microscope and the cell proliferative curve was drawn. The expressions of vimentin and CK19 in isolated cells were detected by immunocytochemistry assay. Multipotential differentiation capacities of isolated cells into osteocytes, adipocytes and chondrocyte were identified.ResultsPrimary cultured fibroblasts isolated from different derivation were presented with spindle, polygonal and irregular shape. The proliferative capacity of the fibroblasts derived from granulation tissue was more potent than that from 1-year and 2-year hypertrophic scars. Immunocytochemistry results showed that vimentin were positively expressed in fibroblasts from 3 derivation , whereas CK19 were negatively expressed. Fibroblasts from different derivation were induced to differentiate into osteocytes, adipocytes and chondrocyte.ConclusionThe fibroblasts from granulation tissue and hypertrophic scars in different periods possess multipotent differentiation capacities and thus could be used as an ideal donor cells for the wound repair treatment and tissue engineering study.
hypertrophic scars;granulation tissue;fibroblast;inducing differentiation
R619.6
A
1000-2715(2013)02-0108-05
国家自然科学基金项目(NO:81060157);贵州省优秀科技教育人才省长资金项目(NO:黔省专合字2010-70)。
王达利,男,医学硕士,教授,硕士生导师,研究方向:创伤修复,E-mail:daliwangzy@sina.com。

