HCMV基因在人和小鼠胚胎成纤维细胞中表达的差异性研究
杨 瑞,王 斌,钱冬萌,李 玲,周 雯,王桐梅,胡 明,陈 豪,宋旭霞
(青岛大学医学院病原生物学教研室,山东 青岛 266071)
巨细胞病毒(cytomegalovirus,CMV)属于β疱疹病毒亚科,为线性双链DNA病毒,其基因组长度超过230 kb[1],能够使人类致病的CMV为人巨细胞病毒(human cytomegalovirus,HCMV)。我国是世界上HCMV先天性感染发病较高的国家之一,在普通人群中的感染率为80%以上,某些特殊地区和人群中感染率可达100%。在孕妇和免疫能力低下者(如器官移植病人、艾滋病患者),该病毒可引发极为严重的并发症[2]。HCMV也能够通过母婴传播,是人类重要的致畸、致神经损伤病原体[3]。HCMV对宿主和组织培养均具有严格的种属特异性,且机制尚不清楚。一般仅感染其自身宿主或同属动物,也只有用其自身宿主的成纤维细胞才可进行体外培养,并产生高滴度的感染性子代病毒颗粒。虽然目前已有利用人源化小鼠成功建立HCMV感染与疾病的动物模型[4-5],但其昂贵的费用等却为科研带来太多困难。HCMV感染容许细胞可分为吸附与穿入、病毒基因的表达、病毒DNA的复制以及病毒的组装与释放。HCMV感染宿主细胞后,其基因表达和调控呈现严格的时序性,依次表达即刻早期基因(immediate-early,IE)、早期基因 e(early,E)和晚期(late,L)基因。Sandford等[6]发现即使把 HCMV IE基因的增强子换成MCMV的增强子也并不能改变其宿主趋向性,由此证明HCMV的宿主特异性并不取决于即刻早期阶段。本研究用人和小鼠新鲜胚胎组织分离培养原代成纤维细胞,观察2种细胞体外感染HCMV AD169后的形态学改变,检测各期病毒基因和蛋白表达情况等,为进一步研究和探讨HCMV可能的种属特异性机制奠定基础。
1 材料与方法
1.1 材料主要试剂与仪器
胎龄为8~10周的自愿米菲司酮流产的新鲜胎儿,经其父母知情同意,由青岛市海慈医院提供;6~8周昆明小鼠购自青岛市药品检验所;DMEM/F12培养基、胎牛血清为Hyclone公司产品;RNAiso Plus购自TaKaRa公司;AMV Reverse Transcription System Kit、PCR Mix 购自 Fermentas公司;Triton X-100购自Sigma公司;RIPA细胞裂解液、PMSF购自Solarbio公司;ECL发光显色试剂盒购自Boster公司;5×蛋白上样缓冲液;彩色预染蛋白分子量标准(10~170 ku)购自碧云天生物技术研究所(Catalog No.P0068);封闭用正常山羊血清,鼠抗 IE1、IE2、UL84、UL83,Cy3 标记的羊抗鼠IgG购自北京博奥森生物公司;倒置荧光显微镜为日本Olympus公司产品;白光凝胶成像系统为法国Vilber Lourmat产品。
1.2 方法
1.2.1 原代细胞分离与培养 人胚胎用75%乙醇消毒10 min后,无菌器械解剖取肺,将其剪成直径小于0.5 mm的碎块,行组织块培养法培养。将6~8周龄昆明小鼠雌雄比例为2∶1合笼,次日早晨检查雌鼠,出现阴栓者记为0.5 d。选择孕期12.5~14.5 d的雌鼠脱臼处死,75%酒精消毒后,用无菌器械取出小鼠胚胎,用PBS清洗3~5遍,去除头部、四肢和内脏,剩余躯干部分剪成小于0.5 mm的碎块,行组织块培养法培养。原代人胚胎成纤维细胞(HEF)和小鼠胚胎成纤维细胞(MEF)在含有10%胎牛血清的DMEM/F12完全培养基中呈贴壁生长,置于37℃、5%CO2的培养箱培养,待其长满瓶底90%以上常规消化、传代,取3代以内生长良好、对数生长期的细胞进行后续实验。
1.2.2 HCMV病毒增殖和滴度测定 取出冻存的HCMV AD169毒株(法国巴斯德研究所惠赠),在流动的自来水中迅速融化,将对数生长期的HEF更换无血清培养基,加入100 μL病毒悬液,于37℃、5%的恒温箱中培养2 h,期间每隔15 min轻轻晃动培养瓶1次。弃掉培养液后,加入含有2%FBS的DMEM/F12培养基维持培养,随时观察并记录细胞的变化,待细胞病变至80%以上时用细胞刮刀刮取细胞并收集培养液上清,-86℃反复冻融3次,使病毒颗粒释放,1500 r/min离心10 min,收集上清液作为病毒储存液,分装至EP管并保存于-86℃冰箱。通过空斑定量法,确定本实验所用病毒滴度为2×106PFU/mL。
1.2.3 HCMV特征性病变效应(CPE)的观察将3代以内且对数生长期的HEF和MEF接种于25 m2培养瓶中(1×106个/mL),常规培养24 h,换用无血清的DMEM/F12培养基,加入制备好的HCMV AD169毒株100 μL(MOI=5)继续培养2 h后,弃去培养液,分别加入2%FBS的 DMEM/F12培养基维持培养,同时设立阴性对照(未感染病毒的正常细胞),在相差显微镜下逐日观察细胞形态学变化。另外,将HCMV感染MEF 3 d后的培养物上清反复冻融3次,离心后收取培养物上清,分别将 1 μL、10 μL、100 μL、1 mL、10 mL 的上清液加入生长状态良好的HEF,换用无血清的DMEM/F12培养基继续培养2 h后弃去培养液,分别加入2%FBS的 DMEM/F12培养基维持培养,同时设立阴性对照(未感染病毒的正常细胞),相差显微镜下逐日观察细胞形态学变化。
1.2.4 RT-PCR 检测 HCMV 感染2 种细胞6、24、48 h时IE1、IE2、UL84、UL83 mRNA的表达 取对数生长期的HEF和MEF接种细胞培养皿(密度约105/mL),培养过夜后加入 HCMV AD169(MOI=5),分别在病毒感染后6、24、48 h收集细胞。按照RNAiso Plus说明书提取细胞总RNA,紫外分光光度计测定其纯度和浓度,并在DNase处理后进行反转录,PCR扩增IE1、IE2、UL84、UL83基因,各基因的PCR引物序列见表1。PCR扩增条件:94 ℃ 5 min,94 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s共30个循环,72℃延伸10 min。1.0%琼脂糖凝胶电泳检测PCR产物后UVP凝胶成像系统拍照。Quantity One软件进行灰度分析,将目的基因条带与内参人β-actin和鼠GADPH基因条带的灰度值的比值来作为目标基因的相对表达量,实验重复3次。
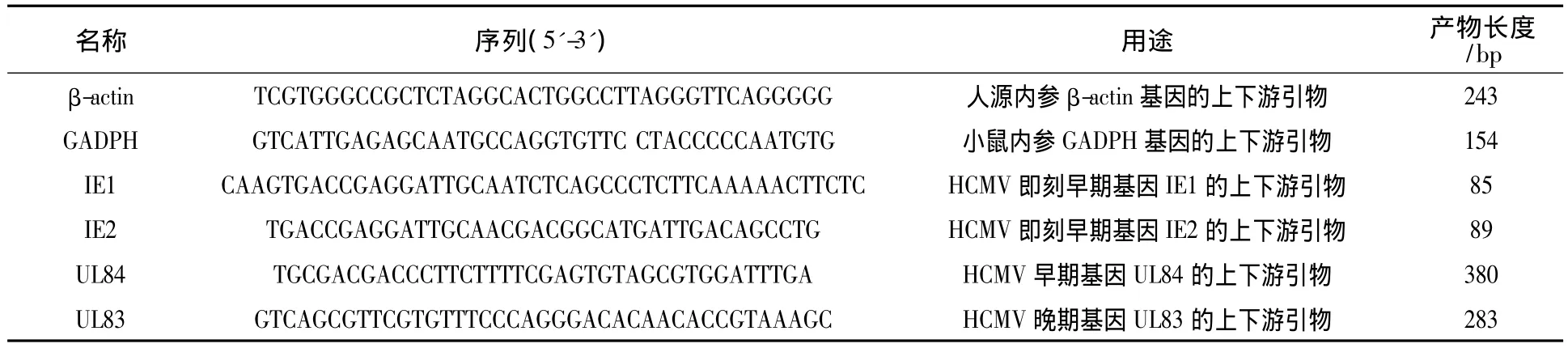
表1 RT-PCR引物序列表Table 1 Sequence of primers used for RT-PCR
1.2.5 Western-blot检测HCMV AD169 感染2 种细胞24、48、72 h 时 IE1、IE2、UL84、PP65 蛋白的表达 取对数生长期的HEF和MEF接种细胞培养皿(密度约105/mL),用RIPA细胞裂解液400 μL、PMSF 4 μL提取未经病毒感染的细胞和HCMV AD169感染24、48、72 h的总蛋白,以BCA 蛋白浓度测定试剂盒进行蛋白定量,取等量样品进行SDS-PAGE电泳,电泳至分离胶底部后,电转至PVDF膜上,5%脱脂奶粉室温摇床封闭2 h,TBST洗膜 3次,每次 10 min;鼠抗 IE1、IE2、UL84、PP65(UL83编码产物)蛋白单克隆抗体 (1∶1000)4℃孵育过夜,TBST洗膜3次后加入HRP标记的羊抗鼠和羊抗兔IgG,室温孵育2 h,TBST洗膜3次,Vilber Lourmat凝胶成像系统显色。分析计算目的蛋白与内参Actin蛋白灰度之比,以此表示目的蛋白的相对表达量。实验重复3次。
1.2.6 统计学方法 采用SPSS13.0统计软件。所得数据以表示。对数据进行单因素方差分析。P≤0.05为差异有统计学意义。
1.2.7 细胞爬片与免疫荧光 取对数生长期的HEF和MEF接种到含已包被玻片的24孔板内(密度约105/mL),培养24 h后换成2%DMEM/F12培养液,4 h后加入HCMV,培养72 h后多聚甲醛固定细胞,0.1%Triton X-100室温透化30 min,10%山羊血清室温封闭30 min,过夜孵育小鼠抗 HCMV IE、PP65、β-actin蛋白单克隆抗体,PBS充分洗涤后,与FITC标记的山羊抗小鼠IgG和Cy3标记的山羊抗兔IgG 37℃孵育2 h,hoechst室温染核10 min,75%甘油封片后在激光共聚焦显微镜下观察、拍照。
2 结果与分析
2.1 HCMV AD169感染HEF和MEF形态学观察
原代培养24 h即可见HEF和MEF呈放射状从组织块中迁移出来,贴壁生长。72 h即可弃去组织块并进行传代培养。初次培养的细胞会夹杂一些非成纤维细胞,可利用差速贴壁法纯化得到高纯度的细胞系。细胞形态为典型纤维形或梭形,细胞轮廓清晰,折光度良好。
取3代以内生长良好、对数生长期的HEF和MEF用于感染HCMV AD169(MOI=5),此过程用含2%FBS的DMEM/F12培养基维持培养。3 d后HEF细胞出现HCMV特征性巢状病变效应(CPE),巢内细胞变大变圆,而周围细胞仍为成纤维形;6 d左右,超过80%的HEF细胞出现典型的CPE,细胞变圆,部分细胞融合为多核巨细胞,呈典型的巨细胞病毒感染后的细胞形态学改变。而MEF感染组则未发生明显的CPE,而是出现大规模的细胞死亡现象,细胞状态愈来愈差,有老化现象(见图1)。
另外,将HCMV AD169感染MEF 3 d后的培养物上清反复冻融3次,离心后取上清,设置浓度梯度再分别感染HEF,相差显微镜下逐日观察均未出现明显的HCMV特征性CPE。
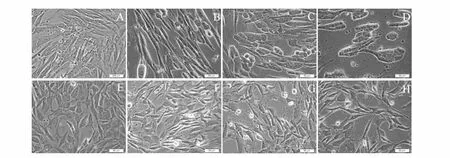
图1 HCMV AD169感染后HEF和MEF的形态学变化(MOI=5)(400×)Fig.1 The morphological changes of HEF and MEF which were infected with HCMVAD169(MOI=5)by phase contrast microscope(400 ×)
2.2 RT-PCR检测HCMV AD169感染HEF和MEF 后 IE1、IE2、UL84、UL83基因的表达
HCMV AD169(MOI=5)感染 HEF 6、24、48 h,IE1、IE2、UL84、UL83 mRNA 表达明显高于未感染组(P ﹤0.01);而MEF 在6、24、48 h 仅IE1、IE2表达显著高于未感染组(如图2),且IE2在HEF组中的相对表达量显著高于MEF组(P﹤0.05)。延长感染时间再行检测,也未见任何变化。HEF和 MEF组中 IE1、IE2、UL84、UL83 mRNA相对表达量见表2。
2.3 Western-blot检测 HCMV AD169 感染HEF和MEF后IE、E、L蛋白的表达
HEF感染HCMVAD169后24 h检测到IE1蛋白表达,48 h表达 IE2、UL84蛋白,72 h表达PP65(UL83编码产物)蛋白(如图3),其相对表达量均显著高于未感染组(P﹤0.01)。而MEF感染HCMV AD169后仅在24 h显著表达IE1和IE2蛋白(P﹤0.01),不表达 UL84和 PP65蛋白。且IE1、IE2在HEF组中的相对表达量显著高于 MEF组(P﹤ 0.05)。HEF和 MEF组中IE1、IE2、UL84和PP65蛋白相对表达量见表3。
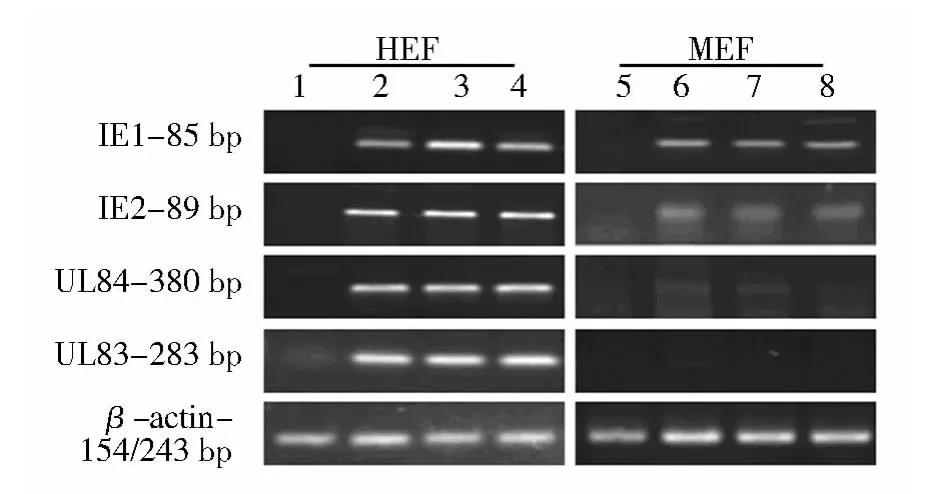
图2 PT-PCR检测HEF和MEF组IE1、IE2、UL84、UL83 mRNA 的表达Fig.2 Expressions of IE1、IE2、UL84、UL83 mRNA in HEF and MEF cells infected with HCMV by RT-PCR
表2 HEF和MEF组中IE1、IE2、UL84和UL83 mRNA相对表达量比较()Table 2 The relative value of IE1,IE2,UL84 and UL83 mRNA in HEF and MEF groups
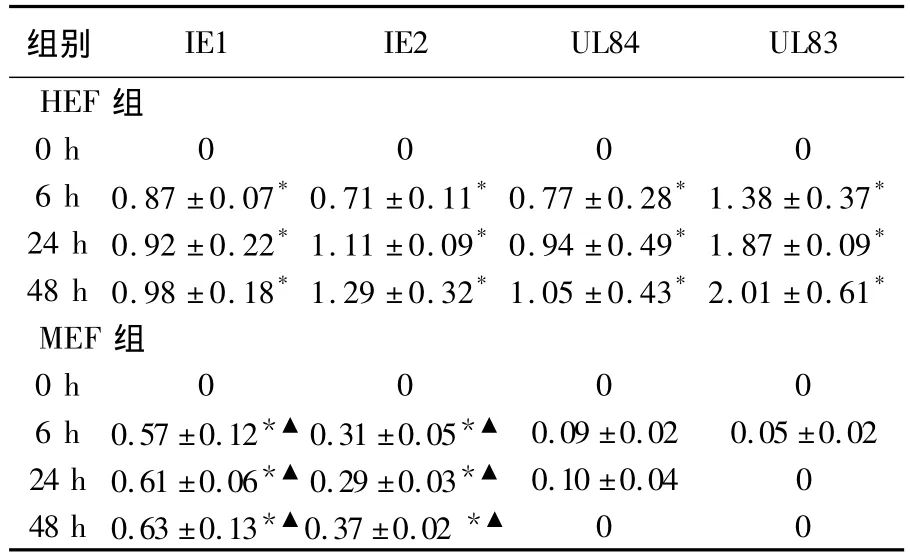
表2 HEF和MEF组中IE1、IE2、UL84和UL83 mRNA相对表达量比较()Table 2 The relative value of IE1,IE2,UL84 and UL83 mRNA in HEF and MEF groups
注:与HEF和MEF组的0 h比较*P﹤0.01,与HEF组相应时间点比较▲P﹤0.05,下表同。
组别IE1 IE2 UL84 UL83 HEF 组0 h 0 0 0 06 h 0.87 ±0.07*0.71 ±0.11*0.77 ±0.28*1.38 ±0.37*24 h 0.92 ±0.22*1.11 ±0.09*0.94 ±0.49*1.87 ±0.09*48 h 0.98 ±0.18*1.29 ±0.32*1.05 ±0.43*2.01 ±0.61*MEF组0 h 0 0 0 06 h 0.57 ±0.12*▲ 0.31 ±0.05*▲ 0.09 ±0.02 0.05 ±0.0224 h 0.61 ±0.06*▲ 0.29 ±0.03*▲ 0.10 ±0.04 048 h 0.63 ±0.13*▲0.37 ±0.02 *▲00

图3 Western-blot检测HEF和MEF 组 IE1、IE2、UL84和PP65蛋白的表达Fig.3 Expressions of IE1、IE2、UL84 and PP65 in HEF and MEF by Western-blot
表3 HEF和MEF组中IE1、IE2、UL84和PP65蛋白相对表达量比较()Table 3 The relative value of IE1、IE2、UL84 Group and PP65 in HEF and MEF groups
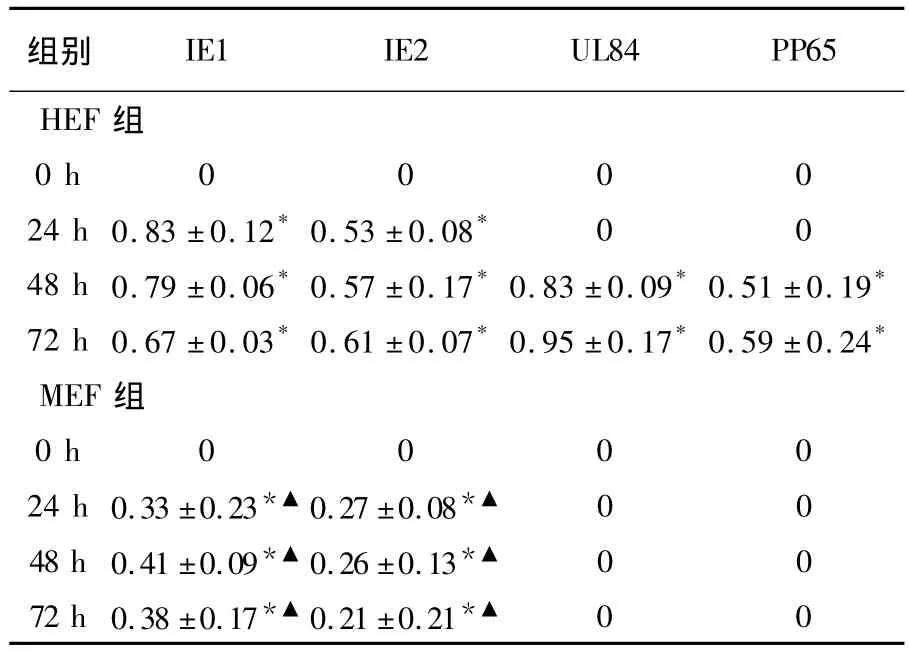
表3 HEF和MEF组中IE1、IE2、UL84和PP65蛋白相对表达量比较()Table 3 The relative value of IE1、IE2、UL84 Group and PP65 in HEF and MEF groups
组别IE1 IE2 UL84 PP65 HEF 组0 h 0 0 0 024 h 0.83 ±0.12*0.53 ±0.08* 0 048 h 0.79 ±0.06*0.57 ±0.17*0.83 ±0.09*0.51 ±0.19*72 h 0.67 ±0.03*0.61 ±0.07*0.95 ±0.17*0.59 ±0.24*MEF组0 h 0 0 0 024 h 0.33 ±0.23*▲ 0.27 ±0.08*▲ 0 048 h 0.41 ±0.09*▲ 0.26 ±0.13*▲ 0 072 h 0.38 ±0.17*▲ 0.21 ±0.21*▲00

图4 免疫荧光检测HEF和MEF感染HCMV AD16972 h后IE和PP65蛋白的表达Fig.4 Expressions of IE and PP65 protein in HEF and MEF by immunofluorescence assay
2.3 免疫荧光检测HCMV AD169感染HEF和MEF后IE和PP65蛋白的表达
HCMV AD169(MOI=5)感染HEF 72 h明显表达IE和PP65蛋白,而MEF内未见明显的IE和PP65蛋白(见图4)。
3 讨论
HCMV具有严格的种属特异性和细胞嗜性,在人以外的动物组织和细胞上难以建立复制并产生完整的子代病毒颗粒,长期以来国内外对CMV致病性的研究主要是以MCMV感染鼠为模型进行研究。但是近年来,国内学者相继有文章报道成功建立HCMV感染野生型小鼠的动物模型。本实验室选取长期连续传代扩增的HCMV AD169毒株和从昆明小鼠胚胎成功分离培养的成纤维细胞,将相同毒株以相同的MOI值(MOI=5)感染HEF(阳性对照组)和MEF(实验组),光学相差显微镜观察细胞感染后的形态学变化,发现并未出现明显的HCMV特征性CPE。另外,将HCMV感染MEF 72 h后的培养物上清反复冻融3次,离心后的上清设置浓度梯度分别感染HEF,亦未出现明显的CPE,不符合柯赫法则对于微生物感染的要求。本实验为尽可能模拟真实的HCMV感染允纳细胞和非允纳细胞的体内环境,用新鲜的人和小鼠胚胎组织中分离培养出原代HEF和MEF,以HCMV AD169株感染HEF为阳性对照,RT-PCR结果显示在感染病毒的MEF细胞内,仅HCMV IE1和IE2即刻早期基因表达量显著高于未感染HCMV组(P﹤0.01);Westernblot结果显示只有IE1和IE2蛋白表达量显著高于未感染组(P﹤0.01);免疫荧光检测未发现明显的IE和PP65蛋白的表达。以上结果均表明,本实验室储存HCMV AD169株不能体外跨种属感染原代培养的小鼠胚胎成纤维细胞,未能成功建立HCMV AD169株体外感染小鼠成纤维细胞的动物模型,且HCMV基因产物在原代MEF细胞中的表达阻止在IE蛋白表达与l基因表达之间。
作为人类疱疹病毒组中最大的病毒,HCMV感染宿主细胞后,其基因表达和调控呈现严格的时序性,依次表达即刻早期基因IE1和IE2,早期基因E和晚期基因L。其中IE基因主要编码一些免疫调节因子,其表达是由宿主细胞因子所激活,并不依赖任何新的蛋白的合成[7]。IE蛋白为E基因的表达提供必要的条件[8]。虽然IE基因在宿主细胞中的存在有重要意义,但它的表达并不等同于完整病毒颗粒的复制。Ellsmore等[9]证实HCMV能够有效吸附并穿入多种细胞包括一些非容许细胞系如人胚肾293细胞和Vero细胞,并在HCMV穿入细胞后检测到了IE1的表达。Lafemina等[10]证实 BALB/c-3T3 细胞可以表达HCMV或SCMV的IE1和IE2,但都不能产生完整病毒颗粒。UL84是一种HCMV早期蛋白,也是重要的功能蛋白,主要合成HCMV DNA复制因子,为HCMV DNA复制所必须。UL84是目前为止发现的唯一与IE2蛋白相互作用的病毒蛋白,Sanders RL等[11]研究发现IE2蛋白的相对表达量的降低能够导致 UL84蛋白丢失。PP65为UL83基因所编码的 HCMV晚期蛋白之一,是HCMV的标志性结构蛋白。已有研究证实,在潜伏感染状态下,IE基因持续、低水平的升高不能有效激活E、L基因,但在IE基因拷贝数明显增多的细胞内却相继发现高效表达的P52蛋白和MCP mRNA[12]。本研究结果显示,虽然 HCMV 即刻早期基因和其蛋白产物可以在MEF内持续表达,但表达水平显著低于 HEF感染组(P﹤0.05),相反在IE基因明显高表达的允许细胞HEF内也相继高表达UL84和UL83基因和相应的蛋白。此结果提示在HCMV跨种属感染过程中,可能有一种机制从一开始就在某种程度上阻止了病毒基因的表达和蛋白的翻译,导致即刻早期基因和蛋白的表达减少。而少量的即刻早期蛋白又不足以启动早期和晚期基因的表达程序,故导致早期蛋白不能表达,进而病毒DNA复制阶段受阻,最终无法合成完整的子代病毒颗粒。因此认为感染细胞MEF内低水平的IE相对表达量可能是无法启动基因组表达的主要原因,也是HCMV种属特异性分子机制形成的原因之一。
综上所述,不完整的HCMV基因时序表达是HCMV种属特异性形成的基础,IE基因的低水平表达导致下游基因的表达无法正常启动可能是其中的关键因素。因此,寻找抑制IE基因表达的主要原因,是克服HCMV种属特异性,建立HCMV感染的动物模型的捷径之一。
[1]Montague M G,Hutchison C R.Gene content phylogeny of herpesviruses[J].Proc Natl Acad Sci U S A,2000,97(10):5334-5339.
[2]Pass R F,Burke R L.Development of cytomegalovirus vaccines:prospects for prevention of congenital CMV infection[J].Semin Pediatr Infect Dis,2002,13(3):196-204.
[3]Schleiss M R.Congenital cytomegalovirus infection:update on management strategies[J].Curr Treat Options Neurol,2008,10(3):186-192.
[4]Maidji E,Kosikova G,Joshi P,et al.Impaired surfactant production by alveolar epithelial cells in a SCID-hu lung mouse model of congenital human cytomegalovirus infection[J].J Virol,2012,86(23):12795-12805.
[5]Smith M S,Goldman D C,Bailey A S,et al.Granulocyte-colony stimulating factor reactivates human cytomegalovirus in a latently infected humanized mouse model[J].Cell Host Microbe,2010,8(3):284-291.
[6]Sandford G R,Brock L E,Voigt S,et al.Rat cytomegalovirus major immediate-early enhancer switching results in altered growth characteristics[J].J Virol,2001,75(11):5076-5083.
[7]Ahn K,Angulo A,Ghazal P,et al.Human cytomegalovirus inhibits antigen presentation by a sequential multistep process[J].Proceedings of the National Academy of Sciences,1996,93(20):10990-10995.
[8]DeMarchi J M,Schmidt C A,Kaplan A S.Patterns of transcription of human cytomegalovirus in permissively infected cells[J].J Virol,1980,35(2):277-286.
[9]Ellsmore V,Reid G G,Stow N D.Detection of human cytomegalovirus DNA replication in non-permissive Vero and 293 cells[J].J Gen Virol,2003,84(Pt 3):639-645.
[10]Lafemina R L,Hayward G S.Differences in cell-type-specific blocks to immediate early gene expression and DNA replication of human,simian and murine cytomegalovirus[J].J Gen Virol,1988,69(Pt 2):355-374.
[11]Sanders R L,Spector D H.Human cytomegalovirus IE286 and IE240 proteins differentially regulate UL84 protein expression posttranscriptionally in the absence of other viral gene products[J].J Virol,2010,84(10):5158-5170.
[12]赵杨,陈敦金,闻良珍.人巨细胞病毒基因时序表达对感染结局的影响[J].中华微生物学和免疫学杂志,2004,24(10):834-838.