银条多糖SFPSA的单糖组成及抗肿瘤活性研究
马丽苹,尤晓颜,原江锋,汪伦记,曾晓雄
1河南科技大学食品与生物工程学院,洛阳 471023;2南京农业大学食品科学与技术学院,南京 210095
恶性肿瘤,即通常所说的癌症,其发病率及死亡率近年来一直呈上升趋势,按目前趋势预测,至2020年随着世界人口达80亿,将有2000万新发癌症病例,其中死亡人数将达1200万。目前临床治疗癌症的主要方法是手术、化疗、放疗,其共同的特点是在缓解症状的同时会给正常机体产生严重的损伤。尤其是临床上广泛使用的传统化疗药物普遍存在选择性差、毒副作用大、易产生耐药性等问题,大大限制了其在临床上的应用[1]。因此,从天然产物中寻找和筛选专一性高、毒副作用小的抗癌药物或抗癌辅助药物已经成为目前肿瘤治疗的重要研究方向。近年来,大量药理研究结果表明,植物多糖不仅具有较强的抗肿瘤活性,而且具有毒副作用小和不易造成残留等优点[2],因此在医疗、保健、食品和动物养殖等领域有着广阔的应用前景。
银条(Stachys floridana Schuttl.ex Benth),又名银条菜、银白条、银苗、银根菜和地灵等,属唇形科水苏属多年生草本植物,是以地下茎作为食用器官的偃师地方独特蔬菜品种。地下茎白色,肉质脆嫩,稍有纤维,味甘,营养丰富,可炒食、盐渍、酱渍或制成泡菜、蜜饯等,不仅是宴席的珍品,也可作为家常小菜,有消腻去腥的作用,风味良好,尤为酱菜中珍品[3]。据偃师县志记载,自唐代以来,银条就已作为历代宫廷贡品。现代研究表明,银条富含碳水化合物、多酚、VC、蛋白质和有机酸,具有降血脂、软化血管和改善血液循环的作用[4]。而且,以银条为原料提取的水苏糖,有重要的医用和药用价值,也开辟了银条综合利用的新途径[5]。目前对银条粗多糖的提取工艺和护肝活性已有研究[6],而关于银条多糖的抗癌活性鲜有报道,因此本研究以银条多糖纯化片段SFPSA作为研究对象,分析其单糖组成,进而采用MTT法体外考察了SFPSA对三种癌细胞系(BGC-823、HGC-27和HT-29)增殖的抑制作用,以期为银条多糖抗癌活性提供理论依据。
1 材料与方法
1.1 实验材料
银条粗多糖按照Ma等[6](2012)报道的方法通过热水浸提、超滤浓缩而后醇沉冻干后制得。银条粗多糖通过DEAE-52阴离子交换柱层析获得一个主要洗脱成分(由0.3M NaCl洗脱得到),浓缩冻干后,又将其上样于Sephadex G-100凝胶柱进一步分离纯化而得到纯化组分SFPSA。BGC-823人胃腺癌细胞株,由江苏省药物研究所馈赠;HT-29人结肠癌细胞株,HGC-27人胃癌细胞株购于上海中科院细胞库。
DEAE-纤维素-52凝胶、葡聚糖G-100凝胶、噻唑蓝(MTT)、青霉素-链霉素贮存溶液、各单糖(鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖)标准品和葡聚糖标准品购于 Sigma公司。DMEM培养基、新生胎牛血清、丙酮酸钠溶液、HEPES试剂、台盼蓝染色剂购于Gibco公司;其它试剂均为国产分析纯。
1.2 主要仪器设备及试剂
电子天平(AY-120型、BL-220H型,日本SHIMADZU公司);电脑全自动部份收集器(DBS-100A型,上海沪西分析仪器厂);旋转蒸发器(Laborota-400型,德国Heidolph公司);冷冻干燥机(Alpha 1-2型,英国 LABCONCO公司);气相色谱仪(Agilent 6890N型,美国Agilent公司);高效液相色谱仪(Agilent 1100 Series型,美国Agilent公司);立式压力蒸汽灭菌锅(LDZX-50KBS型,上海申安医疗器械厂);冷冻离心机(Megafuge 1.0R型,美国Thermo Scientific公司);超净工作台(SW-CJ-2F型,苏州安泰空气技术有限公司);细胞培养箱(Series II 3110型,美国Thermo Scientific公司);酶标仪(Synergy-2型,美国Biotek公司);涡旋振荡器(XW-80A,江苏海门其林贝尔有限公司);细胞培养瓶、细胞培养板(Nunc,美国Thermo Scientific公司)。
1.3 实验方法
1.3.1 SFPSA的纯度鉴定及相对分子质量测定
采用高效液相凝胶渗透色谱法(High performance gel permeation chromatography,HPGPC)进行多糖样品的纯度鉴定和相对分子质量测定,具体方法参照《糖复合物生化研究技术》(张惟杰,1999)[7]一书中所述。
1.3.2 SFPSA的单糖组成分析
采用糖腈乙酸酯衍生物法测定SFPSA的单糖组成。具体步骤如下:
1.3.2.1 多糖样品酸水解
称取多糖样品5 mg置安瓿瓶中,加入2 mol/L三氟乙酸(TFA)4 mL后封管,120℃水解2 h,水解液50℃条件下旋转蒸发至干,加入甲醇约2 mL,再蒸发至干,如此重复3次,最后蒸干待作衍生化使用。
1.3.2.2 糖腈乙酸酯衍生物的制备
水解后的糖样和各标准单糖(鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖)中分别加入10 mg盐酸羟胺、5 mg肌醇(内标物)和0.6 mL吡啶,封口,放入90℃水浴中加热反应30 min并振荡。取出后冷至室温,再加入1.0 mL醋酸酐,90℃水浴中继续反应30 min,冷却后得糖腈乙酸酯衍生物。以肌醇为内标,反应产物直接用于气相色谱分析。
1.3.2.3 衍生物的气相色谱检测
使用Agilent 6890N气相色谱仪,氢离子火焰检测器(FID),Agilent HP-5型5%苯甲基硅氧烷毛细管色谱柱(30.0 m ×320 μm ×0.25 μm)。具体操作条件如下:N2为载气,流速1 mL/min;色谱柱程序升温,120℃保持3 min,以3℃/min速度升温至210℃,210℃再保持4 min;进样口温度250℃;检测器温度280℃;进样体积1.0~3.0 μL;氮气、氢气和空气的流速分别是25、30、300 mL/min。
1.3.2.4 样品中单糖的定性和定量
根据各种单糖标准品在色谱图中的出峰时间可以对样品中的单糖进行定性分析。根据标准品、内标物和样品中各单糖的峰面积可以对各单糖进行定量,计算公式如下:
各单糖校正因子 K=(W标准/W内标)/(A标准/A内标)
样品中各单糖的质量 W样品=K(A样品/A内标)× W内标
其中W标准为上述所称取的单糖标准品的质量(mg);W内标为衍生化反应时加入的内标肌醇的质量(mg);W样品为样品中所含单糖的质量(mg);A标准为色谱图中某单糖标准品的峰面积;A内标为色谱图中内标肌醇的峰面积;A样品为样品色谱图中某单糖的峰面积。
1.3.3 SFPSA对肿瘤细胞增殖的抑制作用
1.3.3.1 肿瘤细胞的培养
肿瘤细胞参照Jiang等[8](2011)报道的方法进行培养。
1.3.3.2 MTT法体外检测SFPSA对肿瘤细胞增殖的抑制作用
取对数生长期的肿瘤细胞制备单细胞悬液,调整细胞数为1×105个/mL,按每孔100 μL的量接种于96孔细胞培养板,注意96孔板四周边孔不接种细胞,均加入等体积的PBS液体。接种好的96孔细胞培养板在37℃、饱和湿度、5%CO2培养箱中培养12~24 h。
取出96孔细胞培养板,用排枪小心吸出培养液,向样品组孔中加入多糖溶液(用新鲜DMEM完全培养基溶解)100 μL,使得每孔中的多糖终浓度分别为 125、250、500、1000、2000 μg/mL,每个浓度梯度设6个复孔。对照组每孔加入100 μL新鲜DMEM完全培养基。
加样处理后的细胞于37℃、饱和湿度、5%CO2培养箱中继续培养24、48和72 h,根据观测药物作用效果的需要,选择在相应的培养时间点,于样品孔和对照孔中加10 μL MTT贮存溶液,继续培养4 h后小心吸去上清培养液,加入100 μL的DMSO溶解蓝紫色结晶。轻轻振摇均匀后,在550 nm波长条件下,用酶标仪测定各孔的吸光度(Abs),根据以下公式计算药物对肿瘤细胞的抑制率:
抑制率(%)=(1-Abs样品/Abs对照)×100%
2 结果与分析
2.1 SFPSA的纯度及相对分子质量
本研究采用高效液相凝胶渗透色谱法鉴定了SFPSA的纯度。结果见图1。从图1中可以看出,SFPSA的液相色谱图上表现为单一的色谱峰,且峰形尖锐,对称性好。这表明,银条粗多糖经两步柱层析分离纯化后得到了一个分子量相对均一的多糖组分。
HPGFC法分离原理同样也是据组分的相对分子量进行分离,多糖在排阻色谱柱上的洗脱体积或保留时间与其分子量密切相关,在一定分子量范围内,洗脱体积或保留时间与分子量的对数呈线性关系。因此,本研究以不同分子量的普鲁兰多糖为标准品,通过高效液相凝胶渗透色谱法绘制了相对分子量的标准曲线,并对其进行线性回归方程,回归方程为:LogMw=-0.2217 RT+7.0983,相关系数R2=0.9945。其中Mw为标样的已知平均相对分子量,RT为标样的保留时间。银条多糖纯化组分SFPSA的高效液相凝胶渗透色谱图如图1所示。由图1可知,它在高效液相色谱图上的保留时间为:8.203 min。将保留时间值代入标准曲线,计算得到它们的相对平均分子质量是168.30 kDa。
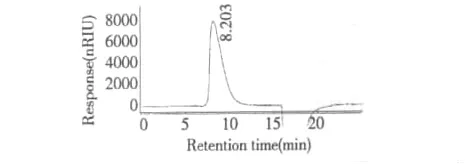
图1 银条多糖纯化组分SFPSA相对分子质量的高效液相色谱图Fig.1 HPLC chromatogram of relative molecular weight of SFPSA
2.2 SFPSA的单糖组成

图2 单糖标准品的气相色谱图Fig.2 GC spectrum of monosaccharide standards

图3 SFPSA单糖组成的气相色谱图Fig.3 GC spectrum of monosaccharide composition of SFPSA
本文采用糖腈乙酸酯衍生物的气相色谱法对银条酸性多糖SFPSA的单糖组成进行了测定。标准单糖糖腈乙酸脂衍生物气相色谱图如图2所示。在图2中,它们在气相色谱图上的保留时间依次为L-鼠李糖(RT,20.666)、L-阿拉伯糖(RT,21.325)、L-岩藻糖(RT,21.614)、D-木糖(RT,21.907)、D-甘露糖(RT,28.706)、D-葡萄糖(RT,29.078)、D-半乳糖(RT,29.818)、肌醇(RT,33.194)。
SFPSA完全酸水解的GC图如图3所示。比对标准单糖在气相色谱图(图2)上的出峰时间,即可获得各样品中单糖种类的信息;根据色谱图上的峰面积,再依据内标法结合矫正系数K即可计算出纯化组分的单糖组成的摩尔比。SFPSA主要含有由鼠李糖、阿拉伯糖、葡萄糖和半乳糖等单糖组分,其摩尔百分比为:8.19∶37.74∶3.46∶50.61。
2.3 银条多糖SFPSA体外对三种肿瘤细胞增殖的抑制作用
将不同浓度的银条多糖SFPSA加入到BGC-823、HGC-27和HT-29三种癌细胞中,分别作用24、48、72 h,以研究其对这三种癌细胞增殖活性的影响,结果见图4、图5和图6。由图4可知,当SFPSA的终浓度为125 μg/mL,给药时间为24 h时,SFPSA对BGC-823细胞增殖的抑制作用较弱,抑制率仅为3.89%,而当药物作用72 h时,SFPSA对BGC-823细胞增殖的抑制作用增加,抑制率为30.33%。药物处理72 h时,当药物浓度由125 μg/mL增加到2000 μg/mL,其对BGC-823细胞增殖的抑制率也由30.33%增加到38.37%。以上结果说明银条多糖SFPSA对人胃腺癌BGC-823细胞的增殖具有一定的抑制作用,而且这种作用随着时间的延长和浓度的增加而增加,即呈现一定的时间和浓度的依赖关系。

图4 银条多糖SFPSA对人胃腺癌细胞BGC-823增殖的抑制作用Fig.4 Inhibitory effect of SFPSA on the proliferation of human gastric cancer BGC-823 cells

图5 银条多糖SFPSA对人胃腺癌细胞HGC-27增殖的抑制作用Fig.5 Inhibitory effect of SFPSA on the proliferation of human gastric cancer HGC-27 cells
由图5可知,当SFPSA的终浓度为125 μg/mL,给药时间为24 h时,SFPSA对HGC-27细胞增殖的抑制作用较低,抑制率为18.39%,而当SFPSA浓度增加到2000 μg/mL时,其对HGC-27的抑制率便提高到47.20%。药物处理72 h后,当药物浓度由125 μg/mL 增加到 2000 μg/mL,SFPSA 对 HGC-27细胞增殖的抑制率由47.20%增加到55.72%。结果表明银条多糖SFPSA也能抑制人胃腺癌HGC-27细胞的增殖,且这种抑制作用也呈现一定的量效关系和时效关系。但要比同一浓度同一时间下对BGC-823细胞的抑制率要高,说明HGC-27对SFPSA的敏感程度比BGC-823要高。

图6 银条多糖SFPSA对人结肠癌细胞HT-29增殖的抑制作用Fig.6 Inhibitory effect of SFPSA on the proliferation of human colon cancer HT-29 cells
由图6可知,银条多糖SFPSA对人结肠癌HT-29细胞增殖的抑制作用也呈现一定的量效和时效关系。125 μg/mL的SFPSA作用24 h后,其抑制率为17.25%,而当 SFPSA浓度增加到2000 μg/mL时,其抑制率提高到32.97%,比SFPSA对HGC-27细胞的抑制作用的增幅要大。2000 μg/mL的SFPSA分别作用24、48和72 h后,其对HT-29细胞的抑制率从44.69%增加到64.68%,即呈现时效关系。
研究表明,多糖的抗肿瘤活性受到多糖分子量、单糖组成等因素影响。而高分子量和高半乳糖含量等特性均有助于多糖抗肿瘤活性的发挥[9,10]。而本研究中的SFPSA同时具有高分子量和高半乳糖含量的特性,这可能是其具有抗肿瘤活性的原因之一。以上结果表明银条多糖SFPSA对BGC-823、HGC-27和HT-29三种癌细胞的增殖均有较好的抑制作用,且抑制能力存在剂量和时间的依赖关系,为了更加直观的比较三种癌细胞对SFPSA敏感程度的差异,我们将它们的半数抑制浓度IC50计数出来,如表1所示。在给药处理24、48、72 h后,SFPSA对HT-29均具有最低的IC50值,分别为:2438.38、908.624和407.52 μg/mL。根据IC50值的高低,可以得出三种癌细胞对SFPSA的敏感程度由强到弱的顺序关系:HT-29>HGC-27>BGC-823。有关SFPSA抑制人结肠癌HT-29细胞增殖的机理有待进一步研究。

表1 银条多糖SFPSA对不同癌细胞的半数抑制浓度Table 1 50%concentration of inhibition of SFPSA on different cancer cells
3 结论
从银条粗多糖中分离纯化得到的SFPSA片段为分子量相对均一的杂多糖,其相对重均分子量为168.30 kDa。糖腈乙酰酯化法分析银条多糖SFPSA单糖组成的结果表明,SFPSA中含鼠李糖,阿拉伯糖,葡萄糖和半乳糖等单糖组分,其摩尔百分比为8.19∶37.74∶3.46∶50.61。SFPSA 对人胃腺癌 BGC-823、HGC-27和人结肠癌HT-29三种癌细胞的增殖均有抑制作用,且这种增殖抑制作用呈现一定的的量效和时效关系。通过比较SFPSA对三种癌细胞的半数抑制浓度(IC50)可知,人结肠癌HT-29细胞对SFPSA最为敏感,可作为下一步SFPSA抗癌机理的研究对象。
1 Lai CL(赖春丽),Huang WF(黄婉锋),Zhu CC(祝晨蔯),et al.The development of Chinese herbal medicines with antitumor activities.J Chin Med Mater(中药材),2003,26:677-680.
2 Shen LH(申利红),Wang JS(王建森),Li Y(李雅),et al.Research and application of plant polysaccharide.Chin Agric Sci Bull(中国农学通报),2011,27:349-352.
3 The Insititute of Vegitables and Flowers Chinese of Agricultural Sciences(中国农业科学院蔬菜花卉研究所).Chinese Vegetable Varieties(V.2)(中国蔬菜品种志下卷).Beijing:China Agricultural Technology Press,2001.1128
4 Li SY(李素云),Liang ZL(梁中丽),Dong TY(董铁有).Study on vacuum freeze-drying technology of Stachys Floridana Schuttl.ex Benth by mixed-press.Grain Distri Tech(粮食流通技术),2010,2:35-37.
5 Chen Y(陈燕),Zhong XF(钟先锋),Huang GD(黄桂东),et al.Extraction conditions of stachyose from Stachys floridana Schuttl.ex Benth.Nat Prod Res Dev(天然产物研究与开发),2011,23:123-130.
6 Ma LP,Gan D,Wang MC,et al.Optimization of extraction,preliminary characterization and hepatoprotective effects of polysaccharides from Stachys floridana Schuttl.ex Benth.Carbohyd Polym,2012,87:1390-1398.
7 Zhang WJ(张惟杰).Sugar Complex Biochemical Research Technology(糖复合物生化研究技术).Hangzhou:Zhejiang University Press,2003.
8 Jiang CX,Wang MC,Liu J,et al.Extraction,preliminary characterization,antioxidant and anticancer activities in vitro of polysaccharides from Cyclina sinensis.Carbohyd Polym,2011,84:851-857.
9 Huang QL,Jin Y,Zhang LN,et al.Structure,molecular size and antitumor activities of polysaccharides from Poria cocos mycelia produced in fermenter.Carbohyd Polym,2007,70:324-333.
10 Fan YL,Wang WH,Song W,et al.Partial characterization and anti-tumor activity of an acidic polysaccharide from Gracilaria lemaneiformis.Carbohyd Polym,2012,88:1313-1318.

