ESI-Q-TOF-MS/MS研究N-取代邻苯二甲酰亚胺衍生物的裂解途径
梁现蕊,郭子立,俞传明
(浙江工业大学药学院,绿色制药技术与装备教育部重点实验室,浙江 杭州 310014)
ESI-Q-TOF-MS/MS研究N-取代邻苯二甲酰亚胺衍生物的裂解途径
梁现蕊,郭子立,俞传明
(浙江工业大学药学院,绿色制药技术与装备教育部重点实验室,浙江 杭州 310014)
为了研究N-取代邻苯二甲酰亚胺类衍生物的质谱裂解行为,应用电喷雾-四极杆-飞行时间串联质谱(ESI-Q-TOF-MS/MS),在正离子模式下研究了5种N-取代邻苯二甲酰亚胺衍生物的质谱裂解行为,并对其质谱裂解途径进行解析,为表征该类化合物提供了依据。实验发现该5种化合物具有相似的裂解途径,即丢失化合物母核N-羟基邻苯二甲酰亚胺,甲醇和CO等中性小分子。化合物1~4的特征离子为丢失N-羟基邻苯二甲酰亚胺和甲醇产生的离子;化合物5的特征离子为丢失N-羟基邻苯二甲酰亚胺产生的类似于卓鎓离子结构的离子,该特征离子继续丢失甲醇和CO,最后卓鎓离子继续开裂丢失一分子C2H2。
裂解途径;N-取代邻苯二甲酰亚胺;电喷雾-四极杆-飞行时间串联质谱(ESI-Q-TOF-MS/MS)
随着现代分析技术的发展,质谱技术在化合物结构研究中的应用日渐广泛,尤其是近年来发展并完善起来的一种新型离子化分析技术,即电喷雾(ESI)技术[1-2]。作为一种新的软电离技术,ESI源中化合物离子化行为不同于传统的电子轰击(EI)源[3],它的一级全扫描质谱通常不会产生碎片离子,但可以获得化合物的相对分子质量信息;而MS/MS则能提供比较丰富的碎片信息,借助这些碎片信息可以推断化合物的相关结构,因此得到了研究者的广泛关注[4-9]。由于受分辨率的影响,很多化合物的分析研究都受到限制,直到飞行时间质谱的出现,分辨率的问题才得以解决[10-11]。
3-羟基异噁唑类衍生物是一种极为重要的杂环化合物,受到很多学者的探索和研究。该类化合物具有显著的生物活性,如从蘑菇毒蝇伞分离提纯出来的蝇蕈醇(镇静药,止吐药)和鹅膏蕈氨酸。蝇蕈醇是非选择性的GABAA受体激动剂[12],并以其为母核开发出具有特殊临床活性的GABA吸收抑制剂THPO[13];鹅膏蕈氨酸能够非选择性的干扰所有(S)-谷氨酸受体[14]。此外,3-羟基异噁唑类衍生物还被开发为除草剂、杀菌剂和广谱杀虫剂,如立枯灵和异噁唑磷是已开发上市的农用化学品[15]。N-取代邻苯二甲酰亚胺衍生物作为合成4,5-二氢-3-羟基异噁唑衍生物的关键中间体,对其进行研究显得尤其重要。
N-取代邻苯二甲酰亚胺衍生物的裂解机理目前还没有文献报道,为此本研究利用电喷雾-四极杆-飞行时间质谱的高分辨性能及其串联质谱功能,对5种结构相似的N-取代邻苯二甲酰亚胺衍生物进行质谱分析。
1 实验部分
1.1主要试剂与仪器
实验所用的N-取代邻苯二甲酰亚胺衍生物1~5均为实验室合成[16],其结构式示于图1,已经NMR、IR、UV和MS确证。甲醇(HPLC纯):德国Merck公司产品;Agilent 6540 QTOF质谱仪:美国Agilent公司产品,配有Mass Hunter数据处理系统、Agilent 1260 HPLC自动进样器。

图1 N-取代邻苯二甲酰亚胺衍生物的结构Fig.1 The structures of N-substituted phthalimide derivatives
1.2质谱分析条件
复合电喷雾电离源(Dual ESI);毛细管电压:3.5 kV;干燥气流速:10 L/min;雾化气压力:2.8×105Pa;毛细管温度:350 ℃;碰撞气体:氦气;甲醇为溶剂,Agilent 1260 HPLC自动进样器进样;进样速度:0.2 mL/min;检测方式:正离子模式;化合物4的碎裂电压:120 V,其余化合物的碎裂电压:150 V;CID能量:0~30 eV。
1.3实验方法
分别配制化合物的甲醇溶液置于自动进样器中,用Agilent 1260 HPLC进样器直接导入Dual ESI电离源,正离子模式检测。将得到的待测物[M+H]+准分子离子作为母离子进行MS/MS分析,以用于化合物裂解规律的研究。
2 结果与讨论
2.15种化合物的一级全扫描质谱
采用电喷雾离子源,在正离子检测模式下,对5种N-取代邻苯二甲酰亚胺衍生物进行一级质谱全扫描分析,检测结果列于表1。所有样品均可观察到[M+1]+准分子离子峰。
2.25种化合物的二级质谱结果
为进一步研究其质谱的裂解途径,在正离子检测模式下,分别对各准分子离子进行二级质谱(MS/MS)分析,所产生的产物离子丰度以及可能的元素组成列于表2。

表1 5种化合物的一级质谱数据
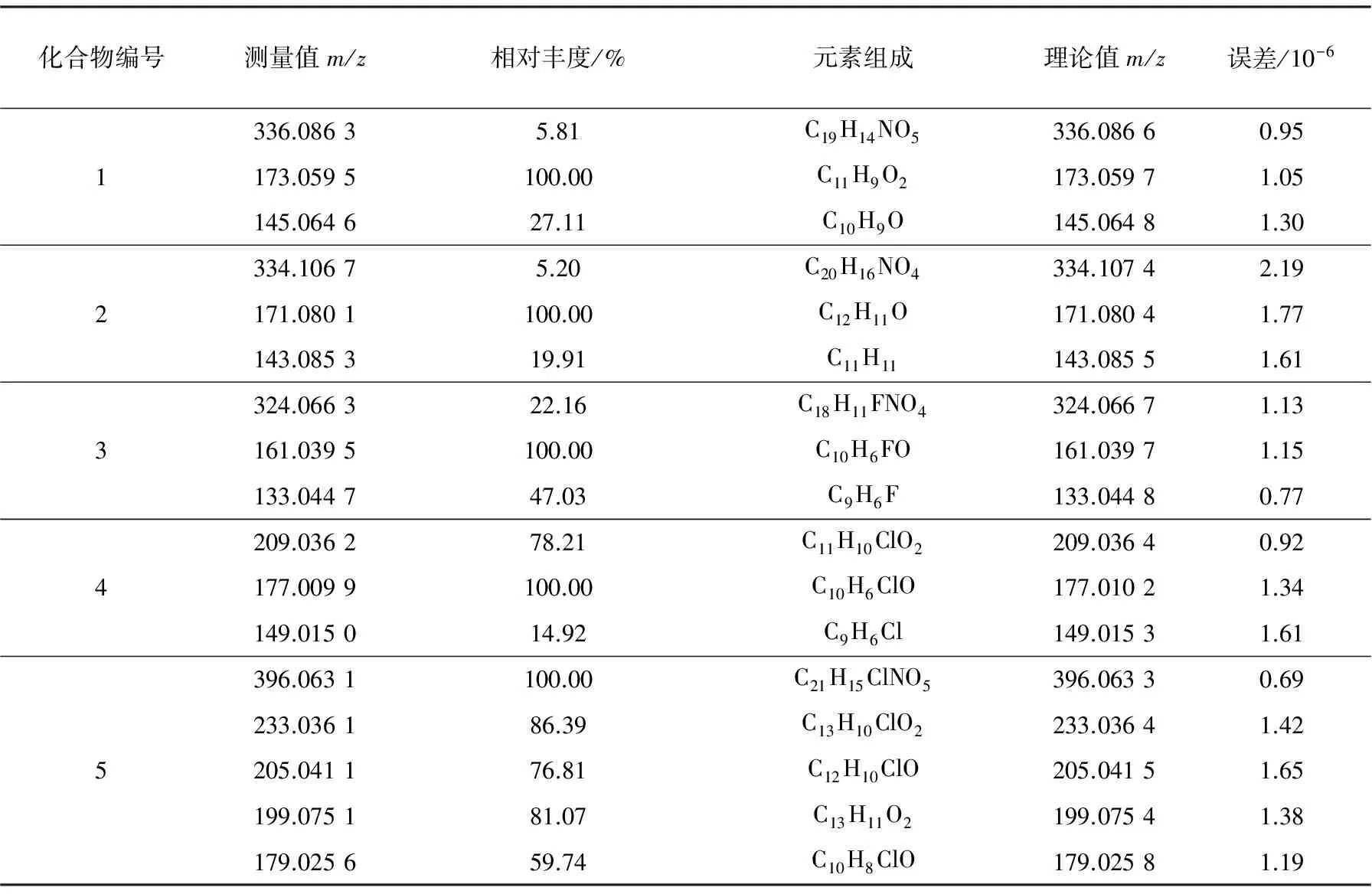
表2 主要的产物离子及其元素组成
2.3MS/MS结果分析及裂解途径研究
化合物1~4的裂解途径示于图2。化合物1~3经历了图2中路径I的裂解途径。由实验数据得出,3个化合物的特征碎片离子(基峰)均为丢失甲醇和N-羟基邻苯二甲酰亚胺后所产生的离子。由实验路径I可以看出:化合物首先丢失一分子甲醇,正电荷转移到了羰基碳上[17-18],生成了离子a;离子a进一步通过苯环邻位氢原子的转移而导致丢失母核N-羟基邻苯二甲酰亚胺,形成一个具有五元环结构的离子b;离子b中含有的羰基结构很容易发生脱羧反应丢失CO[19-20],从而生成离子c。
化合物4经历了如图2中路径II的裂解途径,即化合物首先丢失N-羟基邻苯二甲酰亚胺,然后连续丢失甲醇得到特征碎片离子(基峰)b’,最后丢失CO,生成离子c。化合物4不同于上述3个化合物,即首先丢失N-羟基邻苯二甲酰亚胺,之后丢失甲醇,这是由于苯环上的氯与苯环和侧链羰基形成了一个大的共轭体系,使得甲醇离去变得相对较难。
化合物5的裂解途径与化合物1~3的裂解途径相同,不同的是化合物5的芳环侧链较其它化合物的芳环侧链长,所以脱母核所成的环为类似卓鎓结构的七元环离子,该离子具有比较高的稳定性,同时该七元环离子还能进一步开裂,脱去一分子的乙炔分子[21],形成m/z179.025 6离子。至于离子m/z199.075 1的形成则是由于化合物5的芳环侧链上含有氯原子,在成环的同时脱氯形成该离子,其裂解途径示于图3。
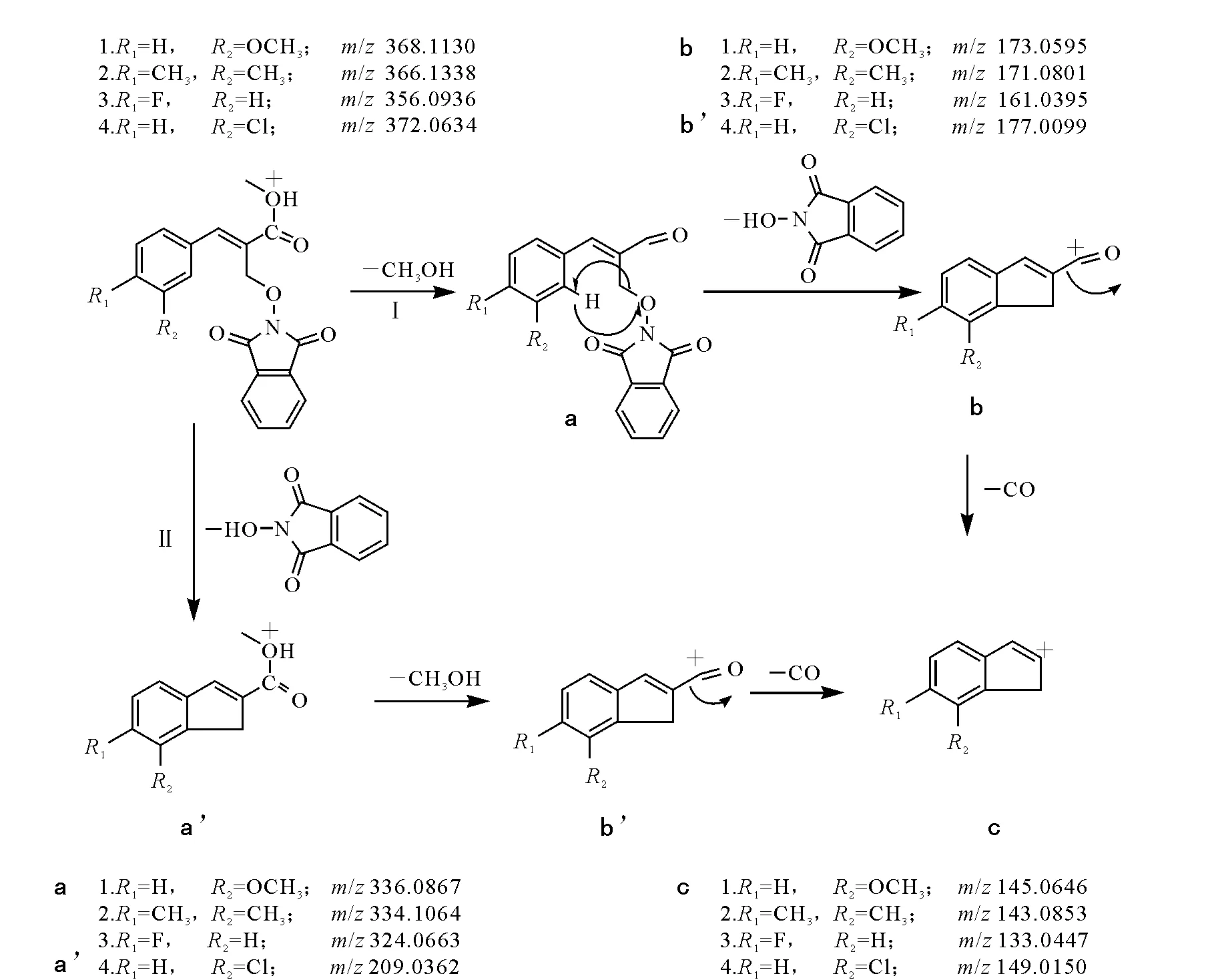
图2 化合物1~4的裂解途径Fig.2 Cleavage progresses of compounds 1—4

图3 化合物5的裂解途径Fig.3 Cleavage progress of compound 5
3 结论
本工作应用电喷雾-四极杆-飞行时间串联质谱(ESI-Q-TOF-MS/MS)研究了N-取代邻苯二甲酰亚胺衍生物的裂解途径。5种化合物在正离子模式检测下能给出较丰富的结构信息。二级质谱实验结果表明:所研究的5种化合物均易丢失中性分子甲醇,N-羟基邻苯二甲酰亚胺和CO。化合物1~4的特征离子为丢失N-羟基邻苯二甲酰亚胺和甲醇产生的离子;而化合物5的特征离子为丢失甲醇所产生的离子,这是因为化合物5的芳环侧链较长且含有共轭结构,所以能够形成类似于卓鎓结构的七元环离子,然后卓鎓离子继续开裂丢失一分子的C2H2。
[1] SIMON J G. Electrospray: Principles and practice[J]. J Mass spectrometry, 1997, 32: 677-688.
[2] WHITEHOUSE C M, DREYER R N, YAMAS-HITA M, et al. Electrospray interface for liquid chromatographs and mass spectrometers[J]. Anal Chem, 1985, 57: 675-679.
[3] ASHCROFT A G. Ionization methods in organic mass spectrometry[M]. Royal Society of Chemistry, 1997: 1-176.
[4] LAI C M, LI S P, YU H. A rapid HPLC-ESI-MS/MS for qualitative and quantitative analysis of saponins in “XUESETONG” injection[J]. J Pharm Biomed Anal, 2006, 44: 669-678.
[5] PAOLA M, ALEXANDRE S, ANGELA P, et al.Determination of steroidal glycosides in yucca gloriosa fowers by LC/MS/MS[J]. J Pharm Biomed Anal, 2010, 52: 791-795.
[6] JEONG E K, LEE S Y, YU S M, et al. Identifi-cation of structurally diverse alkaloids in corydalis species by liquid chromatography/ electrospray ionization tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2012, 26: 1 661-1 674.
[7] TAI Y P, PEI S F, WAN J P, et al. Fragmentation study of protonated chalcones by atmospheric pressure chemical ionization and tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2006, 20: 994-1 000.
[8] GUO C, HU N, JIANG K Z, et al. Study of fr-agmentation pathways of lithiated α,β-unsaturated thioesters by electrospray ionization mass spectrometry[J]. Rapid Commun Mass Spectrom, 2010, 24: 409-414.
[9] HUO F F, BAI Y, LIU H W. Fragmentation investigation of brassinosteroid compounds by ion trap and quadrupole time-of-flight mass spectrometry[J]. Rapid Commun, Mass Spectrom, 2010, 24: 3 325-3 334.
[10] SOUISSI Y, BOURCIER S, BOUCHONNET S, et al. Estrone direct photolysis: By-product identification using LC-Q-TOF[J]. Chemosphere, 2012, 87(2): 185-193.
[11] KANG L P, YU K, ZHAO Y, et al. Characterization of steroidal glycosides from the extract ofparispolyphyllavar.yunnanensisby UPLC/Q-TOF MSE[J]. J Pharm Biomed Anal, 2012, 62: 235-249.
[12] LARSEN P K, HJEDS H, CURTIS D R, et al. Dihydromuscimol, thiomuscimol and related heterocyclic compounds as GABA anlogues[J]. J Neurochem, 1978, 32: 1 717-1 724.
[13] LARSEN P K, JOHNSTON G A R. Inhibition of GABA uptake in rat brain slices by nipecotic acid, various tsoxazoles and related compounds[J]. J Neurochem, 1975, 25: 797-802.
[14] LARSEN P K, EBERT B, LUND T M, et al. Design of excitatory amino acid receptor agonists, partial agonists and antagonists: Ibotenic acid as a key lead structure [J]. Eur J Med Chem, 1996, 31: 515-537.
[15] SATO K, SUGAI S, TOMITA K. Synthesis of 3-hydroxyisoxazoles from β-ketoesters and hydroxylamine[J]. Agric Biol Chem, 1986, 50(7): 1 831-1 837.
[16] ZHONG W H, LIU Y L, GUO B M. Efficient synthesis of 4-substituted 4,5-dihydroisoxazol-3-ols from morita-baylis-hillman bromides[J]. Heterocycles, 2009, 78: 3 053-3 064.
[17] CHARLES L, LEJARS M, MARGAILLAN A, et al. Fragmentation pathways of methacrylic homopolymers with labile trialkylsilyl ester side-groups:A mass spectrometric investigation of the RAFT process[J]. Int J Mass Spectrom, 2012, 311: 31-39.
[18] AARON W A, EDWARD H, SEAN H, et al. Site-specific hydrogen exchange and hydrogen transfer processes preceding the fragmentation of long-lived radical cations of ethyl dihydrocinnamate and related arylalkanoates[J]. Int J Mass Spectrom, 2012, (316/317/318): 206-215.
[19] ZHAO J F, SHOEIB T, SIU K W M, et al. The fragmentation of protonated tyrosine and iodotyrosines: The effect of substituents on the losses of NH3and of H2O and CO[J]. Int J Mass Spectrom, 2006, (255/256): 265-278.
[20] YAN G Q, LI Q R, TAN H R, et al. Electrospray ionization ion-trap time-of-flight tandem mass spectrometry of two furofurans: Sesamin and gmelinol[J]. Rapid Commun Mass Spectrom, 2007, 21: 3 613-3 620.
[21] 吴立军. 有机化合物波谱解析[M]. 3版, 北京: 中国医药科技出版社, 2009.
FragmentationPathwaysofN-substitutedPhthalimideDerivativesUsingElectrosprayIonizationQuadrupoleTime-of-FlightMassSpectrometry
LIANG Xian-rui, GUO Zi-li, YU Chuan-ming
(KeyLaboratoryforGreenPharmaceuticalTechnologiesandRelatedEquipmentofMinistryofEducation,CollegeofPharmaceuticalSciences,ZhejiangUniversityofTechnology,Hangzhou310014,China)
N-substituted phthalimide derivatives were studied by electrospray ionization mass spectrometry (ESI-MS) in positive mode in conjunction with high-resolution quadrupole time-of-flight mass spectrometry (Q-TOF-MS), in order to study its’ fragmetation pathways. Based on mass spectrum behaviors of the fragmentation pathways, all the five compounds showed a similar cleavage progress. Classical losses of CO and methanol owing to the presence of ester were observed in all these compounds; in addition, the loss of mother nucleusN-hydroxy phthalimide was observed in the five compounds. The characteristic ions of compounds 1—4 were the ions which lost methanol andN-hydroxy phthalimide. However, the characteristic ion of compound 5 was the ion of losingN-hydroxy phthalimide, whoses structure was similar to tropylium ion, then continuously lost a molecular C2H2after losing methanol and CO in a row.
fragmentation pathways;N-substituted phthalimide; electrospray ionization quadrupole time-of-flight mass spectrometry (ESI-Q-TOF MS/MS)
O 657.63
A
1004-2997(2013)05-0151-06
10.7538/zpxb.2013.34.03.0151
2013-01-15;
2013-03-06
国家自然科学基金(21206148)资助
梁现蕊(1975~),女,山东临沂人,副教授,从事药物结构分析研究。E-mail: liangxrvicky@zjut.edu.cn

