自发性高血压大鼠心肌组织microRNA-133a与TGF-β1蛋白表达的改变及意义*
谭文鹏, 杨 侃, 陈晞明, 陈次滨
(1广州医学院第三附属医院心内科,广东 广州 510150; 2中南大学湘雅三医院心内科,湖南 长沙 410013)
自发性高血压大鼠心肌组织microRNA-133a与TGF-β1蛋白表达的改变及意义*
谭文鹏1△, 杨 侃2, 陈晞明1, 陈次滨1
(1广州医学院第三附属医院心内科,广东 广州 510150;2中南大学湘雅三医院心内科,湖南 长沙 410013)
目的观察microRNA-133a(miR-133a)与转化生长因子-β1(transforming growth factor β1,TGF-β1)蛋白在自发性高血压大鼠(spontaneously hypertensive rats,SHR)心肌组织中的表达改变和关系。方法取12只18周龄雄性自发性高血压大鼠为SHR组,12只18周龄雄性Wistar-Kyoto (WKY)大鼠为对照组,通过无创血压测量分析系统测大鼠尾动脉血压,Masson染色检测心肌胶原容积分数(collagen volume fraction,CVF)和血管周围胶原面积比率(perivascular collagen area ratio, PVCA),实时荧光定量PCR检测miR-133a表达水平,免疫组化和Western blotting法检测心肌TGF-β1蛋白表达。结果与对照组比较,SHR组的收缩压和舒张压明显升高(P<0.01),心肌CVF和PVCA明显升高(P<0.01),TGF-β1蛋白表达水平明显升高(P<0.01),miR-133a表达水平明显降低(P<0.01),SHR组心肌miR-133a表达水平为对照组的(23.9±4.6)%;SHR组心肌组织miR-133a与TGF-β1蛋白表达水平呈负相关(r=-0.791,P<0.01)。结论SHR心肌组织miR-133a表达下调,伴随TGF-β1蛋白表达升高和胶原合成增加。miR-133a与TGF-β1可能参与SHR大鼠的心肌纤维化。
微小RNA; 转化生长因子 β1; 自发性高血压大鼠; 心肌纤维化
高血压是常见的心血管疾病,能导致心肌纤维化、心肌肥厚等心脏病理生理改变,从而引起心力衰竭、心律失常等不良预后。微小核糖核酸(microRNA,miRNA)是内源性非编码的小分子RNA,通过调控基因表达广泛参与生命进程及疾病发生发展[1-2]。目前研究表明,miRNAs在心肌纤维化、心肌肥厚等心血管疾病的病理生理过程中具有重要的调控作用[3-6]。转化生长因子 β1(transforming growth factor-β1,TGF-β1)是公认的促纤维化细胞因子,能诱导胶原、蛋白聚糖等细胞外间质(extracellular matrix,ECM)成分合成,从而促进心肌纤维化[7-8]。研究表明,在尼古丁诱导的犬心房成纤维细胞,microRNA-133a(miR-133a)表达受抑制,导致TGF-β1蛋白表达上调伴随大量胶原合成,miR-133a能通过调节TGF-β1蛋白表达参与成纤维细胞胶原合成[9]。但是目前在高血压病中,miR-133a与TGF-β1蛋白表达关系的研究报道较少。本文通过检测自发性高血压大鼠(spontaneously hypertensive rats,SHR)心肌组织中的miR-133a与TGF-β1蛋白表达水平,对二者在高血压引起的心肌纤维化中关系进行探讨。
材 料 和 方 法
1材料
1.1实验对象 14周龄的雄性SHR和Wiskar-Kyoto(WKY)大鼠各12只,体质量220~240 g,购自北京维通利华生物公司,许可证编号为SCXK(京)2006-0009。
1.2材料与设备 TGF-β1小鼠单克隆抗体(MAB240,R&D);辣根过氧化物酶结合的马抗鼠Ⅱ抗、ABC试剂盒和DAB试剂盒(Vector);Trizol试剂(Invitrogen);miScript Reverse Transcription Kit、miR-133a引物和U6内参照(Qiagen);蛋白裂解液(西安晶彩公司);Western blotting羊抗鼠Ⅱ抗、β-actin内参照(Jackson)。动物恒温系统和无创血压测量分析系统(上海奥尔科博公司);石蜡切片机(Leica);光学显微镜(Nikon);PCR仪(Bio-Rad);电泳仪、电泳槽(北京六一仪器厂)。
2方法
2.1大鼠血压测量 用无创测压法测大鼠尾动脉压,在大鼠安静清醒状态下测量血压。恒温系统加热至39 ℃,使尾动脉出现明显的搏动波,尾袖气囊充气阻断尾动脉搏动波,缓慢放气测量血压,反复测3次。观察4周,SHR血压持续明显升高,WKY大鼠血压正常作为正常对照,2组均在18周龄时取心脏标本。
2.2大鼠心脏标本处理 称量大鼠体质量,10%水合氯醛(350 mg/kg)腹腔注射麻醉,取出心脏,在冰生理盐水中清洗血液,无菌滤纸吸干水分,减去心房组织和右心室游离壁,电子天平称取左心室重量。左室重量指数(left ventricular weight index,LVWI)=左心室重量(mg)/体质量(g)。垂直于心室长轴,在中点处将左心室横切成两半,心尖部用4%多聚甲醛固定8 h,乙醇梯度脱水后石蜡包埋,做形态学检测;心底部放入冻存管,-80 ℃超低温冰箱储存,行分子生物学检测。
2.3大鼠心肌组织Masson染色及观察 作心肌组织石蜡切片(厚5 μm),常规脱蜡后行Masson胶原染色。光学显微镜下观察心肌组织胶原改变。通过NIS-Elements 图像软件摄取照片,并测定胶原面积在视野中所占面积百分比。每张切片选 5个不含血管和瘢痕组织视野,测量心肌胶原容积分数[collagen volume fraction,CVF(%) =心肌胶原面积/所测视野面积×100%];每张切片任选 3支小动脉,测量血管周围胶原面积比率(perivascular collagen area ratio,PVCA=小动脉周围胶原面积/小动脉管腔面积)。
2.4免疫组化法检测心肌组织TGF-β1蛋白表达 切片脱蜡后80 ℃抗原热修复20 min,3%H2O2消除内源性过氧化物酶;封闭2 h,加TGF-β1小鼠单克隆抗体(1∶50),4 ℃孵育过夜;辣根过氧化物酶结合的马抗鼠Ⅱ抗(1∶400),室温孵育2 h;ABC工作液孵育2 h,DAB法显色,脱水后封片。光学显微镜下观察,组织中棕黄色颗粒为阳性染色,每个组织切片取5个视野拍照,通过NIS-Elements BR 3.00 图像分析系统对结果进行半定量分析,阳性面积占组织切片面积的比例为阳性数值。
2.5Western blotting法检测心肌组织TGF-β1蛋白水平 提取心肌组织总蛋白,Bradford法进行蛋白质定量;10 % SDS-PAGE 胶电泳分离蛋白质,转膜;封闭1 h,TGF-β1小鼠单克隆抗体(1∶10 000)4 ℃孵育过夜;羊抗鼠Ⅱ抗(1∶2 000)室温孵育1 h;显色显影定影,扫描胶片,用图像分析软件Image-Pro Plus 6.0对图像进行灰度分析。
2.6实时荧光定量PCR(real-time qPCR)检测心肌组织miR-133a表达 取100 mg大鼠心脏组织,Trizol试剂盒提取心肌总RNA;逆转录合成cDNA,逆转录反应体系:miScript HiFlex Buffer 2 μL,Nucleics Mix 1 μL,miScript Reverse Transcriptase Mix 1 μL,总RNA 6 μL,混匀后短暂离心,37 ℃反应1 h, 95 ℃水浴5 min,将得到的cDNA 置于-20 ℃保存备用。PCR反应体系:cDNA 1 μL,miScript Universal Primer 1 μL,miR-133a引物or U6 1 μL,SYBR Green qPCR Mix10 μL,水7 μL,反应条件95 ℃ 15 s, 58 ℃ 30 s,40个循环后PCR 仪采集荧光信号。PCR扩增反应完成后,在实验系统中调整基线和阈值,达到阈值时的循环数为各反应孔的Ct值。目的基因相对量=2-ΔCt,ΔCt=Ct目的基因-Ct内参照基因。
3统计学处理
采用SPSS 13.0软件对数据进行统计分析,数据以均数±标准差(mean±SD)表示。两组间均数比较采用t检验,变量间的相关分析采用Pearson直线相关分析。以P<0.05为差异有统计学意义。
结 果
1大鼠一般资料
与对照组比较,SHR组尾动脉收缩压和舒张压明显升高(P<0.01),LVWI明显增大(P<0.05),见表1。
2大鼠心肌组织Masson染色结果
对照组可见红色心肌细胞排列整齐紧密,细胞间隙散在少量蓝色胶原纤维,SHR组心肌细胞排列紊乱,细胞间隙增宽,可见大量蓝色胶原纤维沉积,见图1。对心肌胶原纤维定量分析显示,SHR组的CVF和PVCA较对照组明显升高(P<0.01),见表1。
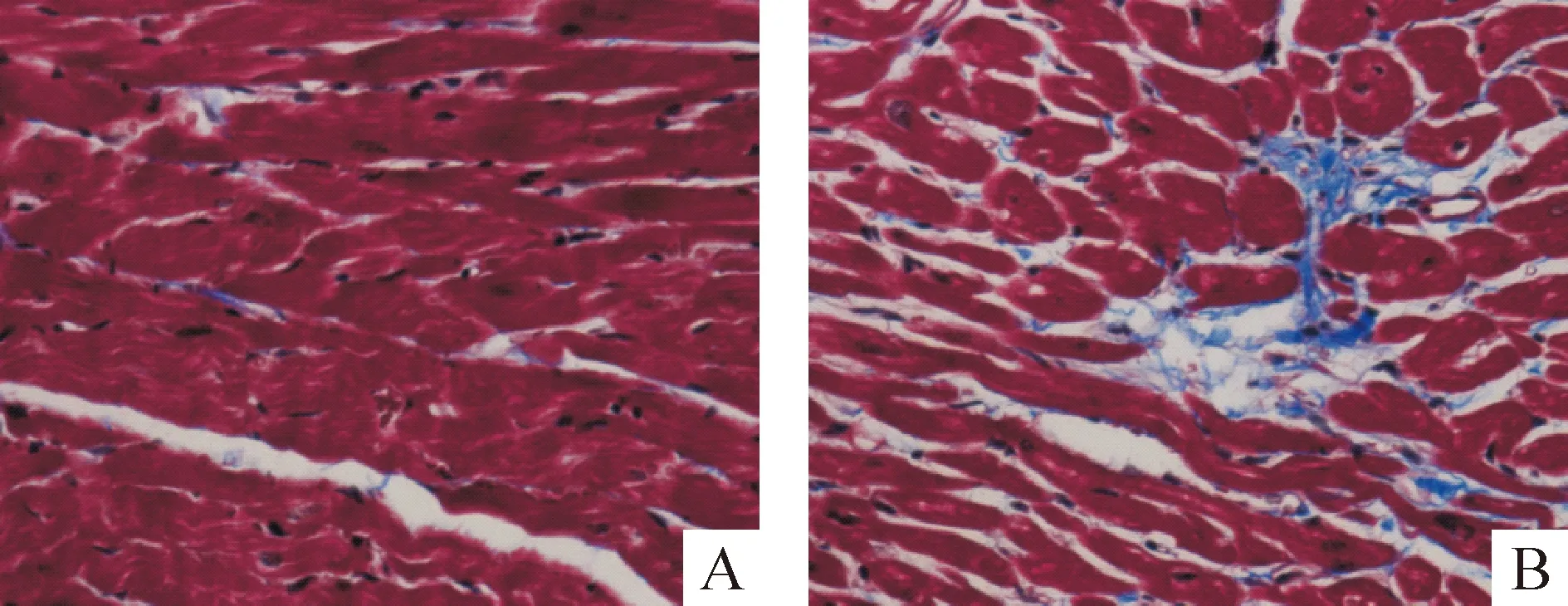
Figure 1. Masson staining of myocardial tissues of rats(×400). A:control group;B :SHR group.
图1大鼠心肌组织Masson染色结果
表1两组大鼠一般资料与心肌胶原含量的变化
Table 1. Characteristics and changes of collagen in myocardial tissues of rats(mean±SD.n=12)

GroupSBP(mmHg)DBP(mmHg)LVWI(mg/g)CVF(%)PVCAControl118.6±7.876.2±6.72.38±0.322.87±0.340.81±0.11SHR192.7±15.4**102.0±9.3**3.05±0.46*5.56±0.61**1.34±0.28**
*P<0.05,**P<0.01vscontrol group.
3大鼠心肌组织TGF-β1蛋白表达改变
免疫组化检测显示,TGF-β1主要在成纤维细胞表达,分布在细胞膜、胞浆及细胞间隙,对照组心肌有少量TGF-β1表达,SHR组心肌可见TGF-β1大量表达,见图2。Western bltting检测显示,SHR组心肌TGF-β1蛋白表达水平显著高于对照组(1.21±0.14vs0.65±0.07,P<0.01),见图3。
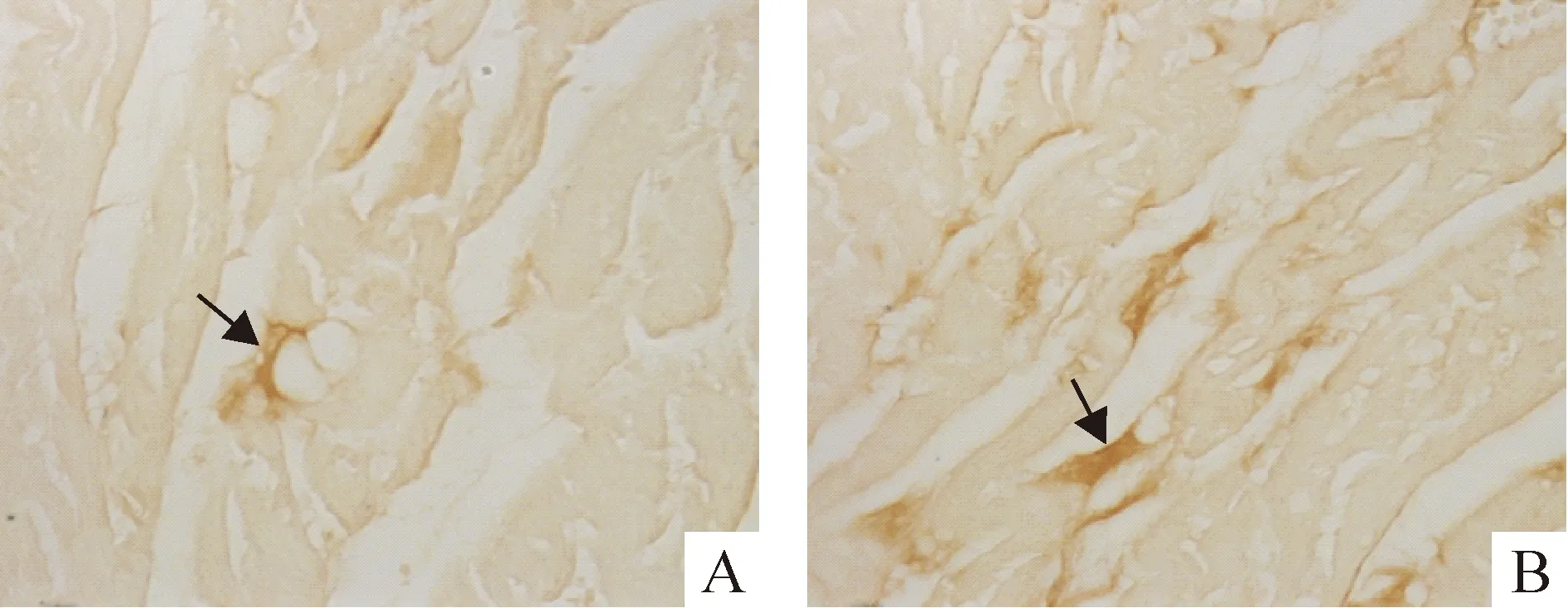
Figure 2. Immunohistochemical staining of TGF-β1in myocardial tissues of rats(×400). A:control group;B :SHR group.
图2大鼠心肌TGF-β1免疫组化染色

Figure 3. Changes of protein expression of TGF-β1in myocardial tissues of rats.
图3大鼠心肌组织TGF-β1蛋白表达改变
4大鼠心肌组织miR-133a表达
miR-133a的熔解曲线均为单峰状,表明PCR产物无污染、引物二聚体和假阳性,引物特异性良好,见图4。Real-time qPCR结果显示,SHR组心肌miR-133a表达水平较对照组明显降低(P<0.01),SHR组心肌miR-133a表达水平为对照组的(23.6±4.5)%。
Figure 4. Result of fluorescent quantitation of miR-133a in myocardial tissues of rats.
图4大鼠心肌组织miR-133a荧光定量PCR结果
5大鼠心肌组织miR-133a与TGF-β1蛋白表达水平相关性分析
Pearson直线相关分析显示,SHR组心肌组织miR-133a表达水平与TGF-β1蛋白表达水平呈显著负相关(r=-0.791,P<0.01)。
讨 论
高血压、心肌梗死等多种心血管疾病均可导致心肌细胞外间质增生、胶原沉积,从而引起心脏结构功能异常[10]。TGF-β是公认的具有重要作用的促纤维化细胞因子,TGF-β1能通过自分泌和旁分泌,作用于成纤维细胞,诱导其表型改变,使胶原合成能力显著提高[7-8]。
miRNA是内源性非编码蛋白质的小分子RNA,主要功能是通过调控基因表达广泛参与生命进程及疾病发生发展[11]。miR-133a是肌肉特异性miRNA,在心肌含量丰富,研究显示, double-miR-133a基因敲除小鼠的心脏发生严重的心肌纤维化,并最终因心力衰竭死亡,表明miR-133a在心肌细胞间质合成平衡中具有关键作用[12]。在心肌梗死病人及主动脉缩窄动物模型中,心肌miR-133表达水平均出现明显降低[13-14]。研究表明,体外培养的心房成纤维细胞在尼古丁刺激下,miR-133a表达水平下调了60%~70%,并导致TGF-β1蛋白水平显著升高,伴随大量胶原合成;miRNA TargetScan 系统分析显示miR-133a与TGF-β1mRNA的3’-URT有多个可能的结合位点;心房成纤维细胞miR-133的过表达,可以明显减少TGF-β1蛋白表达和胶原合成,这一作用可以被miR-133的反义寡核苷酸(AMO-133)抵消[9]。但是在高血压病中miR-133a与TGF-β1的表达关系目前尚未见研究报道。
本研究发现,18周龄SHR出现了明显的心肌纤维化,Masson染色可见SHR心肌细胞间隙和血管周围有大量胶原纤维沉积,CVF及PVCA均较对照组明显升高。免疫组化检测显示SHR心肌合成大量TGF-β1,在细胞膜、胞浆内及细胞间隙均有表达,表明TGF-β1作为分泌蛋白发挥促纤维化作用。进一步采用Western boltting法进行蛋白定量发现,SHR心肌TGF-β1蛋白水平较对照组升高了1倍左右。Real-time qPCR检测显示,SHR心肌miR-133a表达水平显著降低,为对照组水平的四分之一左右,miR-133a水平与TGF-β1蛋白水平呈显著负相关。
本实验表明,miR-133a在SHR心肌中表达降低,可能对TGF-β1的抑制作用减弱,导致TGF-β1蛋白合成增加,引起心肌纤维化。是否能通过调节miR-133a的表达,增强对TGF-β1蛋白表达的抑制作用,从而改善高血压病的心肌纤维化有待进一步研究。
[1] Filipowicz W, Bhattacharyya SN, Sonenberg N. Mechanisms of post-transcriptional regulation by microRNAs: are the answers in sight?[J]. Nat Rev Genet, 2008,9(2):102-114.
[2] Olena AF, Patton JG. Genomic organization of microRNAs[J]. J Cell Physiol, 2010,222(3):540-545.
[3] Latronico MV, Condorelli G. microRNAs in hypertrophy and heart failure[J]. Exp Biol Med (Maywood), 2011,236(2):125-131.
[4] Bauersachs J. Regulation of myocardial fibrosis by microRNAs[J]. J Cardiovasc Pharmacol, 2010,56(5):454-459.
[5] van RE, Olson EN. Searching for miR-acles in cardiac fibrosis[J]. Circ Res, 2009,104(2):138-140.
[6] 魏 聪, 胡 兵, 申 锷. MicroRNAs在心脏发育和疾病中的作用[J]. 中国病理生理杂志, 2011,27(3):611-615.
[7] Dobaczewski M, Chen W, Frangogiannis NG. Transforming growth factor (TGF)-β signaling in cardiac remodeling[J]. J Mol Cell Cardiol, 2011,51(4):600-606.
[8] Creemers EE, Pinto YM. Molecular mechanisms that control interstitial fibrosis in the pressure-overloaded heart[J]. Cardiovasc Res, 2011,89(2):265-272.
[9] Shan H, Zhang Y, Lu Y, et al. Downregulation of miR-133 and miR-590 contributes to nicotine-induced atrial remodelling in canines[J]. Cardiovasc Res, 2009,83(3):465-472.
[10] Small EM, Thatcher JE, Sutherland LB, et al. Myocardin-related transcription factor-a controls myofibroblast activation and fibrosis in response to myocardial infarction[J]. Circ Res, 2010,107(2):294-304.
[11] Carthew RW, Sontheimer EJ. Origins and mechanisms of miRNAs and siRNAs[J]. Cell, 2009,136(4):642-655.
[12] Liu N, Bezprozvannaya S, Williams AH, et al. microRNA-133a regulates cardiomyocyte proliferation and suppresses smooth muscle gene expression in the heart[J]. Genes Dev, 2008,22(23):3242-3254.
[13] Bostjancic E, Zidar N, Stajer D, et al. MicroRNAs miR-1, miR-133a, miR-133b and miR-208 are dysregulated in human myocardial infarction[J]. Cardiology, 2010,115(3):163-169.
[14] Duisters RF, Tijsen AJ, Schroen B, et al. miR-133 and miR-30 regulate connective tissue growth factor: implications for a role of microRNAs in myocardial matrix remodeling[J]. Circ Res, 2009,104(2):170-178.
RelationshipofmicroRNA-133aandTGF-β1proteininmyocardialtissuesofspontaneouslyhypertensiverats
TAN Wen-peng1, YANG Kan2, CHEN Xi-ming1, CHEN Ci-bin1
(1DepartmentofCardiology,theThirdAffiliatedHospitalofGuangzhouMedicalCollege,Guangzhou510150,China;2DepartmentofCardiology,theThirdXiangyaHospitalofCentralSouthUniversity,Changsha410013,China.E-mail: 492452050@qq.com)
AIM: To observe the changes of microRNA-133a and transforming growth factor β1(TGF-β1) protein in the myocardium of spontaneously hypertensive rats (SHR).METHODSMale SHR (18 weeks old,n=12) and male Wistar-Kyoto rats (WKY, 18 weeks old,n=12) served as SHR group and control group, respectively. Caudal arterial blood pressure was detected by a noninvasive blood pressure measurement and analysis system. Myocardial collagen volume fraction (CVF) and perivascular collagen area ratio (PVCA) were determined by Masson staining. The level of miR-133a in the heart was detected by real-time quantitative PCR. The protein level of TGF-β1in the heart was also analyzed by the methods of immunohistochemisty and Western blotting.RESULTSCompared with control group, systolic and diastolic blood pressure, CVF and PVCA significantly increased, the expression of TGF-β1protein was significantly up-regulated, and the level of miR-133a was significantly reduced in SHR group. In SHR group, the expression of miR-133a was decreased to (23.9±4.6)% in control group. A negative correlation between the levels of miR-133a and TGF-β1protein in SHR group was observed (r=-0.791,P<0.01).CONCLUSIONThe level of miR-133a is down-regulated along with the up-regulation of TGF-β1protein expression and collagen synthesis in the myocardial tissues of SHR. miR-133a and TGF-β1may be involved in myocardial fibrosis in SHR.
MicroRNA; Transforming growth factor β1; Spontaneously hypertensive rats; Myocardial fibrosis
R544.1
A
10.3969/j.issn.1000- 4718.2013.04.031
1000- 4718(2013)04- 0748- 04
2012- 10- 08
2013- 03- 01
广州医学院博士启动基金资助项目(No.2012C59)
△通讯作者 Tel: 020-81292119; E-mail: 492452050@qq.com

