蛋白质组学技术在细胞信号转导研究中的应用
王玮鹏 苗芳芳 武丹丹 杨军 王志钢
(1.内蒙古大学生命科学学院,呼和浩特 010021;2.内蒙古呼和浩特市环境科学研究所,呼和浩特 010030)
随着蛋白分离技术与质谱技术的发展,结合基因组学和转录组学研究获得的海量信息,对蛋白质的研究已从蛋白质化学发展到蛋白质组学的研究阶段,并成为21 世纪生命科学的重要技术支撑和战略前沿。蛋白质组学中的蛋白质鉴定、定量以及相互作用的研究已实现了其对细胞信号转导和相关通路机制的研究作出贡献的早期设想。新的蛋白质组学技术在很大程度上推进了细胞信号转导研究的深入,阐明了细胞信号转导通路是通过蛋白质间相互作用(protein-protein interaction)从而实现信号传递的机制。利用蛋白质组学技术进一步确定各种信号转导通路中的未知分子,实现对这些通路之间的联系(cross-talk)及所构成的错综复杂的细胞内信号网络系统更深入的认识是目前的研究热点。
1 蛋白质组学的概念与技术
1.1 蛋白质组学的定义
1994 年澳大利亚Macquarie大学的Wilkins和Williams等在意大利的第一届Siena会议上首次提出了蛋白质组(Proteome)这个概念,并最初定义为“一个基因组所表达的蛋白质”[1]。目前认为蛋白质组是指一个基因组所编码的全部蛋白质,蛋白质组学是指利用直接测定和鉴别蛋白质的高通量方法,大规模研究蛋白质组的表达动力学和蛋白质相互作用。蛋白质组学是研究细胞和组织中全部蛋白质的科学,试图通过蛋白质组学的研究从细胞水平及整体水平上研究蛋白质的组成及其变化规律,从而深入认识有机体的各种生理和病理过程。
1.2 蛋白质组学研究领域与技术
对蛋白质组的功能分析是功能基因组学的核心。蛋白质组学的研究一般可以划分为3个领域:一是蛋白质鉴定和分析;二是不同生长条件下蛋白质的泛蛋白质组(proteome-wide)差异显示;三是蛋白质-蛋白质相互作用。其运用的技术主要是蛋白质分离与鉴定技术,同时生物信息学技术也是蛋白质组学研究技术中不可或缺的部分。
传统蛋白质研究方法的单一应用已经不能满足目前对蛋白质组研究的要求,在已有方法的基础上将其整合与创新,已经形成了系统的蛋白质组学分离与鉴定、蛋白质相互作用与修饰及定量研究技术。对蛋白质样品的制备通常从样品的预分级开始。常用的预分级方法如二维高效液相色谱、液相等电聚焦及膜电泳,亚细胞分级与单细胞水平样品制备等,主要用以提高低丰度蛋白质的上样量和检测灵敏度,并且可以针对某一细胞器的蛋白质组进行研究。蛋白质的分离与鉴定是预分级处理后蛋白质组学研究中极为重要的一环,双向凝胶电泳(two-dimensional gel electrophoresis,2-DE)和高效液相色谱(high performance liquid chromatography,HPLC) 是 目 前常用的方法,毛细管电泳(capillary electrophoresis,CE)则是经典电泳技术与现代微柱分离技术相结合的产物,具有极高的分辨率,而毛细管色谱(capillary electro chromatography,CEC)则同时具有毛细管电泳的高效分离性和HPLC的高效选择性。
蛋白质鉴定的主要手段之一便是生物质谱(Biomass spectrometry,Bio-MS),Bio-MS是通过制备、分离、检测气相生物大分子来鉴定化合物的高通量技术,具有较高特异性与灵敏性。液质连用(liquid chromatography-mass spectrometry,LC-MS) 是 以 液相色谱作为分离系统,质谱作为检测系统对复杂样品进行实时分析的综合技术,它综合了液相色谱较宽的分离范围特性与MS的高选择性和高灵敏度的特点,能够实现很好的鉴定效果。在此基础上建立的液相色谱串联质谱联用(liquid chromatographytandem mass spectrometry,LC-MS/MS)技术则将液相色谱与串联质谱相结合,检测样品即使在液相色谱难分离的情况下,只要通过多级质谱对目标化合物进行的中性碎片扫描,即可发现并突出混和物中的目标化合物,提供更精确的鉴定效果。此外,近年基体辅助激光解吸电离-飞行时间质谱技术(matrixassisted laser desorption ionization-time of flight-mass spectrometry,MALDI-TOF-MS)、Shotgun混 合 蛋 白鉴定技术及蛋白质从头测序(De-novo)等技术在未知样品分析及翻译后修饰鉴定中得到了广泛应用。同时,蛋白质定量技术近年也逐步发展起来,一是基于传统双向凝胶电泳及染色基础上的定量,如双向荧光差异凝胶电泳(two-dimensional fluorescence difference gel electrophoresis,DIGE),通过三色荧光染料分别对内标和生物样本进行标记,再通过图像分析准确地发现差异表达的蛋白;另一是基于质谱检测技术的定量,包括采用差异同位素标记的相对定量技术,如ICAT(isotope-coded affinity tag)、SILAC(stable isotope labeling with amino acids in cell)和iTRAQ(isobaric tags for relative and absolute quantitation)等,以及含有特定同位素的目标肽段的绝对定量技术。值得注意的是,高通量的蛋白质组学技术的应用是与生物信息学技术的发展分不开的,蛋白质定性与定量测定结果的分析依赖于生物信息学建立起来的计算模型和数据库,尤其是未知蛋白的结构和功能预测更离不开生物信息学的支持。
2 细胞信号转导与分子调控
细胞生长调控是一个受多因素影响的复杂过程,它不仅受到时间和空间的限制,还受到营养条件和细胞内外环境条件的影响。尽管目前对细胞生长和细胞周期的调节机制了解得很少,但它已经成为了现代细胞生物学的研究重点,同时也取得了许多重大进展。细胞内存在许多不同的信号通路来调控细胞内外刺激所引发的反应,并介导细胞的代谢、增殖、分化、迁移、周期阻滞或凋亡等生物学过程。信号分子是细胞的信息载体,种类繁多。信号分子与靶细胞表面受体或胞内受体的特异性结合将受体活化后可以启动靶细胞内一条或多条信号转导途径从而引发细胞代谢或基因表达的改变,进而调控细胞生长与分化[2]。
尽管不同的信号通路具有各自不同的调节机制,但准确的信号传递则需要各个通路之间的交叉作用(cross-talk)从而进一步形成复杂的细胞内信号网络(intracellular network)。随着细胞内新的信号分子的不断发现和鉴定,细胞内信号网络愈加复杂,针对单一信号分子的研究技术和方案已难于满足对细胞生理活动的全面了解的需要。蛋白质组学技术在细胞信号转导研究中的应用为我们揭示了细胞内复杂的信号网络系统,鉴定信号分子复合物,探讨蛋白质间相互作用的分子基础,新伴侣分子的发现,以及已知通路之间的交叉和实现细胞信号转导的动态变化研究提供了重要手段。
3 蛋白质组学技术在细胞信号转导研究中的应用
3.1 在蛋白质之间相互作用中的应用
免疫共沉淀(Co-Immunoprecipitation,Co-IP)和酵母双杂交技术是研究蛋白之间相互作用的基本方法。Co-IP是用抗体将相应特定分子沉淀的同时,与该分子特异性结合的其他分子也会被带着一起沉淀出来的技术,这种技术常用于验证蛋白质之间相互特异性结合。酵母双杂交技术则是在单细胞真核生物酵母在体内利用“诱饵蛋白”(bait)捕获“猎物蛋白”(prey),二者在细胞内相互作用后形成转录激活复合物从而启动报告基因表达。此外,融合蛋白沉降技术与免疫荧光技术也广泛适用于蛋白质相互作用的研究。pull-down技术是利用GST对谷胧甘肤偶联球珠的亲和性,从非相互作用蛋白的溶液中纯化相互作用蛋白,常采用原核表达纯化技术,适用于体外研究蛋白质在溶液中的相互作用。近年单分子操作技术、荧光共振能量转移(fluorescence resonance energy transfer,FRET)技术也有应用于蛋白质-蛋白质相互作用研究的报道,使得蛋白之间的相互作用检测实现了直接可测。蛋白质芯片技术目前得以广泛应用,可将待检测的蛋白混合样品与结合到固相基质上的蛋白质相杂交,从而实现对未知蛋白的分离和鉴定。由于蛋白质芯片的高特异性和敏感性,结合质谱、荧光、显色等方法可以直接或间接地鉴定出与靶蛋白相结合的蛋白质,适用于高通量的蛋白质表达谱分析。
蛋白质复合体在细胞内行使多种功能。鉴定蛋白质复合体的亚基是理解蛋白质复合体功能的基础。Guerrero等[3]发明了一种体内串联亲和纯化交联蛋白质复合体的定量分析(quantitative analysis of tandem affinity purified in vivo cross-linked(X)protein complexes,QTAX)技术来描述体内蛋白质间相互作用(protein-protein interaction,PPI),并利用这一策略成功绘制了酵母中26S蛋白酶体(细胞内降解蛋白的蛋白质复合体)的相互作用网络。26S蛋白质复合体中有64对潜在的PPI,其中42对是新发现的相互作用。
较为复杂的研究则包括许多非常规的蛋白质组学手段。例如,酵母是研究G-蛋白偶联受体(G-protein coupled receptor,GPCR)信号通路的一种模式生物。GPCR研究为理解丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)通路包括交配信息素(mating pheromone)的应答提供了基础。Gruhler等使用13C6-Lysine和13C6-Arginine标记,对赖氨酸和精氨酸营养缺陷型酵母交配信息素诱导的磷酸化改变进行定量蛋白质组学分析,用固定化金属离子亲和层析(immobilized metal ion affinity chromatography,IMAC)富集磷酸化肽段;在离子阱(ion trap)中大量发生中性丢失的离子可被进一步分离、碎裂和分析,这称为MS/MS/MS(MS3)。准确的母离子质量结合MS3图谱信息,可以提高几个数量级的磷酸肽鉴定可信度。该研究以混合线性离子阱-傅立叶变换粒子回旋共振(linear ion trap-Fourier transform ion cyclotron resonance,LTQ-FTICR)质谱仪进行MS/MS和中性丢失导向(neutral lossdirected)的MS3分析,提高对磷酸肽检测及鉴定的灵敏度和准确性。利用MS/MS扫描自动触发数据依赖的MS3对中性丢失的母离子进行碎裂,这一中性丢失依赖的MS3运行模式会出现特征性磷酸丢失(-98 Da),通过2次连续的串联质谱对磷酸肽进行测序。共鉴定了700个磷酸肽,其中139个表达变化在2倍以上,主要是MAPK信号通路成员[4]。
3.2 在分子伴侣研究中的应用
分子伴侣是存在于细胞中,帮助蛋白质正确折叠使之正常行驶功能的小分子蛋白质,对细胞内的信号转导具有重要意义。近几年应用蛋白质组学技术在分子伴侣的相关研究中取得了较大的进展(表 1)。
3.3 在信号转导通路之间的关联与机制研究中的应用
细胞信号传导是细胞通过胞外或胞内的刺激后,激活受体而改变细胞内生理机能的过程,这种刺激可以是很小的分子、蛋白、甚至是光子,细胞经过刺激后通过基因表达水平的改变对外界刺激做出回应。通过对调节生长发育起关键作用的信号通路分子进行研究发现,应答过程不是一条通路的作用结果,而是不同通路之间交互的调控作用结果[11]。随着蛋白质组学的发展,对于细胞通路的交叉作用的研究显得极为重要。通过研究不同通路之间的交叉作用,发现了一些重要通路间的交叉位点(表2)。
4 小结
虽然蛋白质组学技术已经给相关研究带来了许多指导性的结果,但是相关的技术仍具有很大的发展空间。首先是蛋白质的分析与鉴定方面,将某个蛋白质组样品中的所有蛋白质分离并检测仍然是不现实的,目标蛋白质过低的丰度,特殊的蛋白质修饰等都对此技术的发展造成了阻碍。这样便限制了对未知的细胞信号通路中或已知的通路中未知蛋白质的发现。此外,将一个蛋白质相互作用组与另一个相比较几乎是不可实现的,两个相互作用网络间的比较仍然没有很好的方法能够完成,这限制了信号通路间交叉作用的研究。倘若这一技术得到发展,两个相互作用网络的差异得以方便地确定,则会大大增进通路间交叉作用的新发现。
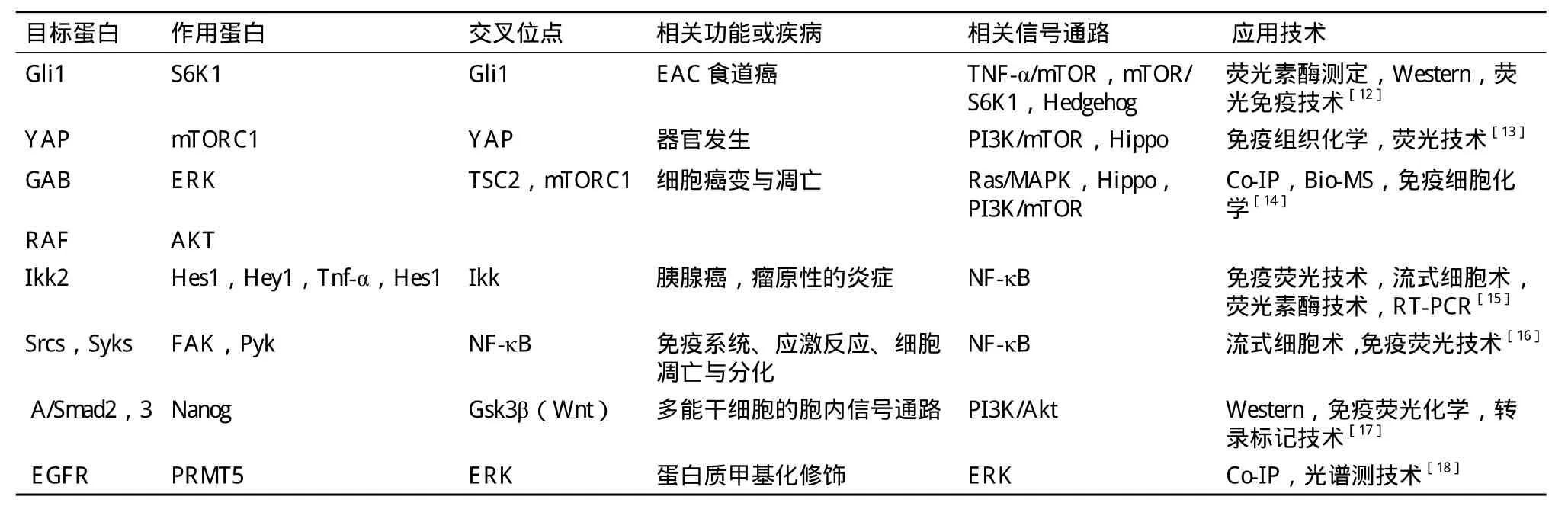
表2 应用蛋白质组学技术发现的重要通路交叉位点及相关功能
未来蛋白质组学在信号转导研究中可能会更加侧重于生命体依赖的复合物、通路以及网络的形式来协调蛋白质之间的相互作用的研究方向。例如,目前通路间的蛋白质相互作用网络是一个相对静态的连线图,需要将基因敲除及系统扰动等数据加入进来,以期认识信号转导作用的本质,发现网络的核心。除此之外,如何在不影响细胞的正常生理条件下的活细胞分析及检测动态的蛋白间相互作用仍然会是研究的热点。
[1] Wilkins MR, Sanchez JC, Gooley AA, et al. Progress with proteome projects:why all proteins expressed by a genome should be identified and how to do it[J]. Biotechnol Genet Eng Rev, 1995,13:19-50.
[2] Jayaseelan S, Tenenbaum SA. Neurodevelopmental disorders:Signalling pathways of fragile X syndrome[J]. Nature, 2012, 492:359-360.
[3] Guerrero C, Tagwerker C, Kaiser P, Huang L. An integrated mass spectrometry-based proteomics approach:QTAX to decipher the 26 S proteasome interacting network[J]. Mol Cell Proteomics, 2006, 5:366-378.
[4] Gruhler A, Olsen JV, Mohammed S, et al. Quantitative phosphorproteomics applied to the yeast pheromone signaling pathway[J]. Mol Cell Proteomics, 2005, 4:310-327.
[5] Haupt A, Joberty G, Bantscheff M, et al. Hsp90 inhibition differentially destabilises MAP kinase and TGF-beta signalling components in cancer cells revealed by kinase-targeted chemoproteomics[J].BMC Cancer, 2012, 12:38.
[6] Moulick K, Ahn JH, Zong H, et al. Affinity-based proteomics reveal cancer-specific networks coordinated by Hsp90[J]. Nat Chem Biol, 2011, 7:818-826.
[7] Witt SN. Molecular chaperones, alpha-synuclein, and neurodegeneration[J]. Mol Neurobiol, 2013, 47:552-560.
[8] Kato Y, Kajiwara C, Ishige I, et al. HSP70 and HSP90 differentially regulate translocation of extracellular antigen to the cytosol for crosspresentation[J]. Autoimmune Dis, 2012:745962.
[9] Simet SM, Pavlik JA, Sisson JH. Proteomic analysis of bovine axonemes exposed to acute alcohol:role of endothelial nitric oxide synthase and heat shock protein 90 in cilia stimulation[J].Alcohol Clin Exp Res, 2013, 37(4):609-615.
[10] Morgan ED, Eunice HL, Elizabeth AS, et al. Operational plasticity enables Hsp104 to disaggregate diverse amyloid and nonamyloid clients[J]. Cell, 2012, 151:778-793.
[11] Vert G, Chory J. Crosstalk in cellular signaling:background noise or the real thing?[J]. Dev Cell, 2011, 6:985-991.
[12] Wang Y, Ding QQ, Yen CJ, et al. The crosstalk of mTOR/S6K1 and Hedgehog pathways[J]. Cancer Cell, 2011, 21 :374-387.
[13] Tumaneng K, Schlegelmilch K, Russell RC, et al. YAP mediates crosstalk between the Hippo and PI(3)K-TOR pathways by suppressing PTEN via miR-29[J]. Nature Cell Biology, 2012,14:1322-1329.
[14] Mendoza MC, Er EE, Blenis J. The Ras-ERK and PI3K-mTOR pathways:cross-talk and compensation[J]. Trends Biochem Sci, 2011, 6:320-328.
[15] Maniati E, Bossard M, Cook N, et al. Crosstalk between the canonical NF-κB and Notch signaling pathways inhibits Pparγ expression and promotes pancreatic cancer progression in mice[J]. J Clin Invest, 2011, 121:4685-4699.
[16] Oeckinghaus A, Hayden MS, Ghosh S. Crosstalk in NF-κB signaling pathways[J]. Nature Immunology, 2011, 12 :695-708.
[17] Singh AM, Reynolds D, Cliff T, et al. Signaling network crosstalk in human pluripotent cells:a Smad2/3-regulated switch that controls the balance between self-renewal and differentiation[J]. Cell Stem Cell, 2012, 3:312-326.
[18] Hsu JM, Chen CT, Chou CK, et al. Crosstalk between Arg 1175 methylation and Tyr 1173 phosphorylation negatively modulates EGFR-mediated ERK activation[J]. Nature Cell Biology, 2012,13:174-181.

