绿豆胰蛋白酶抑制剂精氨酸活性片段衍生物的克隆表达及生物学活性研究
付荣,李宗伟,赵超,单树花,武海丽,袁琳洁,李卓玉
(山西大学 生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
胰蛋白酶抑制剂(trypsin inhibitor,TI)是指具有胰蛋白酶抑制活性的多肽或蛋白质,是一种重要的生化药物和生化试剂[1].胰蛋白酶抑制剂可以分为两种类型:Bowman-Birk类和Kunitz类.豆科植物Bowman-Birk类胰蛋白酶抑制剂能够抑制丝氨酸蛋白酶的活性,具促进人类胃肠道健康的作用[2].
创伤愈合是指遭受外力作用,组织出现离断或缺损后的恢复过程,是以细胞增殖、迁移、肉芽组织形成、胶原分泌、组织重建为特点的过程.细胞迁移是创伤修复的第一阶段.近年来,由于氧自由基在缺血性组织损伤的发病中具有重要作用,其介导的细胞损伤得到广泛关注.巯基具有抗氧化作用[3],可有效地消除自由基,从而抑制细胞凋亡.
绿豆胰蛋白酶抑制剂(MBTI)属于Bowman-Birk类型抑制剂,含有赖氨酸和精氨酸两个活性中心,分别位于Lys-Ser(20-21)和 Arg-Ser(47-48)[4].目前,对 MBTI的研究多聚焦在 MBTI全长片段或Lys活性片段,而对精氨酸活性片段(MBTI-Arg)研究较少.精氨酸活性片段由27个氨基酸组成,其中包含7个Cys残基,共含有三对二硫键和一个游离巯基.为了进一步了解MBTI-Arg的生物学功能,本文用化学合成方法获得该片段的编码基因,通过原核表达、亲和纯化获得目的蛋白片段.我们将该衍生物命名为Argc.并对Argc的蛋白酶抑制活性和其它生物学活性进行了初步研究.
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 E.coli DH5a、质粒pGEX-4T-1均由本室保存.
1.1.2 细胞株 SW480,SW620,MDCK、HepG2、HL7702细胞株购自武汉博士德生物公司.
1.1.3 酶及主要生化试剂 限制性核酸内切酶BamH I、XhoI、T4DNA ligase、DNA Marker为TaKaRa公司产品;RPMI-1640、DMEM培养基为Thermo公司产品;Protein Marker为上海生工生物公司产品;Glu-tathione Sepharose 4Fast Flow 为 GE Healthcare公司产品;BAPA(苯甲酰-dl-Arg-P-硝基酰替苯胺盐酸盐)为上海三杰生物技术有限公司产品;DTNB、MTT为北京索莱宝科技有限公司产品;其他化学试剂均为进口分装或国产分析纯试剂.
1.2 方法
1.2.1 MBTI-Argc片段编码基因的合成及重组表达质粒pGEX-4T-1-Argc的构建
根据文献[5]报道的MBTI-Arg片段氨基酸序列,委托大连宝生物公司合成Argc片段的编码基因(两端插入BamH I和XhoI酶切位点),经BamH I和XhoI双酶切、胶回收目的基因片段,与同样BamH I和XhoI双酶切的pGEX-4T-1载体进行连接,得到重组表达质粒pGEX-4T-1-Argc.双酶切及测序鉴定重组质粒.
1.2.2 MBTI-Argc片段蛋白的表达及纯化
将重组表达质粒pGEX-4T-1-Argc转入大肠杆菌DH5α中,筛选阳性克隆,挑取单菌落接种于5mL LB培养基中过夜培养,然后接种于1L的培养基中,37℃震荡培养至A600达到0.5时,加入IPTG至终浓度为0.5mmol/L,继续培养4h,收集菌体.用PBS缓冲液重悬菌体后超声破碎,收集上清.采用GST亲和层析法纯化上清样.将细菌裂解液上样于该亲和柱,随后用PBS(pH7.4)缓冲液清洗亲合柱,洗至紫外吸收值为0时停止洗涤.50mmol/L的 Tris-HCl(pH 8.0,10mmol/L的 GSH,)缓冲液洗脱,收集洗脱液,考马斯亮蓝法测定蛋白浓度.
1.2.3 胰蛋白酶抑制剂活力测定
以BAPA(苯甲酰-dl-Arg-P-硝基酰替苯胺盐酸盐)为底物,在3mL缓冲液(100mmol/L Tris-HCl,10 mmol/L CaCl2)中依次加入浓度为0(100μL缓冲液)、0.15mg/mL、0.5mg/mL、0.7mg/mL、1.0mg/mL的GST-Argc各100μL和40μg胰蛋白酶;同时设置对照组,加入相同浓度的GST蛋白.37℃水浴5min,迅速加入底物BAPA 17μL(150mmol/L,溶于DMSO),继续水浴10min后加入250μ体积分数为33%的乙酸终止反应.由于胰蛋白酶可催化水解BAPA,引起410nm波长吸光值升高,加入胰蛋白酶抑制剂后会抑制该反应,使吸光值减少,根据减少程度可表示抑制剂的抑制能力.
1.2.4 二硫键定量测定
自由巯基含量的测定方法见文献[6],CBB法检测待测样品的浓度,取200μL待测样品,加入4.8g尿素定容至1mL,37℃温浴4h.加入2mL Tris-Gly(86mmol/L Tris,90mmol/L glycine,4mmol/L EDTA)缓冲液,50μL DTNB(4mg/mL),5min后测定412nm吸光值.根据吸光值大小判断多肽中游离巯基的含量.根据总巯基数计算二硫键个数.
1.2.5 MTT法检测对细胞增殖影响
指数生长期的SW480、SW620、MDCK及HepG2细胞以1×104个/孔传入96孔培养板,在体积分数为5%的CO2培养箱37℃孵育24h后,加入不同浓度的融合蛋白至终浓度依次为2.0μmol/L、5.0μmol/L和10.0μmol/L.每个浓度设4个复孔,并用含相同浓度的GST蛋白的洗脱缓冲液作为对照.孵育24h后吸弃孔内液体,PBS洗涤后加入新的培养基,每孔加MTT溶液(5mg/mL)20μL,继续孵育4h后终止培养.小心弃去孔内培养上清液,每孔加150μL DMSO,振荡10min,使结晶物充分溶解.在酶联免疫检测仪上测定各孔490nm的光吸收值.
1.2.6 细胞迁移实验
将HL7702细胞以5×105~10×105个/孔密度接种到24孔板上.当细胞贴壁并形成单层细胞后,用10 μL无菌移液枪枪头垂直划线,PBS洗涤,显微镜下测量划痕直径相同的两孔分别设为实验组和对照组.实验组加入终浓度为5μmol/L的GST-Argc,对照组加入相同浓度的含GST蛋白的洗脱缓冲液.孵育24h后显微镜下测量划痕处向外爬行的距离,并对划痕宽度等距取点进行统计学分析.
1.2.7 数据统计分析
实验结果中的数据为均值±标准差,数据在图中用误差棒表示标准差,单因素分析采用Student’s t检验,*P<0.05表示具有统计学意义.***P<0.001表示差异极显著.
2 实验结果
2.1 重组表达质粒pGEX-4T-1-Argc的构建
将获得的重组表达质粒pGEX-4T-1-Argc进行BamHⅠ与XhoⅠ双酶切鉴定,获得了81bp的片段的酶切片段,与预期大小一致(图1).阳性转化子送至上海生工生物公司测序,测序结果与目的基因片段序列完全一致,表明重组表达质粒已成功构建.
2.2 GST-Argc的表达及纯化
将重组质粒pGEX-4T-1-Argc转入E.coli DH5α中,诱导表达获得 GST-Argc融合蛋白,用 Tris-glycine-SDS-PAGE检测蛋白纯度.如图2,SDS-PAGE胶经考马斯亮蓝染色脱色后显示,纯化后的蛋白呈单一蛋白条带,其分子量较GST蛋白略大.根据蛋白Marker指示,纯化蛋白分子量比25.0kDa略大,与预期理论计算分子量28.97kDa符合.

图1 重组质粒的酶切鉴定Fig.1 Identification of recombination plasmid Lane 1:pGEX-4T-1-Argc double digested by BamHⅠ+XhoⅠLane Mr:λ-EcoT 14Ⅰdigest DNA Maker
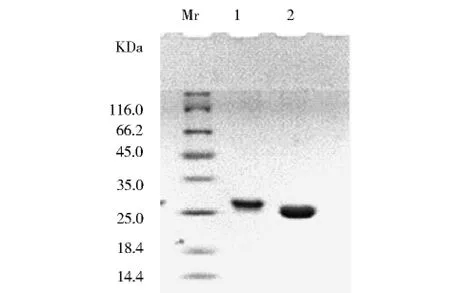
图2 GST-Argc融合蛋白的纯化Fig.2 GST-Argc purified by Glutathione Sepharose 4Fast Flow Lane Mr:Protein Molecular Weight Marker Lane1.The purified GST-Argc fusion proteinLane 2.GST protein alone
2.3 GST-Argc胰蛋白酶抑制剂活性测定
采用紫外吸收法测定活性,纯化的蛋白样品GST-Argc可与胰蛋白酶标准品反应,其胰蛋白酶抑制活力随着浓度增大有所提高,呈现一定的剂量依赖效应,但此重组蛋白表现出的胰蛋白酶抑制剂活力极其微弱(图3),3.3分子的GST-Argc对1分子胰蛋白酶活力的抑制率低于5%.
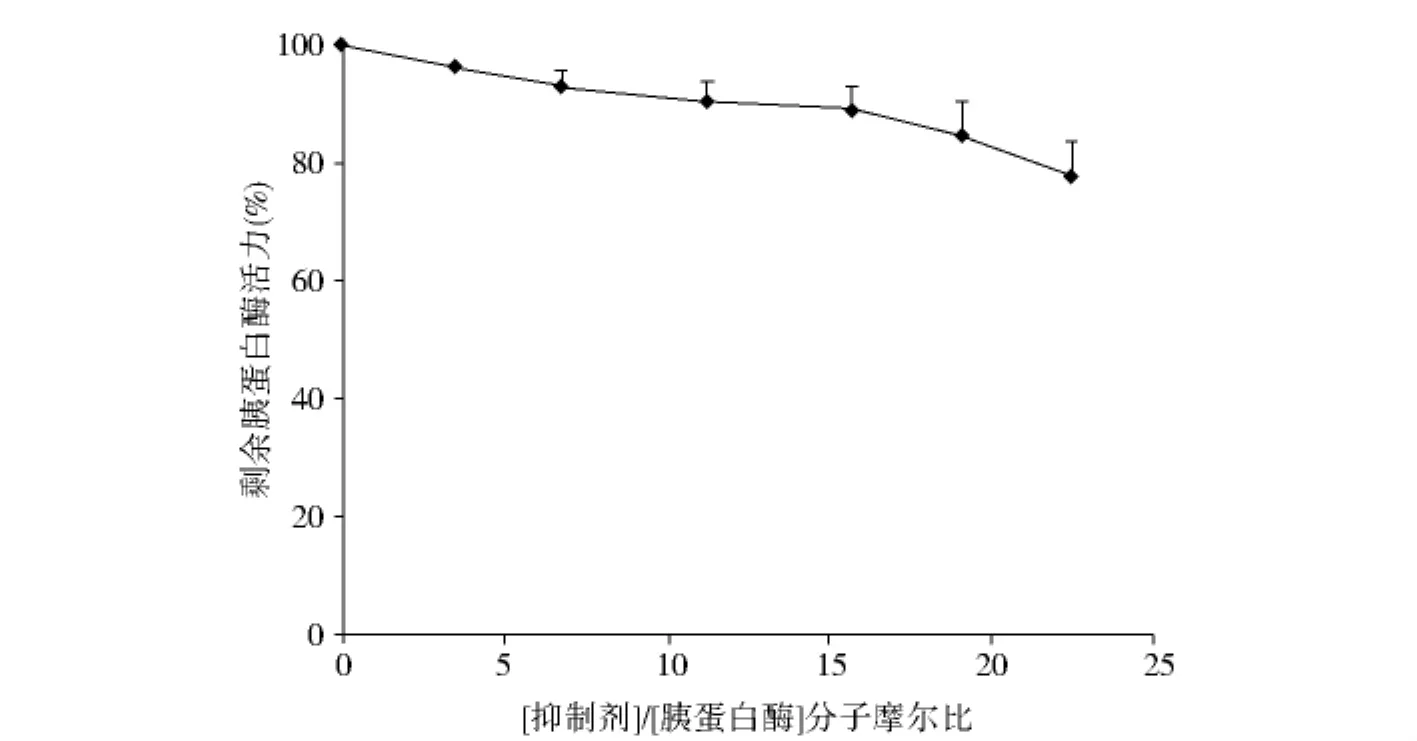
图3 融合蛋白GST-Argc胰蛋白酶抑制剂活力测定Fig.3 Inhibitory curves of fusion protein against bovine trypsin
2.4 二硫键定量结果
采用DTNB法检测GST-Argc自由巯基含量,计算其二硫键个数.结果显示,与天然产物相比,GSTArgc的二硫键个数由3对变为2对.
计算方法[6]:

式中:A412:412nm 处的吸光值;D:稀释倍数;C:蛋白浓度(mg/mL).
由以上公式得μmol/L SH/g(GST-Argc)=105.62(对照GST蛋白无吸光度值),游离SH 数=105.62·M/106=3.06(M:GST-Argc相对分子量),二硫键对数=[7+4(总巯基数)-3.06(游离巯基数)]/2=4,GST蛋白含有2对二硫键,因此Argc二硫键对数为4-2=2.
2.5 MTT实验结果
上述结果表明该精氨酸衍生片段基本丧失胰蛋白酶抑制剂活性,且其结构发生变化.因此,对其进行其他生物学活性检测.图4为MTT法检测GST-Argc对MDCK、SW480、SW620及HepG2细胞增殖的影响.结果表明:GST-Argc能够明显的促进细胞增殖,并且呈现良好的量效关系.随着药物浓度(0、2.0、5.0、10.0 μmol/L)的增加,促增殖率依次增加(MDCK细胞10.0μmol/L剂量除外).四种细胞中,GST-Argc(0~5.0 μmol/L间)对于MDCK促进效率最大,但当浓度达到10.0μmol/L时MDCK细胞增殖有所下降.在GSTArgc 5.0μmol/L浓度时,MDCK细胞促增殖率为1.2倍,SW620细胞促增殖率为0.7,SW480约为0.5,而对肝癌细胞HepG2的促增殖率最低,仅在对照基础上促进了0.2.
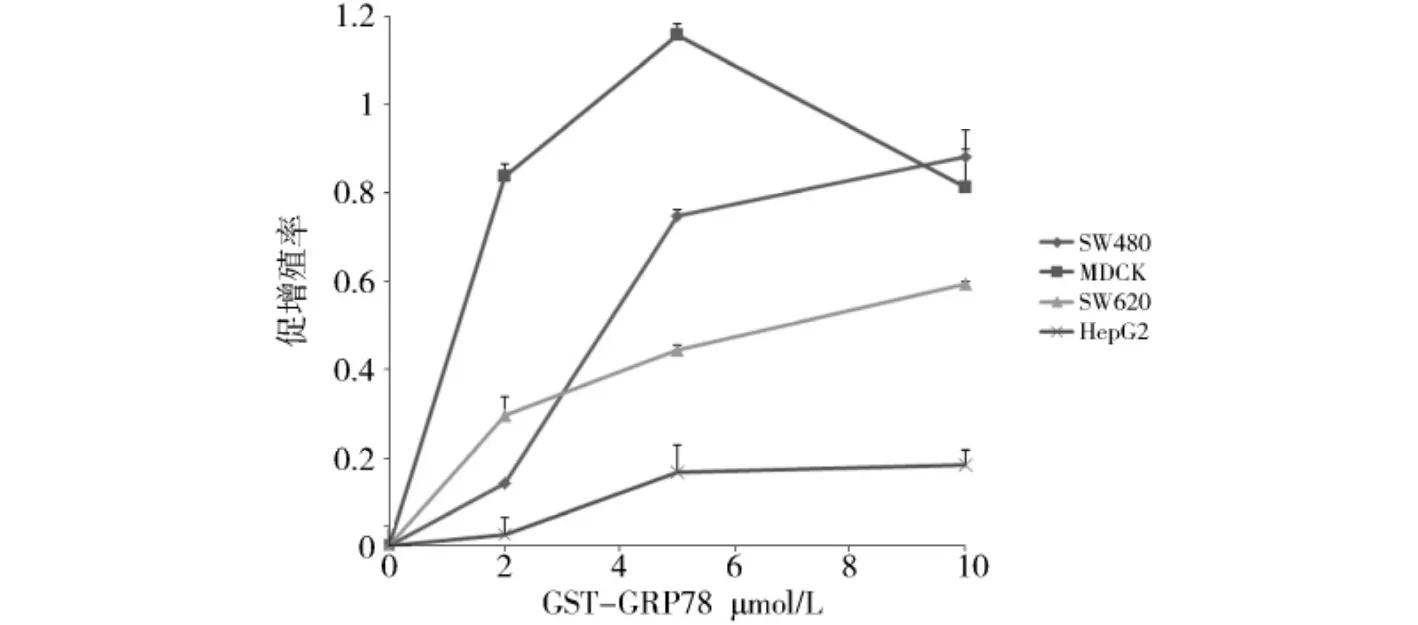
图4 GST-Argc对细胞增殖的影响Fig.4 Effects of GST-Argc on cell proliferation
2.6 细胞迁移实验结果
GST-Argc对几种细胞具有不同程度的促增殖作用,那么它对细胞的创伤愈合、迁移是否也有影响?为此,采用细胞划痕实验检测它对HL7702细胞创伤愈合及迁移的影响.如图5A(P106),与对照相比,GSTArgc在24h就能够明显的促进HL7702细胞的迁移.在0h,对照及实验组划痕宽度均约为17.3μm,而在迁移24h后,未处理细胞划痕的宽度变为10μm,而用GST-Argc处理后的细胞划痕由17.3μm缩小到约5 μm.图5B表示的分别为对照GST蛋白及GST-Argc蛋白在0h和24h时划痕宽度的差距,处理前两组间划痕宽度无显著性差异,处理24h后,实验组明显比对照组迁移更快,划痕宽度差达到4.3μm,表明GSTArgc具有促进细胞迁移的作用.
3 讨论
MBTI具有赖氨酸和精氨酸两个活性中心.研究已经发现,来自MBTI的赖氨酸活性中心具有较强的胰蛋白酶抑制剂活性,1.3分子的赖氨酸活性片段即可完全抑制1分子的胰蛋白酶的活力[7].本研究构建的Argc片段,由于结构变化致使其胰蛋白酶抑制剂活性基本丧失,3.3分子该片段对1分子胰蛋白酶活力的抑制率不足5%.
Argc衍生片段几乎不具胰蛋白酶抑制剂活性,已知该蛋白含有丰富的巯基,巯基是非常活泼的基团,具有抗氧化作用,它可以与活性氧自由基结合,降低其毒性作用,并对氧自由基引起的细胞损伤起防御作用.巯基水平下降是诱导细胞凋亡的重要因素.通过对该蛋白进行二硫键定量,发现Argc只含有2对二硫键,与天然产物中Arg片段所含有二硫键数目相比,由原来的3对二硫键减少为2对.已知该活性片段总的巯基数不变,但形成的二硫键个数减少,也就意味着自由巯基数的增加,游离的自由巯基可能对细胞的某些生理效应具有影响.
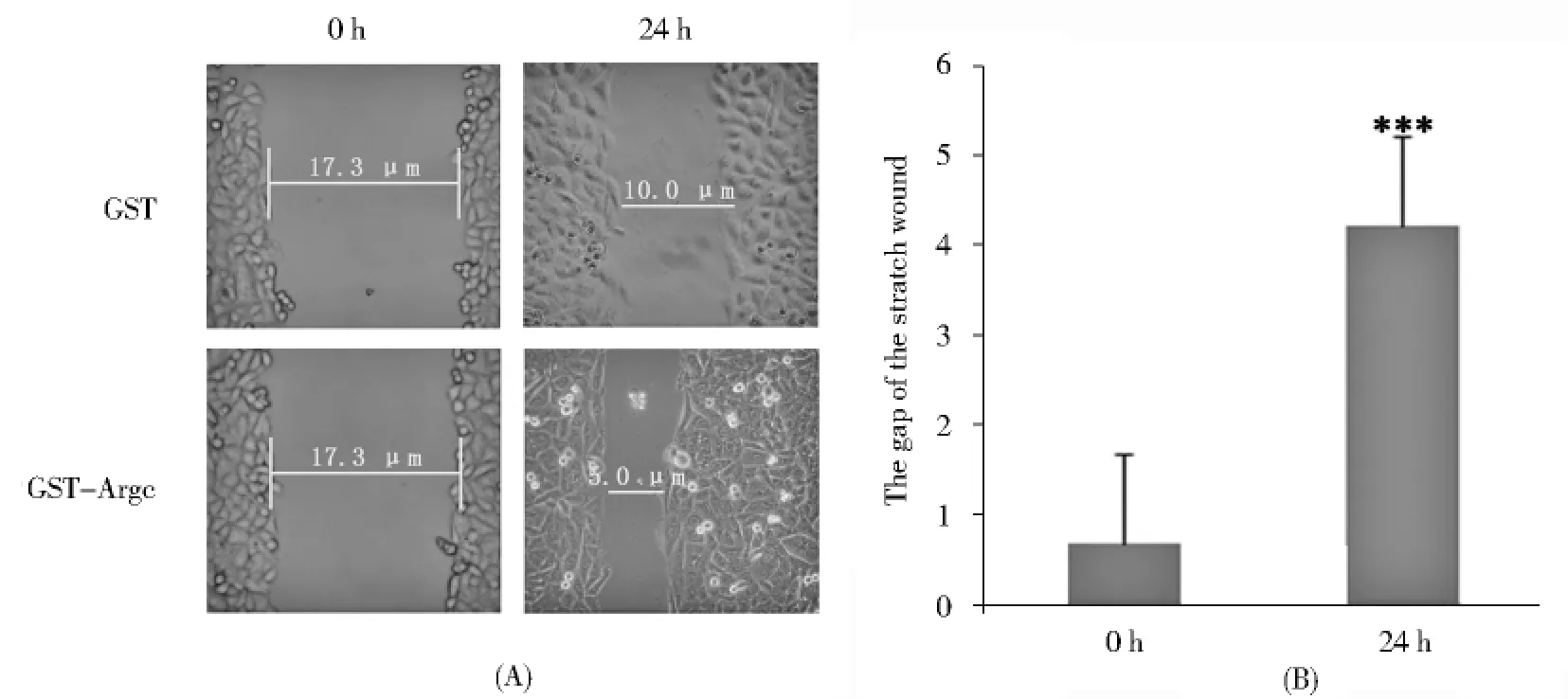
图5 GST-Argc对细胞HL7702伤口愈合的影响Fig.5 Effects of GST-Argc on cell HL7702wound healing
已知有些蛋白酶抑制剂能够有效的抑制肿瘤细胞的侵袭和转移[8-10].本研究发现MBTI-Argc无论对正常细胞MDCK,还是癌细胞SW480、SW620、HepG2均表现出促细胞生长的效应,但它对正常细胞的促进作用明显大于癌细胞.研究还表明,该衍生物对SW480、SW620、HepG2细胞增殖作用具剂量依赖性.研究结果显示,10μmol/L Argc对MDCK细胞的促增殖效应较5μmol/L的剂量有所降低,究其原因可能是MDCK细胞是正常细胞,对Argc的反应较SW480、SW620、HepG2这些癌细胞更敏感,而高浓度的Argc(10 μmol/L)可能导致了MDCK细胞表面的受体发生脱敏效应.采用划痕实验检测该蛋白对HL7702细胞创伤愈合及迁移的影响,发现该衍生物具有促进细胞迁移的作用.推测其生物学效应的发挥可能是由于其构象的改变及二硫键的重组再构.Argc衍生物的这一特点与α2-巨球蛋白(α2-macroglobulin,α2-M)非常类似.全长的α2-M是血液中的一种蛋白酶抑制剂[11],当α2-M截短活化后成为α2-M*,丧失了蛋白酶抑制活性,却能够结合细胞表面的受体(如LRP和GRP78)[12],表现出促进细胞增殖和抗细胞凋亡的特性.因此,我们推测Argc可能也以类似的方式与细胞表面的受体结合,激活细胞的增殖信号通路,发挥类生长因子的作用.其细胞表面的受体以及发挥作用的机制还有待于进一步研究.
综上所述,Argc可能具有促进组织细胞损伤修复的药用潜力.本研究中的GST-Argc分子量约为28 kD,分子量较小,在体内可以避免产生过多的免疫副反应,具有较好的药物应用潜力.接下来,我们将进一步通过免疫沉淀等技术探讨该重组活性片段在细胞表面的可能受体,并对其发挥效应的分子信号通路进行探讨,为其药物学的应用奠定基础.
[1]王长良,张永忠,孙志刚.Bowman-Birk型大豆胰蛋白酶抑制剂研究进展[J].大豆科学,2007,26(5):757-761.
[2]Clemente A,Sonnante G,Domoney C.Bowman-Birk Inhibitors from Legumes and Human Gastrointestinal Health:Current Status and Perspectives[J].Curr Protein Pept Sci,2011,12(5):358-373.
[3]Patel R B,Kotha S R,Sauers L A,et al.Thiol-redox Antioxidants Protect Against Lung Vascular Endothelial Cytoskeletal Alterations Caused by Pulmonary Fibrosis Inducer,Bleomycin:Comparison Between Classical Thiol Protectant,N-acetyl-L-cysteine and Novel Thiol Antioxidant,N,N’-bis-2-mercaptoethyl Isophthalamide[J].Toxicol Mech Methods,2012.Epub ahead of print.
[4]戚正武.三种不同类型丝氨酸蛋白酶抑制剂的研究[J].自然科学进展-国家重点实验室通讯,1995,5(2):153-160.
[5]张耀时,罗珊珊,谭复隆,等.绿豆胰蛋白酶抑制剂的研究Ⅸ两活力碎片及抑制剂的一级结构[J].生物化学与生物物理学报,1981,13(4):427-431.
[6]Beveridge T,Toma S J,Nakai S.Determination of SH and S-S Group in Some Food Proteins Using Ellman’s Reagent[J].Journal of Food Science,1974,39(1):49-57.
[7]Qi R F,Liu Z X,Xu S Q,et al.Small Peptides Derived from the Lys Active Fragment of the Mung Bean Trypsin Inhibitor are Fully Active Against Trypsin[J].Febs journal,2010,277(1):224-232.
[8]Kobayashi H,Suzuki M,Kanayama N,et al.A Soybean Kunitz Trypsin Inhibitor Suppresses Ovarian Cancer cell Invasion by Blocking Urokinase Upregulation[J].Clin Exp Metastasis,2004,21(2):159-166.
[9]Yaguchi T,Muramoto M,Nakano T,et al.Urinary Trypsin Inhibitor Suppresses Migration of Malignant Mesothelioma[J].Cancer Lett,2010,288(2):214-218.
[10]Clemente A,Gee J M,Johnson I T,et al.Pea(Pisum sativumL.)Protease Inhibitors from the Bowman-Birk Class Influence the Growth of Human Colorectal Adenocarcinoma HT29Cells in Vitro[J].J Agric Food Chem,2005,53(23):8979-8986.
[11]Lindner I,Hemdan N Y,Buchold M,et al.a2-Macroglobulin Inhibits the Malignant Properties of Astrocytoma Cells by Impedingβ-Catenin Signaling[J].Cancer Res,2010,70(1):277-287.
[12]Fabrizi C,Businaro R,Lauro G M,et al.Activated a2Macroglobulin Increasesβ-Amyloid (25-35)-Induced Toxicity in LAN5Human Neuroblastoma Cells[J].Exp Neural,1999,155(2):252-259.

