长期高脂饮食对糖尿病大鼠β细胞功能的影响*
付晓昉,赵 兴
(天津市第五中心医院,天津 300450)
2型糖尿病患者除了糖代谢紊乱以外,常常合并 有其他严重的代谢紊乱,其中包括肥胖和脂质代谢异常,主要表现为血甘油三酯(TG)和游离脂肪酸(FFA)水平的升高。TG和FFA以往只被认为是主要的必需能量物质,然而近期研究提示TG和FFA在生理条件状态下,不仅仅为多种细胞提供能量,在葡萄糖刺激的胰岛素分泌中也起着重要的作用。但细胞水平的研究显示长期高TG和FFA非但不能增强葡萄糖刺激的胰岛素分泌,反而使其受损[1,2]。提示脂代谢紊乱不仅构成胰岛素抵抗的组分,也是引起β细胞功能紊乱的因素之一。长期的游离脂肪酸血症对胰岛β细胞的影响却十分复杂。基于此,本研究通过链脲佐菌素(STZ)诱导的DM大鼠高脂饮食喂养12周后,观察血脂及胰岛β细胞功能的变化。
1 材料和方法
1.1 材料 清洁级雄性Wistar大鼠[实验动物质量合格证编号 SCXK(京)2009-0004],6~8周龄,体重180~200 g。实验动物饲养于天津医科大学基础医学院卫生系毒理学教研室,实验期间动物自由进水、进食,饲以标准颗粒饲料。室内通风良好,每日12 h光照交替,相对湿度40% ~70%,室温18~22℃。
1.2 药品及试剂 链脲佐菌素(美国Sugma公司);枸橼酸、枸橼酸钠(天津市化学试剂一厂);血甘油三酯测定试剂盒(浙江东瓯生物工程有限公司);血糖测定试剂盒(北京北化康泰临床试剂有限公司);血游离脂肪酸测定试剂盒(南京建成生物工程研究所);胰岛素放射免疫分析药盒(北京北方生物技术研究所)。
1.3 仪器设备 TN-100B型托盘扭力天平(上海第二天平仪器厂);半自动生化分析仪(荷兰 Vital Scientific公司);GC-1200γ放射免疫计数器(南昌新长征医疗科技发展有限公司);D8982-33型水纯化系统(美国Bamstead公司);恒温水浴箱(上海医疗器械厂);液氮罐、37℃水浴箱、37℃恒温箱、加样器、离心管、立式电热压力蒸汽灭菌器。
1.4 方法
1.4.1 STZ诱导的DM大鼠模型的建立与分组 造模前夜,24只大鼠自由进食、水。实验当日称重后,将大鼠置于鼠盒中,酒精棉球擦拭大鼠尾部使静脉暴露,按35 mg/kg的剂量尾静脉注射链脲佐菌素(溶于0.1 mol/L柠檬酸缓冲液,pH 4.4)建立糖尿病大鼠模型。注射7 d后,尾取血测基础血糖≥7.0 mmol/L,糖负荷后2 h血糖≥11.1 mmol/L者为DM大鼠。DM大鼠随机分为糖尿病正常饮食组(B组8只)和糖尿病高脂饮食组(C组8只)。随机选择8只正常大鼠为正常对照组(A组)。A组和B组给予正常饮食(总热量14 kJ/g,脂肪9%),C组给予高脂饮食(总热量20 kJ/g,脂肪占45%)。
1.4.2 标本的收集与处理 12周后大鼠禁食过夜12 h,动物以3%戊巴比妥钠 (80 mg/kg)腹腔麻醉,腹主动脉取血分离血清待测,留取胰尾组织,留有部分脾脏以定位,液氮保存。
1.4.3 血TG和FFA测定 血甘油三酯(TG)采用GPO-PAP乙酰丙酮法,血糖用葡萄糖糖化酶法,血游离脂肪酸(FFA)采用铜显色法测定。
1.4.4 胰岛内胰岛素的抽提和测定 参照Zhou and Grill等[3]酸乙醇法提取胰岛内的胰岛素,放射免疫方法测定胰岛素含量。
1.4.5 口服葡萄糖耐量试验 大鼠处死前3 h,50%葡萄糖按照2 g/kg体重灌胃,分别于葡萄糖负荷前0 min,负荷后60、120 min尾静脉取血,分离血清,即日以葡萄糖氧化酶法测定葡萄糖浓度。其余血清-20℃保存,一周内放射免疫分析技术测定0 min血胰岛素浓度(批内变异系数CV<10%)。以修正的β细胞胰岛素分泌指数[MBCI:(INS×BG)/(2 hPG+1 hPG -7.0)][4]评估 β 细胞功能。
1.4.6 统计学处理 采用 SPSS 10.0软件进行数据分析,所有数值以±s表示,组间差异比较采用t检验。显著性水准为0.05。
2 结果
2.1 各组大鼠血FBG、TG和FFA比较 与A组相比,B和C组FBG明显升高(均为P<0.01),且后两组之间亦具有统计学差异(P<0.05)。与A组相比,B和C组血TG(均P <0.01)和 FFA(均 P <0.01)均明显增高,且C组增高更明显(与B组相比,TG和FFA均 P <0.01)。见表1。
2.2 胰岛内胰岛素含量比较 B组和C组胰岛素含量明显低于A组(均P<0.01),C组胰岛素含量较B组进一步降低,为B组的47.1%(P<0.01)。见表2。
表1 各组大鼠血糖、血脂比较(±s)
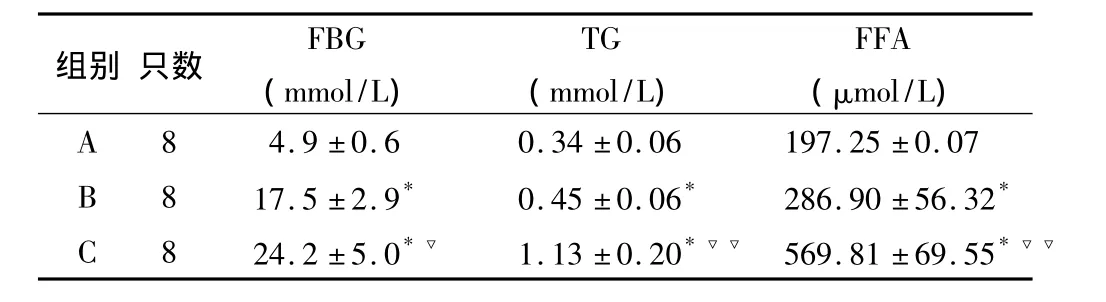
表1 各组大鼠血糖、血脂比较(±s)
与 A组相比,*P <0.01;与 B 组相比,▽ P <0.05,▽▽ P <0.01
组别 只数 FBG(mmol/L)TG(mmol/L)FFA(μmol/L)A 8 4.9 ±0.6 0.34 ±0.06 197.25 ±0.07 B 8 17.5 ±2.9* 0.45 ±0.06* 286.90 ±56.32*C 8 24.2 ±5.0*▽ 1.13 ±0.20*▽▽ 569.81 ±69.55*▽▽
表2 各组胰岛细胞内胰岛素含量比较(±s)
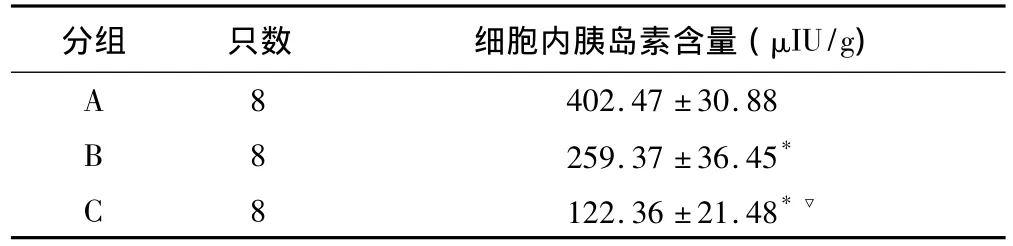
表2 各组胰岛细胞内胰岛素含量比较(±s)
与 A组相比,*P <0.01;与 B 组相比,▽ P <0.01
分组 只数 细胞内胰岛素含量(μIU/g)A 402.47 ±30.88 B 8 259.37 ±36.45*8 C 8122.36 ±21.48*▽
2.3 各组大鼠MBCI的比较 B组和C组MBCI显著低于A组,分别为A组的76.5%(P<0.05)和39.3%(P<0.01);而 C组的MBCI较B组进一步下降了37.7%(P <0.01)。见表3。
表3 各组大鼠MBCI比较(±s)
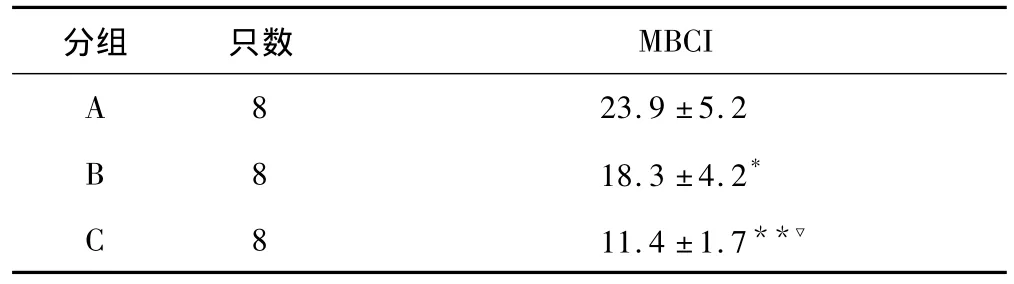
表3 各组大鼠MBCI比较(±s)
与 A 组相比,*P <0.05,** P<0.01;与B 组相比,▽P <0.01
分组 只数MBCI A 23.9 ±5.2 B 8 18.3 ±4.2*8 C 811.4 ±1.7**▽
3 讨论
研究表明脂代谢紊乱不仅仅是DM的一个并发症,对疾病发生和发展也起着重要的作用。血脂升高对糖尿病患者产生多种危害,如影响胰岛β细胞分泌功能,加重胰岛素抵抗,促进心脑血管并发症和糖尿病肾病等的发生和发展。长期的游离脂肪酸血症对胰岛β细胞的影响十分复杂。胰岛β细胞长期在游离脂肪酸的环境中,其原有的葡萄糖刺激的分泌胰岛素功能就会下降,胰岛素原的合成减少,胰岛素的储备也降低[5]。本实验采用小剂量STZ尾静脉注射的方法制成DM大鼠模型,观察给予长期高脂饮食对胰岛β细胞功能的影响。
在细胞内FFA和葡萄糖的代谢是相互影响的,有研究显示,FFA的代谢方式主要取决于葡萄糖浓度。生理状态下,FFA通过β氧化途径供能;但在高糖环境下,FFA则优先进入非氧化代谢途径,合成大量的TG和二酯酰甘油(DAG)等,导致β细胞过多的脂质沉积,可能影响β细胞胰岛素分泌。本实验观察到,与正常对照组相比,糖尿病组大鼠血TG和FFA水平增高,而高脂饮食组的糖尿病大鼠TG和FFA进一步升高。在糖尿病组大鼠血TG和FFA水平增高的同时,β细胞分泌功能受损,而以高脂饮食喂养的糖尿病大鼠表现更为显著。血TG和FFA水平升高损伤胰岛素分泌功能的机制可能在于两者促进TG在β细胞沉积所致,即脂毒性。有研究显示,在胰岛素分泌严重受损的糖尿病大鼠的β细胞内,TG水平升高可达50~100倍,当糖尿病的症状逆转后,胰岛细胞内TG的积聚减少。FFA促进胰岛细胞内软脂酸的酯化作用,增加3-磷酸甘油酰基转移酶(GPAT)的活性和的mRNA的表达[6]。亦有研究显示在高糖环境下,使CPT-1活性受抑制,进而导致脂酰-CoA在细胞浆中大量的蓄积[7]。FFA和TG在β细胞内的堆积超过了组织的利用能力,进而产生毒性作用,影响胰岛素的表达[8,9]。在本实验中观察到糖尿病高脂饮食组的胰岛内胰岛素含量较正常组明显降低,进一步证实此观点。β细胞过多的FFA除影响胰岛素分泌外,亦能促进其凋亡[10],另外还可合成大量的神经酰胺,后者亦可引起β 细胞功能障碍[11]。
本研究通过长期高脂饮食喂养诱导的DM大鼠,观察到TG和FFA与胰岛内胰岛素含量与β细胞功能的关系。长期高脂喂养的糖尿病大鼠在血TG和FFA升高的同时,β细胞内胰岛素含量减少,分泌功能显著下降。此结果提示在临床上降低TG和FFA含量可能有益于β细胞分泌功能的恢复。
1 Chen N G,Reaven G M.Fatty acid inhibition of glucose stimulated insulin secretion is enhanced in pancreatic islets from insulin resistant rats[J].Metabolism,1999,48(10):1317
2 Kelpe C L,Johnson L M,Poitout V.Increasing triglyceride synthesis inhibits glucose-induced insulin secretion in isolated rat islets of langerhans:a study using adenoviral expression of diacylglycerol acyltransferase[J].Endocrinology,2002,143(9):3326
3 Kathrin Maedler,Jose Oberholzer,Pascal Bucher,et al.Monounsaturated fatty acids prevent the deleterious effects of palmitate and high glucose on human pancreaticβ - Cell turnover and function[J].Diabetes,2003,52(3):726
4 李光伟,杨文英,姜亚云,等.以(FINS FPG)/(PG2h+PG1h-2FPG)评估胰岛β细胞分泌功能的可行性探讨[J].中华内科杂志,2000,39(4):234
5 J D McGarry,R L Dobbins.Fatty acid,lipotoxicity and insulin secret ion[J].Diabetologia,1999,42(2):128
6 Lee Y,Hirose H,Zhou Y T,et al.Increased lipogenic capacity of the islets of obese rats:a role in the pathogenesis of NIDDM[J].Diabetes,1997,46(3):408
7 Roduit R,Morin J,Masse F,et al.Glucose down - regulates the expression of the peroxisome proliferator-activeted receptor-αgene in the pancreatic β - cell[J].J Biol Chem,2000,275(46):35799
8 S Jacqueminet,I Briaud,C Rouault,et al.Inhibition of insulin gene expression by long-term exposure of pancreaticβcell to palmitate is dependent on the presence of a stimulatory glucose concentration[J].Metabolism,2000,49(4):532
9 Harmon J S,Gleason C E,Tanaka Y,et al.In vivo prevention of hyperglycemia also prevents glucotoxic effects on PDX-1 and insulin gene expression[J].Diabetes,1999,48(10):1995
10 Liang H,Zhong Y,Zhou S,et al.Palmitic acid-induced apoptosis in pancreatic β-cells is increased by liver X receptor agonist and attenuated by eicosapentaenoate[J].In Vivo,2011,25(5):711
11 Lang F,Ullrich S,Gulbins E,Ceramide formation as a target in betacell survival and function[J].Expert Opin Ther Targets,2011,15(9):1061

