AGTR1基因多态性与糖尿病肾病易感性相关
尹雪瑶,李 红,宣君丽,陈怡馨,李 霖,董雪红
(浙江大学医学院附属邵逸夫医院内分泌科浙江省生物治疗重点实验室,浙江杭州 310016)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最主要的微血管并发症之一,也是终末期肾病(end stage renal disease,ESRD)发病的主要原因,但其发病机制尚未明了。现有研究表明,DN可能是遗传因素和环境因素等综合作用的结果。肾素-血管紧张素系统(renninsystem,RAS)被认为在糖尿病肾病发生过程中起重要作用,Ⅰ型血管紧张素Ⅱ受体(angiotensinⅡtypeⅠreceptor,AGTR1)介导了血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)的主要生物学效应,因而AGTR1基因一直是糖尿病肾病研究的热点。本研究运用聚合酶链反应-限制性片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)技术研究AGTR1 A1166C基因多态性在正常对照组、2型糖尿病非肾病组及糖尿病肾病组中分布频率,以探讨AGTR1基因与2型糖尿病及糖尿病肾病的相关性。
1 研究对象和方法
1.1 研究对象 研究对象均为浙江省杭州市社区居民,汉族,彼此间无血缘关系。均签署知情同意书。
1.1.1 糖尿病组 据1999年WHO糖尿病诊断和分型标准,入选2型糖尿病患者293例,发病年龄>35岁。根据尿白蛋白/肌酐比值(A/C比值)分为两组,糖尿病非肾病组:A/C比值<30 mg/g肌酐,共141例,其中男性73例,女性68例,病程≥10年,年龄(52.99±5.39)岁,未服用血管紧张素转换酶抑制剂血管紧张素Ⅱ受体拮抗剂(ACEIARB)药物;糖尿病肾病组:6个月内连续3次晨尿检查有2次A/C比值≥30 mg/g肌酐,共152例,其中,男性65例,女性87例,年龄(69.63±7.64)岁。糖尿病肾病组中微量白蛋白尿(30 mg/g肌酐≤A/C比值<300 mg/g肌酐)109例,大量白蛋白尿(A/C比值≥300 mg/g肌酐)43例。所有患者临床排除原发肾脏疾病、结缔组织疾病、泌尿系感染、糖尿病急性代谢并发症、急慢性感染、肝脏疾病、心力衰竭等。
按照改良的 MDRD公式[1]计算肾小球滤过率(glomerular filtration rate,eGFR),并根据eGFR将糖尿病患者分为两组,eGFR下降组:eGFR<60 ml/(min/1.73 m2)共90例;eGFR 正常组:eGFR≥60 ml/(min/1.73 m2)共203例。
1.1.2 正常对照组 体检健康者,无糖尿病、高血压及肾脏疾病家族史,且葡萄糖耐量试验排除糖尿病和糖调节异常,共157例,其中,男性65 例,女性92 例,年龄(68.21 ±9.69)岁。
1.2 研究方法
1.2.1 临床和生化检查 测晨8:00~9:00时坐位测量右上臂肱动脉收缩压(SBP)和舒张压(DBP)3次,取其平均值。测量腰围、身高、体重,根据BMI=体重/身高2(kg/m2)计算体质指数。取空腹静脉血测定血清肌酐(Scr)、尿素氮(BUN)、空腹血糖(FPG)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-c)、高密度脂蛋白胆固醇(HDL-c),糖化血红蛋白(HbA1c)。留取晨尿,测定尿白蛋白和肌酐,通过免疫散射比浊法测定尿白蛋白,并计算A/C比值。
1.2.2 AGTR1基因多态性的检测 按照DNA提取试剂盒操作方法提取外周血DNA,引物参照Doria等[2]的设计,由上海Invotrogen公司合成。引物1:5'-CAC CAT GTT TTG AGG TT-3',引物 2:5'-CGA GTT TCT GAC ATT GTT C-3。以PCR扩增目的基因,反应步骤:95℃预变性10 min,95℃变性 30 s,58 ℃退火 30 s,72℃延伸 30 s,共循环30次,72℃终末循环10 min,最后置于4℃终止反应。A1166C变异导致DdeⅠ限制性内切酶切位点的出现。PCR产物用DdeⅠ于37℃酶切4 h。2%琼脂糖凝胶电泳(恒压120 V+电泳液为1×TAE),紫外灯下观察结果。
PCR扩增产物为AGTR13'端非编码区5'末端1058~1331 bp之间274 bp的DNA。扩增产物中无A1166C突变切点则为274 bp片段,若扩增片段中存在A-C碱基替换则产生DdeⅠ切点,经酶切后产生165 bp和109 bp的片段。AA基因型只有一条274 bp片段,CC基因型含有165 bp和109 bp 2条片段,含有以上3条片段的为AC杂合基因型(图1)。选取部分样本PCR后测序,鉴定基因型与酶切结果(图2)。

图1 AGTR1基因型DdeⅠ酶切电泳结果Fig.1 Result of genotypes of AGTR1 gene detected by DdeⅠdigestion

图2 AGTR1基因型测序结果Fig.2 Result of AGTR1 genotype sequencing
2 结果
2.1 各组间临床和生化指标的比较 与正常对照组比较,糖尿病非肾病组年龄、男性比例、腰围、BMI、SBP、Scr、FPG、LDL-c、HbA1c、A/C比值均高于正常对照组,TC值低于正常对照组,差异具有统计学意义(P<0.05);糖尿病肾病组年龄、BMI、SBP、DBP、FPG、TG、LDL-c、HbA1c、A/C比值均显著高于正常对照组,差异有统计学意义(P<0.05);而糖尿病肾病组与糖尿病非肾病组比较,糖尿病肾病组BMI、TG、A/C比值显著高于糖尿病非肾病组,差异具有统计学意义(P<0.05)。结果见表1和表2。

表1 正常对照组、糖尿病非肾病组和糖尿病肾病组的临床资料Table 1 Clinical data of the normal controls,simple diabetes and diabetic nephropathy groups

表2 正常对照组、糖尿病非肾病组和糖尿病肾病组的生化指标Table 2 Laboratory data of the normal controls,simple diabetes and diabetic nephropathy groups
2.2 各组AGTR1 A1166C变异分布频率 表3示正常对照组、糖尿病非肾病组和糖尿病肾病组等位基因分布情况,各组研究对象基因型分布符合Hardy-Weinberg平衡(P>0.05)。在正常对照组、糖尿病非肾病组、糖尿病肾病组A和C等位基因的分布频率分别为 96.5%、97.2%、92.8% 和 3.5%、2.8%、7.2%。其中,糖尿病肾病组C等位基因频率明显高于正常对照组(χ2=4.26,P < 0.05)和糖尿病非肾病组(χ2=5.83,P <0.05),而糖尿病非肾病组和正常对照组等位基因分布未见明显差异(χ2=0.21,P >0.05)。ACCC 基因型频率在糖尿病肾病组与正常对照组或糖尿病非肾病组间存在统计学差异(χ2=3.86,P <0.05 或 χ2=5.44,P<0.05)。
糖尿病肾病组中的微量白蛋白尿组和大量白蛋白尿组A等位基因和C等位基因分布频率分别为 91.3%、96.5% 和 8.7%、3.5%。两组间等位基因及基因型频率比较无统计学意义(χ2=2.355,P >0.05 和 χ2=2.51,P >0.05),见表4。
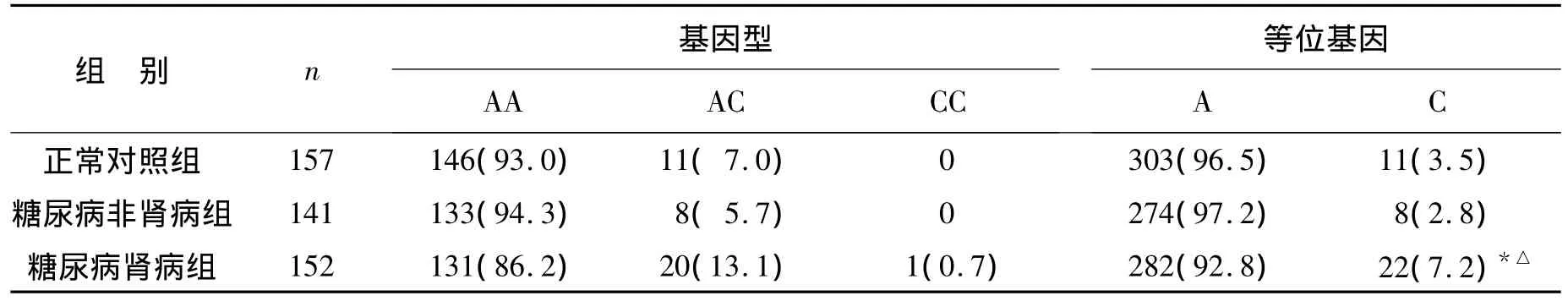
表3 正常对照组、糖尿病非肾病组和糖尿病肾病组的基因型和等位基因分布Table 3 Distribution of genotypes and allele frequency in normal controls,simple diabetes and diabetic nephropathy groups [n(%)]

表4 微量白蛋白尿组和大量白蛋白尿组基因型和等位基因分布Table 4 Distribution of genotypes and allele frequency in microalbuminuria and proteinuria groups[n(%)]
2.3 糖尿病患者肾病和非肾病组及eGFR正常和下降组Logistic回归分析 以糖尿病患者是否发生肾病为分类变量,以年龄、性别、腰围、BMI、SBP、DBP、FPG、TG、TC、LDL、HDL、HbA1c和AGTR1 A1166C基因型为自变量进行Logistic回归分析,经逐步选择表明,高 BMI、DBP、TG和AGTR1ACCC基因型为糖尿病发生肾病的独立危险因素,ACCC基因型与AA基因型相比对,糖尿病肾病比值比(OR)为2.672(95%CI:1.170 ~ 6.104),用 Logistic 回归校 正 后 OR 为 3.184(95%CI:1.277 ~7.934),见表5。
以糖尿病患者是否发生eGFR下降为分类变量,以年龄、性别、病程、腰围、BMI、SBP、DBP、FPG、TG、TC、LDL、HDL、HbA1c、A/C 和AGTR1基因型为自变量进行Logistic回归分析,经逐步选择表明,男性、高TG和A/C为糖尿病患者发生eGFR下降的独立危险因素,而AGTR1 A1166C基因型未进入方程(表5)。

表5 糖尿病患者肾病和非肾病组及eGFR正常和下降组Logistic回归分析Table 5 Logistic regression analysis in simple diabetes and diabetic nephropathy groups,and eGFR normal and low groups
3 讨论
肾素-血管紧张素-醛固酮系统(reninangiotensin-aldosterone system,RAAS)内的基因一直被认为是糖尿病肾病的重要候选基因。因为该系统对于全身和肾脏内的血液动力学具有明显的调控作用。在糖尿病患者中AngⅡ对于组织的损害,除了通过激活血管紧张素受体和下游的通路,还可通过与其他经典的高血糖诱导的病理生理途径的相互作用(如氧化应激,糖基化终末产物,蛋白激酶C、多元醇途径,己糖胺途径)发挥作用[3-4]。
改善血糖和控制血压,以及应用RAAS抑制剂后可明显延缓糖尿病肾病的发生,但仍有相当数量的糖尿病患者虽血糖控制良好仍进展为糖尿病肾病,这表明糖尿病肾病的发生发展存在着个体易感性[5]。大量的研究表明基因背景决定了糖尿病患者进展为糖尿病肾病的风险,无论是蛋白尿或肾小球损伤的程度,及患者的药物治疗效果都存在着明显的家族聚集性[6]。
人类AGTR1基因位于3q21-25,仅含1个外显子,无内含子区域。A1166C位于3'端非编码区域,不编码蛋白质,可能通过调控转录和翻译发挥作用。关于AGTR1 A1166C基因多态性和糖尿病肾病关系的研究结果并不尽一致。Doria等[2]发现,C等位基因同血糖控制不佳的糖尿病患者肾病的发生相关,而Tomino等[7]对于日本2型糖尿病妇女的研究也发现,C等位基因与糖尿病肾病的进展相关。在体外C等位基因还可介导AngⅡ的作用增强[8]。Chowdhury等[9]的研究却并未发现 A1166C与糖尿病肾病的发生相关。另外有研究发现,AA基因型与非糖尿病患者的肾病的迅速发展相关[10]。
本研究以社区人群为研究对象,可使基因型更符合人群中的分布,再者,糖尿病非肾病组筛选病程≥10年,而且为未服用ACEIARB类药物的2型糖尿患者,可排除短病程、药物等因素对于该组患者尿蛋白排泄的影响,使结果更可靠。但是,由于36.18%糖尿病肾病患者服用ACEIARB类药物,该类药物对糖尿病肾病组患者肾功能和尿蛋白的影响未能完全排除。另外,由于大量白蛋白尿组样本量较小,也可能掩盖了基因多态性对于糖尿病肾病进展的影响。
本研究显示,糖尿病肾病组C等位基因的频率显著高于正常对照组和糖尿病非肾病组,而正常对照组和糖尿病非肾病组间未见统计学差异,表明AGTR1基因是糖尿病肾病的易感基因(OR=2.672,95%CI:1.170 ~6.104),而非糖尿病易感基因。经Logistic回归分析表明高BMI、DBP、TG和AGTR1基因型中 C等位基因为糖尿病肾病独立风险因素,该研究结果与国内外研究结果相一致[11]。但由于基因作用的复杂性,AGTR1 A1166C参与糖尿病肾病的发生分子机制仍有待进一步的研究。
总之,本研究发现AGTR1 A1166C基因多态性和糖尿病肾病的易感性相关。对于糖尿病肾病易感基因的深入研究,将有助于糖尿病肾病高危患者的早期筛查、靶向治疗及发现新的治疗靶点。此外,不同基因型的患者对药物也有不同的反应[12],进一步的研究对于指导临床用药也具有重要的意义。
[1]MA Y C,ZUO L,CHEN J H,et al.Modified glomerular filtration rate estimating equation for Chinese patients with chronic kidney disease[J].J Am Soc Nephrol,2006,17(10):2937-2944.
[2]DORIA A,ONUMA T,WARRAM J H,et al.Synergistic effect of angiotensin II type 1 receptor genotype and poor glycaemic control on risk of nephropathy in IDDM [J].Diabetologia,1997,40(11):1293-1299.
[3]STECKELINGS U M,ROMPE F,KASCHINA E,et al.The evolving story of the RAAS in hypertension,diabetes and CV disease:moving from macrovascular to microvascular targets [J].Fundam Clin Pharmacol,2009,23(6):693-703.
[4]LI Hong(李 红).Pathogenesis and therapeutic targets in diabetic microangiopathy[J].Journal of Zhejiang University:Medical Sciences(浙江大学学报:医学版),2006,35(3):233-237.(in Chinese)
[5]KROLEWSKI M,EGGERS P W,WARRAM J H.Magnitude of end-stage renal disease in IDDM:a 35 year follow-up study [J].Kidney Int,1996,50(6):2041,2046.
[6]CONWAY B R,SAVAGE D A,MAXWELL A P.Identifying genes for diabetic nephropathy--current difficulties and future directions[J].Nephrol Dial Transplant,2006,21(11):3012-3017.
[7]TOMINO Y,MAKITA Y,SHIKE T,etal.Relationship between polymorphism in the angiotensinogen,angiotensin-converting enzyme or angiotensin II receptor and renal progression in Japanese NIDDM patients[J].Nephron,1999,82(2):139-144.
[8]VAN GEEL P P,PINTO Y M,VOORS A A,et al.Angiotensin IItype1 receptorA1166C gene polymorphism is associated with an increased response to angiotensin II in human arteries [J].Hypertension,2000,35(3):717-721.
[9]CHOWDHURY T A,DYER P H,KUMAR S,et al.Lack of association of angiotensin II type 1 receptor gene polymorphism with diabetic nephropathy in insulin-dependent diabetes mellitus[J].Diabet Med,1997,14(10):837-840.
[10]COLL E,CAMPOS B,GONZALEZ-NUNEZ D,et al.Association between the A1166C polymorphism of the angiotensin II receptor type 1 and progression of chronic renal insufficiency[J].J Nephrol,2003,16(3):357-364.
[11]TANG S C.Diabetic nephropathy:a global and growing threat[J].Hong Kong Med J,2010,16(4):244-245.
[12]DRAGOVIC T,AJDINOVIC B,HRVACEVIC R,et al.Angiotensin II type 1 receptor gene polymorphism could influence renoprotective response to losartan treatment in type 1 diabetic patients with high urinary albumin excretion rate[J].Vojnosanit Pregl,2010,67(4):273-278.

