过氧化氢危险性分析
王 ,马 翔 ,张淑娟 ,姜 杰 ,石 宁
(1.青岛科技大学环境与安全工程学院,山东青岛 266042;2.中石化青岛安全工程研究院;3.唐山三友集团有限公司;4.北京化工大学)
过氧化氢是一种无色透明液态无机过氧化物,由于其几乎无污染的特性广泛应用于化工、环保、建筑等行业中。高浓度过氧化氢由于具有低毒、环保、产量高等优点在化工生产中受到越来越广泛的关注。例如在环氧丙烷合成工艺中通过提高过氧化氢使用浓度来提高装置产量并减少废液排放,这是提高企业经济效益和保护环境最有效的途径。然而高浓度过氧化氢最大的缺点是本身很不稳定,在受光照射、接触金属杂质或在碱性条件下会发生剧烈分解而生成水和氧并放出热量,当放出的热量足够高时反应不可控可能导致爆炸。因此,安全问题是化工生产过程提高过氧化氢使用浓度的重要技术瓶颈。
近些年,对过氧化氢稳定性和热危险性研究越来越多,然而对其本身的危险特性定量研究却较少[1-4]。Isao Eto 等[5]研究评估了各种金属化合物对过氧化氢水溶液失控反应危害的影响。S.H.Wu等[6]采用差式扫描量热法评估了H2O2与丙酮、Fe2O3、FeSO4、H2SO4、盐酸、HNO3、H3PO4、氢氧化钠和氢氧化钾等溶剂的热危险性。葛广海等[7]通过对碱性过氧化氢稳定性研究选定了过氧化氢在碱性条件下应用的稳定剂。刘中兴等[8]以质量分数为30%的双氧水为研究对象,通过改变一些影响其稳定性的因素和条件探索其分解规律。
笔者以工业中常用浓度(H2O2质量分数为27.5%)及高浓度(H2O2质量分数为50%、70%)过氧化氢作为研究对象,运用高灵敏度C80微量量热仪对3种浓度过氧化氢的分解特性进行实验研究,研究了不同扫描速率对3种浓度过氧化氢热稳定性的影响,并计算分解活化能、绝热条件下达到最大反应速率所需时间(TMRad)等参数,以便考察不同浓度过氧化氢的热危险性,为高浓度过氧化氢在化工生产中的应用提供技术指导,对提高过氧化氢路线化工装置的产能具有重要意义。
1 实验方法
1.1 试剂及仪器
试剂:质量分数分别为27.5%、50%、70%的过氧化氢,工业级。
仪器:C80微量量热仪。其测试精度高、敏感度高,且实验所用试样量大,测得的数据较为准确、可信,结果更接近样品的本质属性。
1.2 实验方法
称取适量过氧化氢置于样品池中,参比池内装入适量惰性物质。将其置于C80微量量热仪中,并设定扫描速率分别为 0.25、0.5、1.0、1.5、2.0℃/min。根据仪器控制程序观察实际反应进程,直到实验程序完成。
2 结论与分析
2.1 微量量热仪测试结果
图1为不同扫描速率下3种浓度过氧化氢放热曲线。由图1可以看出,27.5%H2O2放热峰由低到高的扫描速率依次为 0.25、0.5、1.0、2.0 ℃/min;50%和70%H2O2放热峰由低到高的扫描速率依次为0.5、1.0、1.5、2.0℃/min。 从图 1还可以看出,3种浓度过氧化氢的放热曲线各自在某一温度区间上出现较大的放热峰,而且随着浓度和扫描速率的增大其热流的峰值增大,放热峰向后移且更加尖锐,即过氧化氢分解反应的激烈程度增加、放热集中。

图1 不同浓度H2O2随温度变化的放热曲线
通过对不同扫描速率下的放热曲线分析计算得出3种浓度过氧化氢初始放热温度、最大放热温度、放热量等特征参数,结果见表1。由表1看出,各浓度过氧化氢初始放热温度和最大放热温度都随着扫描速率的增加而升高,但单位质量放热量减小。这是因为,随着扫描速率变小仪器灵敏度升高且对微小热流的感应更敏感。根据失控反应危险等级简单评定方法可知,27.5%H2O2的危险性为 “危急的”,50%、70%H2O2的危险性为“灾难性的”,都属于高危险等级。由于高浓度过氧化氢单位质量放热量是低浓度的2~3倍,因此为尽量减少其带来的危害性,确保化工工业中过氧化氢的安全使用是极其重要的。

表1 3种浓度H2O2初始放热温度、最大放热温度、放热量等特征参数
随着C80加热炉给予样品加热,样品逐渐开始放热,热量的积累导致反应系统温度升高,反应速率也增大。通常来说,物质反应热越多系统温度越高,反应物可能越不稳定。从表1得知,不同扫描速率下各浓度过氧化氢各自的单位放热量相差并不大,且浓度越大单位质量放热量越多,表面可以判断高浓度过氧化氢危险性较大。然而,只单独考虑反应放热量时,不同扫描速率下各浓度过氧化氢分解造成的热危险程度比较接近。这里给出的放热量是整个分解过程中热流曲线的积分值,并不能单纯地用来描述分解过程中随温度变化的放热情况,因此不能用单一的分解放热量来评价过氧化氢的热危险性。
2.2 热危险性分析
2.2.1 过氧化氢活化能
过氧化氢活化能是其分子从常态转变为容易发生化学反应的活跃状态时所需要的能量,即过氧键断裂所需能量,该能量越小反应速率越快。采用等转化率法(Friedman法)计算H2O2在不同转化率下的反应活化能。
热分析曲线的动力学分析中多采用Friedman法,其是基于反应速率在相同转化率下只与温度有关这个原理,可避开反应机理而求取反应不同阶段时的活化能,也叫做“无模式函数法”[9]。
Friedman法中反应动力学方程可表示为[10-12]:

式中:α为转化率;t为时间,s;A为指前因子,(mol/L)1-n/s;Ea是表观活化能,kJ/mol;T 为反应温度,K;R 是气体常数,J/(K·mol);f(α)为反应机理函数。
两边取对数,可得其微分形式:

此时Ea不再是常数,而是转化率α的函数。
采用Friedman法处理不同浓度H2O2放热曲线见图2。

图2 不同浓度H2O2Friedman法关系图
图2中不同浓度H2O2各自的4条曲线分别为一系列扫描速率下 ln(dα/dt)α对 1000/T的关系曲线,将不同扫描速率测试的4条曲线中的同一转化率点相连接可以得到许多直线,这些直线各自的斜率即为此转化率处的-Ea/R[13]。
根据上述直线的斜率可以导出相应转化率下的活化能,绘制出Ea随转化率的曲线,见图3。从总的趋势看来,3种浓度过氧化氢[H2O2质量分数依次为27.5%、50%、70%]分解过程的活化能是按照一定规律变化的,形成一条类似二次函数的曲线,其值的范围分别为 51.05~94.30、16.40~66.72、32.50~76.15 kJ/mol。开始分解时活化能较低,随着分解反应的进行活化能迅速增大,当转化率达到0.5左右时活化能达到最大,然后逐渐减小,反应开始和终点时出现离散点。在非等温的热分析中,热分解是在一定加热速率的热场中进行的,样品自身的热传导导致样品与周围气氛之间存在着温度差,可认为样品自始至终处于一种非热平衡状态,在此情况下得到的反应机理以及反应动力学参数明显与热平衡下的理论情况存在一定的偏差。同时,随着温度的升高未分解的过氧化氢越来越少,反应速率也不断加快。

图3 Friedman法得到的不同浓度H2O2的Ea与α的关系
2.2.2 绝热条件下达到最大反应速率所需时间
TMRad是热危险性评价中的一个重要参量,它表示绝热条件下从某一温度开始到显示最大反应速率的温度所经历的时间[14],主要用来评估物质在不同温度下反应失控的可能性标准。反应失控的可能性分级标准见表 2[15]。
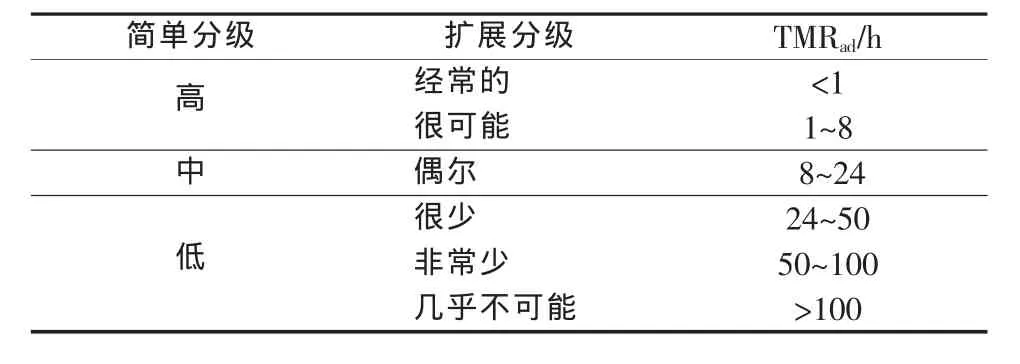
表2 反应失控的可能性分级标准
针对反应失控的可能性分级标准,以50%H2O2、TMRad=24 h为例,TMRad为24 h时对应的温度可表示为TD24,其结果如图4所示。由图4可知,TD24=20.22℃,即当 50%H2O2温度达到 20.22℃时在绝热条件下24 h后反应便达到最大反应速率,其绝热温升 ΔTad达 283.9 ℃(X=24 代表时间, 即 TMRad;Y=20.22 代表温度,即 TD24)。
表3列出了各浓度H2O2在不同初始温度下的TMRad。通常过氧化氢在环境温度下储存和使用,以夏天最高环境温度40℃考虑,由表3数据看出各浓度 H2O2TMRad分别为 26.16、6.74、5.73 h, 根据表 2分级标准判断其发生失控的风险为“很少”和“很可能”。因此,从TMRad分级标准来看低浓度过氧化氢的储存和使用在环境温度下危险性较低,高浓度危险性较高,且需要保证温度在40℃以下。加强过氧化氢储存和使用过程中的温度监控并采取相应降温散热措施对避免危害事故的发生具有重要意义。

图4 50%H2O2TD24

表3 H2O2存储温度与TMRad的关系
根据表2和表3还可以看出,过氧化氢的存储温度越低,达到最大反应速率所需时间越长,表明其危险性越小。由数据处理结果得出高浓度(50%、70%)过氧化氢绝热温升高达283.9℃和420.3℃,一旦发生失控反应会造成极大的危害性。因此,有必要在过氧化氢的储存区配置降温通风系统,以保证过氧化氢储存和使用的安全性。
3 结论
1)各浓度过氧化氢初始放热温度和最大放热温度都随着扫描速率的增加而升高,但单位质量放热量减小。2)过氧化氢分解过程中随着转化率的增加活化能呈现先增大后减小的趋势,可以预测反应机理随反应过程而变化,并不是单一反应机理,此时等转化率法更符合反应的实际进程。3)通过Friedman法得出活化能随转化率变化的曲线,得出了各浓度过氧化氢(27.5%、50%、70%)不同转化率下的活化能, 其值范围分别为 51.05~94.30、16.40~66.72、32.50~76.15 kJ/mol。4)针对反应失控的可能性分级标准可以判断在使用温度最高40℃下高浓度过氧化氢很有可能发生失控反应,有必要在过氧化氢的储存区配置散热通风系统。5)通过对各浓度过氧化氢的热危险性分析可以得出绝热放热起始温度、反应活化能、绝热最大温升速率时间等与物质热稳定性有关的参数数据,利用这些信息可以更好地进行化学动力学和热力学方面的研究,为更准确地评价物质的热稳定性提供可靠依据。
[1]林平,黄文宏,王慧君.过氧化氢生产装置爆炸—化学分解后的物理过程研究[J].中国安全生产科学技术,2008,4(3):71-74.
[2]罗乐.蒽醌法双氧水生产装置的危险性和预防措施[J].化工技术与开发,2007,36(3):39-41.
[3]毛义田.蒽醌法生产过氧化氢的安全事故分析及防范措施[J].中国氯碱,2007(7):34-37.
[4]张文兵,李晓莉,董武杰.蒽醌法制过氧化氢生产典型事故分析及防范[J].化学推进剂与高分子材料,2002(2):40-41.
[5]Isao Eto,Miyako Akiyo shi,Atsumi Miyake,et al.Hazard evaluation of runaway reaction of hydrogen peroxide-influence of contamination of variousions[J].J.Loss Prevent.Proc.,2009,22(1):15-20.
[6]Wu S H,Chi J H,Huang C C,et al.Thermal hazard analyses and incompatible reaction evaluation of hydrogen peroxide by DSC[J].J.Therm.Anal.Calorim.,2010,102(2):563-568.
[7]葛广海,王景越,庞慧敏.过氧化氢在碱性条件下的稳定性研究[J].无机盐工业,2003,35(1):19-20.
[8]刘中兴,谢传欣,石宁,等.过氧化氢溶液分解特性研究[J].齐鲁石油化工,2009,37(2):99-102,105.
[9]胡荣祖.史启祯.热分析动力学[M].北京:科学出版社,2001:24.
[10]Roduit B,Xia L,Folly P,et al.The simulation of the thermal behavior of energetic materials based on DSC and HFC signals[J].J.Therm.Anal.Calorim.,2008,93(1):143-152.
[11]Roduit B,Folly P,Berger B,et al.Evaluating SADT by advanced kinetics based simulation approach[J].J.Therm.Anal.Calorim.,2008,93(1):153-161.
[12]Roduit B,Dermaut W,Lunghi A,et al.Advanced kinetics based simulation of time to maximum rate under adiabatic conditions[J].J.Therm.Anal.Calorim.,2008,93(1):163-173.
[13]张帆,谢传欣,顾静.过氧化苯甲酰在空气中的热分解动力学研究[J].化学工程师,2010(1):23-26.
[14]施特赛尔.化工工艺的热安全-风险评估与工艺设计[M].陈网桦,彭金华,陈利平,译.北京:科学出版社,2009.
[15]王建辉.蒽醌法双氧水生产中的安全问题[J].江苏化工,2004,32(5):54-55.

