人羊膜上皮细胞对于生长因子和ORFV的敏感性研究
于永忠,王欢,谭强,赵文博,崔玉东
(黑龙江八一农垦大学生命科学技术学院,大庆163319)
人羊膜上皮细胞(Human amniotic epithelial cell,hAEC)位于羊膜的最内层,此类细胞拥有干细胞特性,在一定条件下可以向内胚层(如肝细胞)、中胚层(如心肌细胞)和外胚层(如神经细胞)等3种胚层细胞分化[1]。hAEC在治疗中枢神经障碍方面具有独特的应用价值,1996年,Sakuragawa等[2]最先发现培养的hAEC表达神经元和神经胶质细胞的标志。随后的研究表明,培养的hAEC能合成和释放神经递质如乙酰胆碱,儿茶酚胺和多巴胺。hAEC移植治疗大鼠帕金森病(PD)的实验表明其在体内不仅能存活并表达络氨酸羟化酶(TH)活性,而且可以逆转病情和防止神经元死亡。hAEC对于灵长类的脊髓损伤同样具有良好的治疗效果。目前hAEC已应用于溶酶体蓄积病、神经细胞退行性病变以及眼科疾病的治疗。hAEC已被证实具有肝细胞的某些特性和功能。Takashima等[3]在hAEC进行原代培养鉴定过程中,采用肝细胞生长因子和地塞米松等为诱导剂处理方法,使得hAEC逐步具备了分化为成熟肝细胞的潜能。
“羊口疮”(ORF)是由羊传染性脓疱皮炎病毒(ORFV)引起的一种急性、接触性的动物传染病[4],主要危害羊的口唇、蹄和外阴等部位皮肤,尤其是黏膜皮肤边缘及分泌性粘膜,导致以红斑、丘疹、水疱、脓疱和疣状痂皮为特征的病变过程。该病在破坏强度上虽然仅造成皮肤或黏膜局部增生性损伤,甚至没有系统性感染症状,但病毒能够伺机长期潜伏于宿主皮肤内并演变为持续感染和继发感染。同时,ORFV也能感染人类[5-6]。由于ORFV只感染上皮细胞,病毒对于hAEC是否敏感有待于进一步明确。实验以hAEC为对象进行适宜的原代培养,同时应用不同生长因子刺激和ORFV感染观察hAEC细胞敏感性,旨在研究ORFV与细胞相互作用特点。
1 材料与方法
1.1 试验材料
Ⅳ型胶原酶(美国Gibco公司);DMEM高糖培养液(美国Gibco公司);胎牛血清(JRH,Bioscience)(美国Gibco公司);0.25%胰蛋白酶-EDTA(美国Amresco公司);10×青-链霉素溶液(美国Gibco公司);人重组碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)(美国Gibco公司);人重组表皮生长因子(epidermal growth factor,EGF)(美国Gibco公司);ORFV毒株(OV/HLJ/04)由黑龙江八一农垦大学生命科学技术学院细胞生物学教研室保存。
1.2 方法
1.2.1 hAEC的制备及原代培养
健康的人羊膜(试验材料),来源于HIV、甲肝、乙肝及梅毒等病原物生物血清学反应阴性的产妇胎盘(经家属同意)。用预先消毒的弯头镊子先将羊膜与绒毛膜进行轻微钝性剥离,然后将羊膜放置于含双抗(青霉素100 U·mL-1、链霉素100μg·mL-1)的无菌PBS中冲洗数遍。再将漂洗后的羊膜用预先消毒的眼科剪剪成约1 mm×1 mm的组织块,随后加入0.2%的胶原酶Ⅳ于37℃下消化2.5 h;之后加入适量PBS稀释后1 000 r·min-1离心3~5 min,轻轻吸出胶原酶消化液;向沉淀中加入0.25%的胰蛋白酶消化液,37℃振荡消化30~50 min,消化后加入含胎牛血清的培养液终止消化;最后使用400目筛网过滤细胞,弃掉杂质,将滤液1 000 r·min-1离心5min,收集其中的上皮细胞,将细胞铺于细胞培养板,放置于37℃、5%CO2培养箱中培养。hAEC原代培养、传代具体方法如下:将要培养的上皮细胞利用不同成分的培养基制备成细胞悬液,细胞计数后调整为1×105个·mL-1的密度,种植于10 cm培养皿中,置于37℃、5%CO2的细胞培养箱内培养,2 d换液1次。待细胞铺满90%板底时,用预温的0.25%的胰蛋白酶37℃消化细胞2~3 min,待消化细胞大部分分离甚至脱落,用无菌PBS终止消化。收集消化好的细胞,1 000 r·min-1离心3min,弃上清。加入新的培养液,重悬细胞,再分装新的培养板,补充培养基,置于37℃、5%CO2的细胞培养箱内培养。利用倒置显微镜逐日观察不同细胞培养液中hAEC形态、生长和增殖情况,以确定最适宜hAEC原代培养的细胞培养液。
1.2.2 hAEC在EGF和bFGF环境下生长的差异性
hAEC在EGF和bFGF环境下能够加快生长速度。在培养基中,分别添加适量的EGF和bFGF,并已基本培养基作为对照,验证两种不同细胞因子对于hAEC生长影响的差异性。hAEC培养液配制:将10 cm培养板分3组:组1,培养液内添加90%DMEM、10%胎牛血清、40 ng·mL-1的EGF;组2,培养液为90%DMEM、10%胎牛血清、10 ng·mL-1bFGF;组3,对照组,培养液为90%DMEM、10%胎牛血清。具体如表1所示。

表1 hAEC培养基不同组分Table1 Medium with different components for hAEC
1.2.3 hAEC生长曲线测定
原代细胞培养传代稳定后,取传代hAEC单细胞悬液(1×105个·mL-1)均匀接种于7块96孔板中,每块板设置3组,每组接种5个小孔 ,培养基使用量为每孔200μL,然后放于37℃、5%CO2培养箱中培养;从接种细胞的第2 d起每天取一块板检测,检测前加入4mg·mL-1的MTT液(每孔50μL)继续培养4 h,之后吸弃小孔内培养液,加入DMSO液(每孔150μL),再将培养板置于微孔板振荡器上震荡约10 min,使结晶物溶解;利用酶标仪检测各孔检测OD570nm值,计算各时相点吸光度的平均值,记录结果。在绘制细胞生长曲线时,将横坐标设定为时间(d),纵坐标设定为吸光度(表示细胞相对数量)OD570nm值。
1.2.4 hAEC的ORFV感染实验
将10-5TCID50的ORFV按照不同的稀释浓度分别加入到24孔细胞培养板中,未接毒的设为阴性对照。病毒稀释比例为1∶1、1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640等8个梯度。96孔板每孔加入病毒稀释液10μL。接毒后,将细胞板放于37℃,5%CO2培养箱中培养,做好细胞病变观察记录。
2 结果
2.1 hAEC的制备及原代培养结果
在倒置显微镜下可以观察到,经胶原酶IV和0.25%胰蛋白酶消化过的细胞大多数分散存在,偶尔能够看到几个细胞聚合在一起组成细胞团块。在原代细胞培养2~4 h后,可见大部分细胞开始贴壁。随着培养天数的增加,细胞状态趋于稳定,细胞形态逐渐趋向多角形(图1所示)。最初细胞不好辨认,有些细胞边缘不清晰,胞体有些透明;当培养接近10 d左右,细胞生长一定数量,细胞变得致密,有层次感,在板底形成一定“纹理”。铺满板底70%~80%时可传代。

图1 hAEC原代培养结果(A:3 d;B:10 d)(500×)Fig.1 Primary culture of hAEC(day 3 to day 10)
2.2 不同的生长因子对于hAEC生长速度
将hAEC分别用不同成分的培养基培养,结果表明,组1(A:培养24 h;B:培养48 h)培养液内添加90%DMEM、10%胎牛血清、40 ng·mL-1的EGF,细胞生长速度比对照组明显加快;组2(C:培养24 h;D:培养48 h),培养液为90%DMEM、10%胎牛血清、10 ng·mL-1bFGF,细胞生长速度比组1,细胞纹理清晰表明细胞相对致密,可以此作为生长迅速的证据之一;组3(E:培养24 h;F:培养48 h)是对照组,培养液为90%DMEM、10%胎牛血清。结果说明bFGF和EGF加速了hAEC的生长,而未添加生长因子的细胞生长缓慢。而且,添加组细胞培养3d就可以达到普通培养基培养10 d的效果(图2、表2所示)。
2.3 hAEC的生长曲线
将第2代hAEC细胞通过MTT法,用酶标测定仪测定细胞培养物的OD570nm值。根据OD570 nm值的大小计算反应体系中细胞增殖程度。在第1~3 d细胞个数值逐渐上升,为生长缓滞期。第4~7 d,细胞数目明显的增加,为细胞生长对数期。第8~10 d,细胞的数目轻微增加,为平台期。第15 d后,细胞生长停滞,并伴有一定数量的细胞发生死亡。以细胞数×1 000为纵坐标,培养时间为横坐标绘制生长曲线,如图3所示。

图2 添加不同的生长因子对于hAEC生长速度的影响(500×)Fig.2 The influence of growth rate by various growth factor(bFDF,EGF)for hAEC

表2 不同组分培养基的hAEC生长差异性Table2 Dissimilarity of hAEC growth under different components of themedium
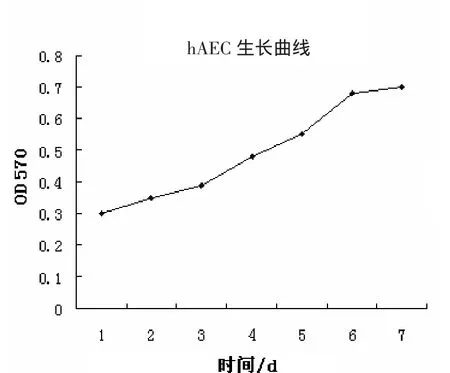
图3 hAEC的生长曲线Fig.2 The growth curve of hAEC incubated
2.4 病毒感染病变结果
在细胞接毒之后72 h内,通过细胞病变效应(CPE)观察,如图4所示,正常细胞(A)接毒后,经过24 h,细胞状态变化很明显。B代表细胞接毒24 h的状态;C代表细胞接毒48 h的状态;D代表细胞接毒72 h的状态。其中,在48 h后发生病变。显微镜观察到有部分细胞皱缩,细胞变圆,坏死,从培养板底部脱落等现象。结果表明,hAEC细胞对病毒ORFV存在敏感性,说明ORFV对于hAEC有一定的侵染能力。

图4 hAEC在ORFV感染后CPE结果Fig.4 The results of CPE of hAEC after infection by ORFV
3 讨论
羊膜(Amnion)覆盖于羊膜腔内表面,其厚度为0.02~0.05 mm,是人体中最厚的基底膜。hAEC位于羊膜的最内层,在受精后第8 d从外胚叶发育而来,使其可能维持原肠胚形成前期胚胎干细胞的可塑性。研究表明,hAEC在遗传学上具备干细胞的某些特性[7],因而很有希望成为干细胞移植的候选细胞。hAEC体外培养的难点是原代培养过程[8]中形成稳定的细胞系,而原代培养的成功与否很大程度决定于能否获得足够数量活性强、品种纯的上皮细胞。在研究中,我们采用多次消化法[9]获得上皮细胞进行培养,同时借鉴了其他学者研究的经验[10],将两种酶交替使用。首先用胶原酶IV处理羊膜组织,分解间质组织等强韧成分,进而获得成片的上皮细胞,然后再用胰蛋白酶多次消化细胞,这样得到的上皮细胞比较多,而且细胞的损伤小、完整性好、质量高,细胞容易贴壁成活。实际上,表皮生长因子(EGF)具有多种生物活性,能刺激hAEC分裂和增生;碱性成纤维细胞生长因子(bFGF)对来源于中胚层和外胚层的细胞具有很强的促分裂作用,而对于hAEC也有较强的促进作用。镜下观察hAEC对bFGF和EGF存在的应激性,发现hAEC在bFGF的刺激下,细胞形态变化也较大,由原来的圆形变成梭形,可能与bFGF的促成纤维细胞增殖有关。而EGF对hAEC的刺激也反映出与EGF作用浓度有关,可能是因为不同浓度的EGF启动的细胞分裂或分化信号通路不同所致。细胞培养结果表明,在第15 d左右,细胞出现萎缩死亡迹象,可能是因为hAEC缺乏端粒酶[11]。鉴于这两种生长因子在胚胎干细胞或间充质细胞等的分化中独特作用[12],我们也将进一步深入研究其中的机制。
ORFV主要引起上皮细胞病变,但与上皮细胞间存在复杂的作用关系,用RNAi技术可能实现针对病毒复制的抑制作用[13]。hAEC在ORFV作用下病变明显,可以提供病毒感染机制研究的细胞模型,对于探寻ORFV在感染非许可细胞的病变机制将起到积极的促进作用。
[1]Miki T,Lehmann T,Cai H,et al.Stem cell characteristics of amniotic epithelial cells[J].Stem Cells,2005,23(10):1549-1559.
[2]Sakuragawa N,Misawa H,Ohsugi K,et al.Evidence for active acetylcholine metabolism in human amniotic epithelial cells:applicable to intracerebral allografting for neurologic disease[J].Neurosci Lett.1997,22(1):53-56.
[3]Takashima S,Ise H,Zhao P,et al.Human amniotic epithelial cells possess hepatocyte-like characteristics and functions[J].Cell Struct Funct,2004,29(3):73-84.
[4]Mercer AA,Haig DM.Parapoxviruses,the encyclopedia of virology[M].2nd ed.New York:Academic Press,1999.
[5]Brandt TA,Jacobs BL.Both carboxy-and amino-terminal domains of the vaccinia virus interferon resistance gene,E3L,are required for pathogenesis in amousemodel[J].JVirol.2001,75(2):850-856.
[6]Robinson AJ,Ballassu TC,Contagious pustular dermatitis orf[J].Vet.Bull,1981,51:771-782.
[7]金玲,陈剑,吴静,等.人羊膜上皮细胞的肝细胞特性[J].中国组织工程研究与临床康复,2011,15(19):732-738.
[8]刘小勇,陈剑,吴静,等.人羊膜上皮细胞的原代及传代培养[J].广东医学,2007,28(2):181-183.
[9]张春,车玉梅.应用胰蛋白酶/DNA酶消化法分散人绒毛膜滋养层细胞[J].齐齐哈尔医学院学报,2011,22(2):232-241.
[10]方宁,宋秀军,张路,等.人羊膜上皮细胞的分离、培养及鉴定[J].遵义医学院学报2009,32(2):432-437.
[11]郭礼和.人羊膜上皮细胞具有胚胎干细胞和移植免疫耐受等优良特性[J].中国细胞生物学学报,2011,33(4):451-454.
[12]吴其全,张胜利,周君梅,等.胚胎干细胞和间充质干细胞分化为内皮细胞的研究现状[J].国际生物医学工程杂志,2009,22(2):108-112.
[13]于永忠,郭雯,吴欣媛,等.靶向ORFV-DNA ploymerase基因shRNA表达载体的构建[J].黑龙江八一农垦大学学报,2012,24(4):38-41.

