强酸性茶园土壤中添加不同肥料氮后N2O释放量变化
黄 莹, 李雅颖, 姚槐应, 2
(1 浙江大学环境与资源学院, 杭州 310058; 2 中国科学院城市环境研究所,福建厦门 361021)
强酸性茶园土壤中添加不同肥料氮后N2O释放量变化
黄 莹1, 李雅颖2*, 姚槐应1, 2
(1 浙江大学环境与资源学院, 杭州 310058; 2 中国科学院城市环境研究所,福建厦门 361021)
茶园由于长期偏施氮肥,造成土壤酸化现象严重和N2O大量排放。本文对强酸性茶园土壤进行不同氮肥处理试验,结果表明, 通过31 d的好气培养,各施肥处理均显著提高N2O排放, 其中施硝酸钾(KNO3)处理平均每天排放的N2O最高,总排放量为对照(CK)的17倍,其次是硝酸铵(NH4NO3)处理, 尿素[CO(NH2)2]和硫酸铵[(NH4)2SO4]处理虽然能增加N2O排放,但远远小于硝酸钾处理。对各氮肥处理硝化势的测定表明,尿素、 硫酸铵和硝酸铵处理均明显增加土壤硝化活性,而硝酸钾处理硝化势与对照相比显著降低。强酸性茶园土壤中N2O排放的主要来源是反硝化作用。氧化亚氮还原酶(nosZ)的定量PCR分析表明,硝酸钾处理的nosZ基因拷贝数与对照相比显著降低(P<0.05)。因此,强酸性土壤中N2O还原酶活性被NO3-抑制是导致高N2O排放的重要原因之一。
茶园土; 不同氮肥处理; N2O排放;nosZ基因; 定量PCR
Abstract: In recent years the long-term application of large amount of nitrogen fertilizers has led to the serious acidification of tea orchard soils with high N2O emission. In this study, different N fertilizers were applied to a highly acid tea orchard soil to evaluate the effects of N fertilizers on N2O emission. The results suggest that all the treatments increase N2O production significantly by the 31 days’ aerobic incubation. The average N2O emission from the KNO3treatment is the highest and total emission is 17 times higher than that of the control. The N2O emission of the NH4NO3treatment is the next. The total N2O productions from the urea[CO(NH2)2] and (NH4)2SO4treatments are stimulated but the N2O emissions are significantly lower than that of the KNO3treatment. The Urea, (NH4)2SO4and NH4NO3treatments significantly stimulate soil nitrification activity, while the KNO3treatment decreases nitrification potential. The results that denitrification is the dominant source of N2O emission in the highly acid tea orchard soil. To find out the microbial mechanism, quantitative PCR of the functional gene of nitrous oxide reductase(nosZ) was determined. The results suggest thatnosZgene copies from the KNO3treatment are significantly(P<0.05) lower than those of the control. Therefore, the inhibition of N2O reductase is one of the important factors to induce the high N2O emission in the highly acid soil.
Keywords: tea orchard soil; nitrogen fertilizer treatment; N2O emission;nosZgene; quantitative PCR
氧化亚氮(N2O)是地球上重要的温室气体之一,其增温潜势值为310[1],红外吸收能力大约为CO2的200倍,CH4的4倍。而且还参与大气的光化学反应,破坏臭氧层。氧化亚氮一方面使得全球气候变暖,对人类居住环境构成很大的威胁[2];另一方面,使得全球氮沉降持续升高,加剧酸化作用等环境危害[3]。在众多N2O产生源中,土壤排放是N2O的最主要来源,因此对陆地系统中N2O的产生进行系统研究十分必要。
土壤中的N2O主要由硝化作用和反硝化作用产生,二者对N2O排放的相对贡献因土壤生态系统不同而存在显著差异[4-6]。硝化作用是由NH4+或NH3氧化为NO2-和NO3-的过程,N2O产生于NH3氧化为NO2-的过程中。一般来说,对于施用肥料和含水量较低的土壤,硝化作用在农田土壤N2O排放过程中起主要作用[7],而在湿地等厌氧系统中,反硝化作用能产生大量N2O[8]。在反硝化过程中,NO3-通过硝酸还原酶(由narG,narH或者napA基因编码)、 亚硝酸还原酶(由nirK或nirS基因编码)、 NO还原酶(由qnorB或cnorB基因编码)、 N2O还原酶(由nosZ基因编码)逐步还原为N2,N2O是其中的重要中间产物。nosZ作为能够编码还原N2O的反硝化细菌群落的功能基因,在土壤N2O释放的过程中起着非常关键的作用[9]。

1 材料与方法
1.1 采样地点及土壤样品处理
土样采自浙江省杭州市西湖区梅家坞茶园(30°11′N,120°05′E),此区属中亚热带湿润季风气候,年平均气温15℃,年平均降水量大约1500 mm。土壤为发育于石英砂岩(薄层页岩相间)母质上的红壤。采样茶园有100年植茶历史,试验分3个小区进行土样采集,每个小区按S形线路选取8个采样点,采样深度0—20 cm。采集的新鲜土样充分混匀过2 mm筛后,一部分装入无菌塑料袋内,贮存于4℃的冰箱用于培养试验和生物性质测定,剩余部分风干后供土壤基本理化性质测定。供试土壤基本性质为: 有机质含量93.1 g/kg,全氮5.6 g/kg、 硝态氮57.9 mg/kg、 铵态氮22.0 mg/kg、 微生物量碳241.4 mg/kg、 速效磷(P2O5)76.1 mg/kg,pH 3.5。
1.2 测定项目和方法
土壤pH以1 ∶2.5土水比用复合电极测定;全氮用浓硫酸消煮—氮磷流动分析仪测定;土壤有机碳用重铬酸钾容量法外加热法;铵态氮和硝态氮用1 mol/L KCl提取—氮磷流动分析仪测定[12];速效磷用0.03 mol/L NH4F-0.025 mol/L HCl浸提,比色法测定。土壤微生物量碳采用氯仿熏蒸-0.5 mol/L K2SO4提取[13],提取液中可溶性有机碳用TOC-500有机碳自动分析仪测定。
1.3 培养试验
称取新鲜土壤样品500 g(以干土计)5份,以N 200 mg/kg干土重的量分别加入硝酸铵(NH4NO3)、 硫酸铵[(NH4)2SO4]、 尿素[CO(NH2)2]、 硝酸钾(KNO3),并设对照处理(CK),调节土壤含水量至田间持水量的60%,装于烧杯中,用锡箔纸于避光处培养,其间称重并定时补充失去的水分。
1.4土壤N2O排放和硝化势的测定
分别于1、 3、 10、 17、 24、 31 d称取土样10 g(以干土计)于120 mL血清瓶中,用胶塞和铝盖将瓶口密闭。在0 h和24 h用气相色谱仪测定N2O浓度。然后从血清瓶中取土测定土壤pH和NO3-含量。以培养时间为横坐标,以NO3-含量为纵坐标,求出斜率,即土壤硝化势[12]。
1.5 气样N2O浓度的测定
气样N2O浓度采用中国科学院城市环境研究所的安捷伦7890气相色谱仪进行分析(带有ECD检测器),具体测定条件依据文献进行[14]。
1.6 DNA的提取
31 d培养结束时,称取500 mg土壤至2 mL灭菌的离心管中,总DNA的提取按照MoBio UltraCleanTM(San Diego, CA, USA)试剂盒标准步骤进行。
1.7 定量PCR
标准质粒的提取方法按照TIAN Prep Mini Plasmid Kit(TIANGEN BIOTECH BEIJING)试剂盒标准步骤进行。实验前,对标准质粒进行稀释。采用ABI PRISM 7500定量PCR仪(Applied Biosystem USA)。PCR反应体系(20 μL)为: SYBR®premix Ex TaqTMII(Takara Bio, Dalian, Liaoning, China) 10 μL,DNA样品2 μL,nosZ使用的基因引物为nosZ1F(5′ WCSYTGTTCMTCGACAGCCAG 3′)和nosZ1R(5′ ATGTCGATCARCTGVKCRTTYTC 3′)[10],浓度为10 μmol/L。nosZ的PCR反应条件为95℃ 10 min,95℃ 15 s,68℃ 1 min(-1℃/cycle), 81.5℃ 30 s, 循环6次;95℃15 s,62℃1 min,81.5℃ 30 s,循环40次。所有样品重复3次并设置阴性对照,通过溶解曲线分析和琼脂糖凝胶电泳鉴定产物的特异性。
1.8 数据统计
SPSS 16.0统计软件对数据进行处理,数据为3次重复的平均值,采用方差分析,计算最小显著性差异(LSD),对不同样品平均值之间进行多重比较。
2 结果分析
2.1 茶园土壤的化学和生物学特性
供试100年茶园土由于植茶年龄长、 酸化程度严重,pH仅为3.5。土壤有效态氮绝大多数仍以NO3--N的形式存在,是NH4+-N的2.6倍,有机质含量为92.1 g/kg,微生物量碳含量为241.1 mg/kg,土壤微生物量碳占土壤有机碳的1.50%。
2.2 不同施肥处理对茶园土壤N2O排放的影响
2.2.1 对土壤pH的影响 茶园土壤pH测试结果表明,不同处理间的pH变化存在显著差异(P<0.05)(图1)。培养初期,尿素在土壤脲酶的水解作用下释放NH4+,导致土壤pH显著增加,以第1 d最高,且显著高于其余4个处理,此后由于土壤发生硝化作用pH逐渐降低。31 d培养结束时,尿素和对照处理的土壤pH差异不显著,但均明显高于其余3个处理。硫酸铵、 硝酸铵处理的土壤pH显著低于对照。硝酸钾处理的土壤pH最低,这可能与土壤胶体之间的离子交换有关。

图1 培养期间不同氮肥处理土壤pH变化Fig.1 Soil pH of the different N fertilizer treatments during the incubation
2.2.2 氮肥处理对土壤硝化势的影响 NH4+-N作为硝化细菌进行硝化作用的初始反应物,其来源对硝化作用具有显著影响。由图2可知,不同氮肥处理中以尿素处理硝化势最高,为2.7 mg/(kg·d),比对照高4.7倍。其次是硫酸铵和硝酸铵处理,硝化势分别为1.87和1.03 mg/(kg·d),比对照增加3.2和1.8倍。硝酸钾处理不能为硝化作用增加底物,其硝化势与对照相比显著(P<0.05)降低。
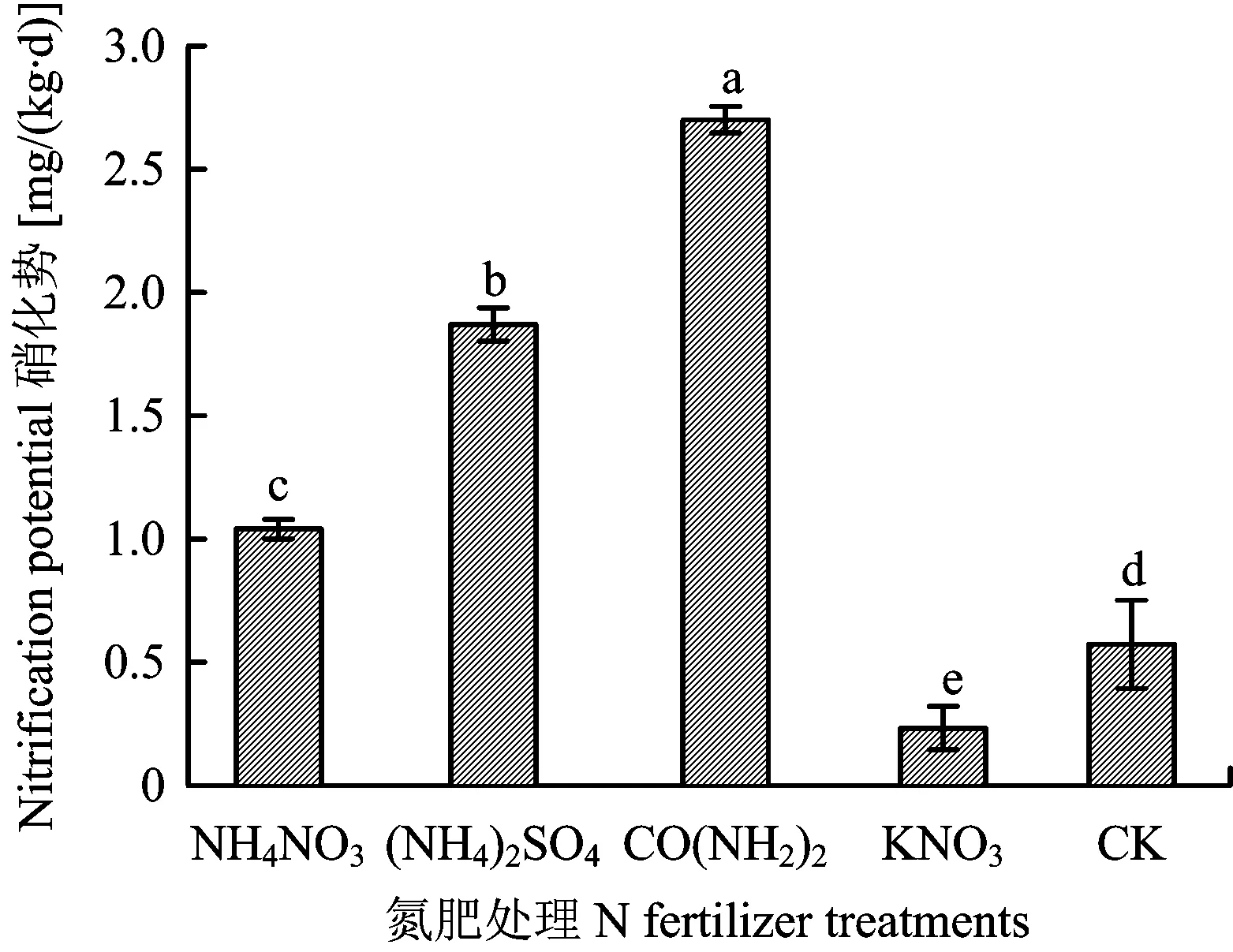
图2 培养期间不同氮肥处理土壤硝化势的变化Fig.2 Nitrification potential of different N fertilizer treatments during incubation[注(Note): 柱上的不同字母表示同一时期处理间差异达到5%显著水平Different letters above the bars at the same stage mean significant difference among treatments at the 5% level.]

图3 培养期间不同氮肥处理日均N2O排放及总N2O排放Fig.3 The average and total N2O emissions from the different N fertilizer treatments during incubation[注(Note): 方柱上的不同字母表示处理间差异达到5%显著水平 Different letters above the bars mean significant difference among different treatments at the 5% level.]
2.2.3 对土壤N2O排放的影响 土壤N2O排放测定结果表明,不同氮肥处理的N2O排放量均存在明显差异,并随培养时间增加发生显著变化。图3表明,所有土壤N2O日排放量以第1 d最高,此后逐渐降低;其中硝酸钾处理第1 d排放的N2O为对照的14倍,此后排放量迅速降低,3 d后N2O排放量基本稳定但仍然高于其余4个处理;硝酸铵处理的N2O排放量仅次于硝酸钾处理,但显著高于其余3个处理;培养前3 d与对照相比,尿素显著(P<0.05)刺激N2O排放;而硫酸铵处理则与对照差异不显著(P>0.05),3 d后硫酸铵处理的N2O排放逐渐增大,到培养结束时与尿素处理差异不显著。经过31 d好气培养,硝酸钾处理N2O总量为744.8 ng/g,比对照增加了16倍;其次是硝酸铵处理,N2O总排放为对照的5.5倍;尿素和硫酸铵处理N2O总排放量分别为4.0和3.1 ng/g,显著小于硝酸钾处理。
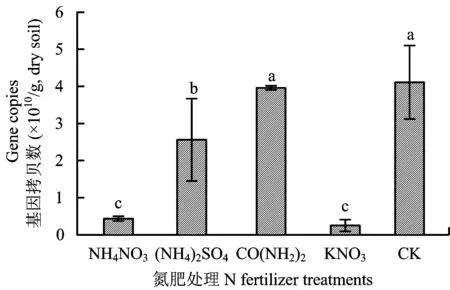
图4 不同氮肥处理nosZ基因拷贝数Fig.4 nosZ gene copy numbers per g dry soil from the different N fertilizer treatments[注(Note): 柱上的不同字母表示处理间差异达到5%显著水平Different letters above the bars mean significant diffeence among different treatments at the 5% level.]
2.2.4 反硝化作用功能微生物的定量PCR结果 作为编码N2O到N2还原过程的关键基因,nosZ的表达在一定程度上决定N2O的排放强度。从图4可以看出,经过31 d的好气培养,除了尿素处理与对照差异不显著(P>0.05)外,其余三种氮肥处理的nosZ基因丰度均显著(P<0.05)小于对照。其中硝酸钾和硝酸铵处理的nosZ基因拷贝数最低,分别为4.3×109和2.5×109copies/g干土;硫酸铵处理的土壤nosZ基因拷贝数为1.8×1010copies/g干土,也显著(P<0.05)低于尿素和对照处理。
3 讨论
铵态氮肥料能刺激硝化微生物群落生长,提高硝化作用强度[19-22]。本试验硫酸铵、 硝酸铵施入土壤后均显著促进了硝化活性(见图2)。随着硝化微生物对NH3的吸收利用,大量H+被释放到土壤中,导致土壤pH较对照显著(P<0.05)降低。对于尿素处理来说,土壤脲酶能迅速水解尿素为碳酸铵和碳酸氢铵,使得培养初期土壤pH显著提高。随后由于硝化作用的进行,土壤pH呈下降趋势。施入硝酸钾肥料虽然没有刺激硝化作用,但土壤pH仍然下降,这可能与K+与H+之间的离子交换有关。


4 结论
在强酸性茶园土壤中,反硝化过程是产生N2O的主要来源;不同施肥处理能显著影响N2O的排放速率,硝态氮肥处理的土壤N2O排放远远高于铵态氮肥;高浓度硝态氮能显著降低nosZ基因丰度,N2O还原酶被硝态氮抑制是酸性茶园土壤中高通量N2O排放的关键原因。
[1] Houghton J T, Meira Filho L G, Callander B Aetal.The science of climate change. Contribution of group Ι to second assessment report of the intergovernmental panel to climate change[R]. New York, USA: Cambridge University Press,1995.
[2] 刘义, 陈劲松, 刘庆, 陈林武. 土壤硝化和反硝化作用及影响因素研究进展[J].四川林业科技, 2006, 27(2): 36-41. Liu Y, Chen J S, Liu Q, Chen L W. Advances in studies of soil nitrification and denitrification and controlling factors[J]. J. Sichuan For. Sci. Tech., 2006, 27(2): 36-41.
[3] 张玉树, 丁洪, 秦胜金. 农业生态系统中氮素反硝化作用与N2O排放研究进展[J]. 中国农学通报, 2010, 26(6): 253-259. Zhang Y S, Ding H, Qin S J. Progress in the studies of nitrogen denitrification and N2O emission in agro-ecosystem[J]. Chin. Agric. Sci. Bull., 2010, 26(6): 253-259.
[4] Firestone M K, Firestone R B, Tiedje J M. Nitrous oxide from soil denitrification: factors controlling its biological production[J]. Science, 1980, 208: 749-751.
[5] Wrage N, Lauf J, Prado A Detal. Distinguishing sources of N2O in European grasslands by stable isotope analysis[J]. Rapid Commun. Mass Spectrom., 2004, 18: 1201-1207.
[6] Nakajima Y, Ishizuka S, Tsuruta Hetal. Microbial processes responsible for nitrous oxide production from acid soils in different land-use patterns in Pasirmayang, central Sumatra, Indonesia[J]. Nutr. Cycl. Agroecosys., 2005, 71: 33-42.
[7] Stevens R J, Laughlin R J, Burns L Cetal. Measuring the contributions of nitrification and denitrification to the flux of nitrous oxide from soil[J]. Soil Biolo. Biochem., 1997, 29: 139-151.
[8] Hefting M M, Bobbink R, De C H. Nitrous oxide emission and denitrification in chronically nitrate-loaded riparian buffer zones[J]. J. Environ. Qual., 2003, 32: 1194-1203.
[9] Henry S, Bru D, Stres Betal. Quantitative detection of thenosZgene, encoding nitrous oxide reductase, and comparison of the abundance of 16S rRNA,narG, nirK, andnosZgenes in soils[J]. Appl. Environ. Microbiol., 2006, 72(8): 5181-5189.
[10] 韩文炎, 阮建云, 林智, 等.茶园土壤主要营养障碍因子及系列专用肥的研制[J]. 茶叶科学, 2002, 22(1): 70-74. Han W Y, Ruan J Y, Lin Zetal. The major nutritional limiting factors in tea soils and development of tea speciality fertilizer series[J]. J. Tea. Sci., 2002, 22(1): 70-74.
[11] Akiyama H, Yan X, Yagi K. Estimations of emission factors for fertilizer-induced direct N2O emissions and estimate of N2O emission factors from agricultural soils in Japan: Summary of available data[J]. Soil Sci. Plant Nutr, 2006, 52(6): 774-787.
[12] 鲁如坤. 土壤农业化学分析法[M]. 北京: 中国农业科技出版社,1999. Lu R K. Soil and agro-chemistry analysis[M]. Beijing: China Agricultural Science and Technology Press, 1999.
[13] Vance E D, Brookes P C, Jenkinson D C. An extraction method for measueing soil microbial biomass C[J]. Soil Bio. Biochem., 1987, 79: 703-707.
[14] Molstad L, Dörsch P, Bakken L R. Robotized incubation system for monitoring gases(O2, NO, N2O, N2) in denitrifying cultures[J]. J. Microbiol. Methods, 2007, 71: 202-211.
[15] Tokuda S, Hayatsu M. Nitrous oxide production from strongly acid tea field soils[J]. Soil Sci. Plant Nutr., 2000, 46(4): 835-844.
[16] Hankinson T R, Schmidt E L. An acidophilic and a neutrophilic nitrcbacter strain isolated from the nnmencaly predominant nitrite-oxidizing population of an acid forest soil[J]. Appl. Environ. Microbiol., 1988, 54: 1536-1540.
[17] Paul E A, Clark F E. Soil microbiology and biochemistry[M]. San Diego, California: Academic Press, 1989.
[18] Hayatsu M, Kosuge N. Autotrophic nitrification in acid tea soils[J]. Soil Sci. Plant Nutr., 1993, 39(2): 209-217.
[19] Martikainen P J. Numbers of autotrophic nitrifiers and nitrification in fertilized forest soil[J]. Soil Biol. Biochem., 1985, 17: 245-248.
[20] Mendum T A, Sockett R E, Hirsch P R. Use of molecular and isotopic techniques to monitor the response of autotrophic ammonia -oxidizing populations of the β subdivision of the class proteobacteria in arable soils to nitrogen fertilizer[J]. Appl. Environ. Microbiol., 1999, 66: 4155-4162.
[21] Chu H Y, Fujii T, Morimoto Setal. Population size and specific nitrification potential of soil ammonia-oxidizing bacteria under long-term fertilizer management[J]. Soil Biol. Biochem., 2008, 40: 1960-1963.
[22] Xue D, Gao Y M, Yao H Y, Huang C Y. Nitrification potentials of Chinese tea orchard soils and their adjacent wasteland and forest soils[J]. J. Environ. Sci., 2009, 21: 1225-1229.
[23] Chon K, Chang J S, Lee Eetal. Abundance of denitrifying genes coding for nitrate(narG), nitrite(nirS), and nitrous oxide(nosZ) reductases in estuarine versus wastewater effluent-fed constructed wetlands[J]. Ecol. Eng., 2011, 37: 64-69.
[24] Philippot L, Andert J, Jones C Metal. Importance of denitrifiers lacking the genes encoding the nitrous oxide reductase for N2O emissions from soil[J]. Glob. Change. Biol., 2011, 17: 1497-1504.
[25] Zhou Z F, Zheng Y M, Shen J Petal. Response of denitrification genes nirS, nirK, andnosZto irrigation water quality in a Chinese agricultural soil[J]. Environ. Sci. Pollut. Rea, 2011, 18: 1644-1652.
[26] Palmer K, Biasi C, Horn M A. Contrasting denitrifier communities relate to contrasting N2O emission patterns from acidic peat soils in arctic tundra[J]. ISME J., 2012, 6: 1058-1077.
[27] Ma W K, Bedard-Haughn A, Siciliano S D, Farrell R E. Relationships between nitrifier and denitrifier community composition and abundance in predicting nitrous oxide emissions from ephemeral wetland soils[J]. Soil Biol. Biochem., 2008, 40: 1114-1123.
[28] Nommik H, Thorin J. A mass spectrometric technique for studying the nitrogenous gases produced on the reaction of nitrite with raw humus[J]. Agrochimica, 1972, 16: 319-322.
[29] Blackmer A M, Bremner J M. Inhibitory effectt of nitrate on reduction of N2O to N2by soil microorganisms[J]. Soil Biol. Biochem., 1978, 10: 187-191.
EffectsofdifferentnitrogenfertilizersonN2Oemissionsinahighlyacidteaorchardsoils
HUANG Ying1, LI Ya-ying2*, YAO Huai-ying1, 2
(1CollegeofEnvironmentalandResourceSciences,ZhejiangUniversity,Hangzhou310058,China; 2InstituteofUrbanEnvironment,ChineseAcademyofSciences,Xiamen,Fujian361021,China)
2013-02-06接受日期2013-05-23
国家自然科学基金项目(31071869, 31272256)资助。
黄莹(1987—), 女, 安徽池州人, 博士研究生, 主要从事土壤生物化学和微生物生态研究。 Tel: 0592-6190586;E-mail: hybg0418@126.com * 通信作者 E-mail: yyli@iue.ac.cn。
S143.1; 153.6
A
1008-505X(2013)06-1533-06

