腺苷预处理对OGD星形胶质细胞NGF和BDNF的影响
马世江 李 静 靳 玫 李素芳 谭 军
新乡医学院第三附属医院神经内科 新乡 453003
近年来研究表明[1],抑制缺血再灌注损伤(ischemiareperfusion injury,IRI)成为目前治疗缺血性脑卒中的关键环节。神经生长因子(nerve growth factor,NGF)[2]和脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)可以抑制神经细胞的凋亡,对脑缺血具有明显的神经保护作用[3]。
本研究选用SD大鼠,采用 McCarthy及谢裕华[4]的星形胶质细胞培养方法并在现有实验条件上稍作改进进行体外培养星形胶质细胞,经纯化、传代至第三代或第四代细胞用于实验,在氧糖剥夺(oxygen-glucose deprivation,OGD)处理前实验组给予100μmol/L的腺苷预处理,研究其对内源性NGF、BDNF表达的影响。
1 材料与方法
1.1实验动物出生24h内的SD大鼠,雌雄不限,体质量10~12g。
1.2实验方法将SD大鼠星形胶质细胞的分离、消化、培养、鉴定,通过分组处理,随机分为3组:正常对照组(normal control group)、氧糖剥夺组(OGD group)、腺苷预处理组(ADO group),每组各3只。正常对照组不进行氧糖剥夺,在氧糖剥夺期及复氧糖期均更换完全DMEM培养基。OGD组在氧糖剥夺期更换成无糖、无血清DMEM培养基;ADO组在氧糖剥夺前24h给予含100μmol/L腺苷的完全DMEM培养基,氧糖剥夺时更换为无糖、无血清DMEM培养基。观察氧糖剥夺8h复氧糖24h后星形胶质细胞形态、检测细胞培养液中NGF和BDNF的浓度。
1.3统计学方法分析所有数据采用Prism4.0软件包进行统计学分析,计量资料以均数±标准差(s)表示,多组间比较采用单因素方差分析,两两比较均采用LSD检验,P<0.05为差异有统计学意义。
2 结果
2.1 OGD后星形胶质细胞分泌NGF的变化NGF试剂盒检测行单因素方差分析见表1。由表1可知,OGD组培养液中NGF活性明显高于对照组,差异有统计学意义(P<0.05),表明受到缺氧缺糖损伤后,可刺激NGF表达增加;ADO组与OGD组相比NGF分泌明显增加,差异有统计学意义(P<0.05),表明腺苷预处理可以增加NGF表达。
表1 3组ELISA检测星形胶质细胞氧糖剥夺复氧复糖24h细胞NGF含量比较 (s,ng/mL)
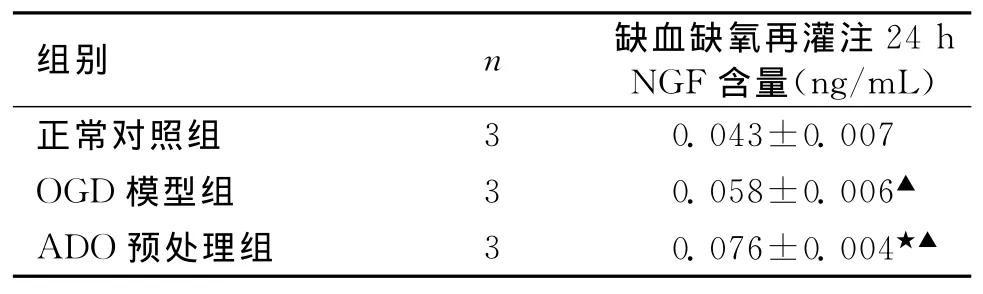
表1 3组ELISA检测星形胶质细胞氧糖剥夺复氧复糖24h细胞NGF含量比较 (s,ng/mL)
注:与正常对照组比较,▲P<0.05;与OGD组比较,★P<0.05
3 0.043±0.007 OGD模型组 3 0.058±0.006▲ADO预处理组 3 0.076±0.004正常对照组★▲
2.2 OGD星形胶质细胞分泌BDNF的变化通过BDNF试剂盒检测行单因素方差分析见表2。由表2可知,OGD组培养液中BDNF活性明显高于对照组,差异有统计学意义(P<0.05),表明细胞受到缺氧缺糖损伤后,可刺激BDNF表达增加;ADO组与OGD组相比BDNF分泌明显增加,差异有统计学意义(P<0.01),表明腺苷预处理可以增加BDNF的表达。
表2 ELISA检测星形胶质细胞氧糖剥夺复氧复糖24h细胞BDNF含量比较 (s,ng/mL)
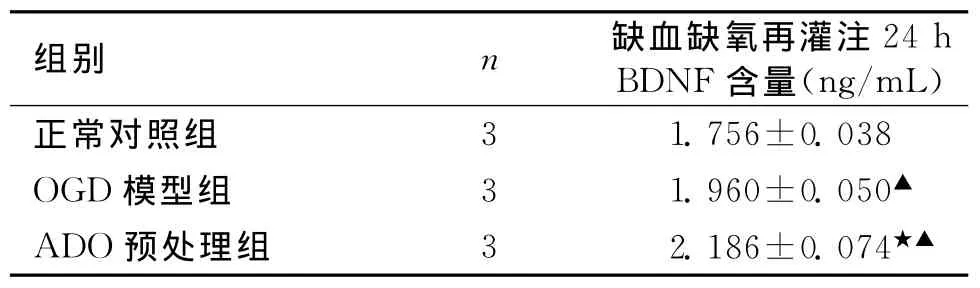
表2 ELISA检测星形胶质细胞氧糖剥夺复氧复糖24h细胞BDNF含量比较 (s,ng/mL)
注:与正常对照组比较,▲P<0.05;与OGD组比较,★P<0.01
3 1.756±0.038 OGD模型组 3 1.960±0.050▲ADO预处理组 3 2.186±0.074正常对照组★▲
3 讨论
改善缺血周围区血流供应是近几年国内外研究的焦点问题。大量研究表明,在体内具有神经营养的多种生长因子中,BDNF和NGF是近年来在神经再生、损伤修复领域内的研究热点。BDNF对受损神经系统的再生具有积极促进作用[5]。脑缺血发生以后,脑神经细胞的损伤程度与NGF和BDNF的表达水平密切相关[6]。二者的表达升高有利于缺血后脑组织损伤的修复[7],可以明显促进缺血后脑神经元的存活和生长发育,改善神经元的病理状态,并能够防止受损死亡,促进受损神经元再生及分化成熟,在中枢神经系统损伤修复中具有非常重要的作用。
NGF可调节神经元结构,BDNF可改变神经元的活性,机制可能是改变了胆碱能神经元的功能,进而对皮质的可塑性进行调节。中枢神经系统受到损害时,特定的神经元、局部的星形胶质细胞及小胶质细胞可以迅速表达NGF及受体。缺乏NGF及BDNF轴突就不生长,而应用NGF及BDNF能使成熟的受损神经元轴突生长,提示NGF及BDNF可以促使轴突克服周围环境中阻止因素而进行生长。张燕平研究表明,NGF可以抑制神经细胞的凋亡,对脑梗死大鼠具有明显的神经保护作用[5]。
NGF作为第一个被发现的神经营养因子,是神经系统维持正常发育和功能的必要因素[8]。NGF是一种亚基蛋白组成的靶组织源性细胞因子,营养谱比较广泛,包括基底节胆碱能神经元、海马和皮层的神经元。NGF对缺血再灌注损伤脑组织有确切的保护和治疗作用,机制可能包括:(1)NGF能增强自由基清除剂的活性,对降低神经元损伤有重要作用;(2)抵抗兴奋性氨基酸的神经毒性;(3)干扰钙通道与钙离子排出系统的表达与活化,稳定细胞内钙离子浓度;(4)抑制神经元的凋亡;(5)NGF能在神经元损伤后的促存活作用过程中,促进受损神经细胞功能恢复,促进神经递质的恢复。NGF对早期神经细胞发育分化的影响主要表现在:(1)促使神经干细胞向神经元分化;(2)促进神经干细胞向神经胶质细胞分化。而神经胶质细胞发育不仅是神经系统整体发育的一个组成部分,且为神经元发育提供不可缺少的环境条件。
BDNF是神经营养因子家族中具有神经营养和保护作用的主要成员之一,可对抗缺血、缺氧等病理损害保护神经元,对发育中的运动、感觉、交感神经元的存活、分化和增殖及防止运动神经元的退行性变有促进作用。还具有抗凋亡作用,主要机制为[9]:(1)下调NMDA受体功能,抑制谷氨酸的毒性;(2)通过诱导钙结合蛋白表达,稳定细胞内Ca2+浓度;(3)BDNF可以调节自由基代谢,从而保护神经元免受自由基的攻击;(4)BDNF可以对抗NO供体的细胞毒性,从而保护神经元免受损伤。由此可见,脑缺血损伤后,BDNF的表达上升是通过上述适应机体的神经元保护机制减少缺血性神经元死亡,降低脑缺血损伤后神经功能的损伤程度[10]。
综上所述,NGF和BDNF既有神经营养,又有神经保护作用,抑制神经细胞凋亡。本研究通过星形胶质细胞培养、氧糖剥夺、腺苷预处理已经证实:腺苷预处理后,星形胶质细胞损伤减轻,腺苷预处理组较氧糖剥夺组NGF和BDNF表达增高,差异有统计学意义(P<0.05)。以上实验结果表明腺苷预处理能够减轻大脑损伤产生脑保护作用,可能与上调NGF和BDNF表达有关。局灶性脑缺血后NGF和BDNF表达增高是机体自身的代偿反应,腺苷预处理后局灶性脑缺血时NGF和BDNF表达进一步上调,对机体产生更强的保护作用,我们推断NGF和BDNF的表达上调可能是腺苷预处理诱导脑缺血耐受形成的重要分子机制之一,为腺苷在脑缺血的应用提供理论依据,为临床治疗提供新的途径。
[1]Xu Z,Xu RX,Liu BS,et al.Time window charaeteristics of cultured rat hippocampal rat hippocampal neurons subjected to ischemia and reperfusion[J].Chin J Traumatol,2005,8(3):179-182.
[2]Buckley PF PF,Mahadik S,Pillai A,et al.Neurotrophins and schizophrenia[J].Schizophr Res,2007,94(1/3):1-11.
[3]张燕平 .神经生长因子对脑梗死大鼠神经元凋亡与脑梗死体积的影响[J].中国现代药物应用,2009,3(18):5-6.
[4]谢裕华,易春智,项晓伟,等 .新生大鼠大脑皮质星形胶质细胞的体外培养[J].广州中医药大学学报,2009,26(3):277-280.
[5]巴迎春,段艳萍,王金德,等 .内源性BDNF促进受损神经系统再生的实验研究[J].四川大学学报(医学版),2009,40(3):418-421.
[6]张卓,王廷华,朱榆红,等.NGF.BDNF和NT3在AD大鼠海马中的分布及表达变化[J].四川大学学报(医学版),2005,36(6):789-791.
[7]李子清,喻凯,赵焕英 .四物汤对血管性痴呆大鼠脑组织中BDNF和EGF的影响[J].中药药理与临床,2008,24(6):10-12.
[8]Petruska JC,Mendell LM.The many functions of nerve growth factor:multiple actions on nociceptors[J].Neurosci Lett,2004,361(1/3):168-171.
[9]Mizuno T,Kuno R,Nitta A,et al.Protective effects of nicergoline against neuronal cell death induced by activated mincroglia and strocytes[J].Brain Res,2005,1066(14):78-85.
[10]张津华,刘其强,白宏英 .尼莫地平对慢性脑缺血大鼠认知和海马CA1区NOS亚型的影响[J].中国实用神经疾病杂志,2007,10(5):74-76.
[11]Ding Y,Li J,Luan X,et al.Exercise pre-conditioning reduces brain damage in ischemic rats that may be associated with regional angiogenesis and cellular overexpression of eurotrophin[J].Neuroscience,2004,1(24):583-591.

