NMNAT1基因对体外原代培养神经元树突发育的影响
赵 虹 张惊宇 车守梅 赫丹丹 郭朝晖
哈尔滨医科大学附属第四医院神经内科 哈尔滨 150001
1 材料与方法
1.1动物和药物原代培养皮层神经元来源于ICR小鼠(SLAC.CHINA)的胚胎,动物实验保护协议由哈尔滨医科大学附属第四医院动物伦理委员会批准。酰胺磷酸核糖转移酶抑制剂FK-866购置于美国cayman化学制品公司。
1.2试验方法
1.2.1 DNA构建:编码小鼠NMNAT1基因的cDNA从小鼠脑cDNA库中经PCR扩增得到的,所用引物:5′-ATGGACTCATCCAAGAAGACAGA-3′和 5-TCACAGAGTGGAGTGGAATGGTTGTGCTTG-3′,并克隆到 PIRES2-EGFP载体(Invitrogen公司)中产生野生型过表达NMNAT1(NMNAT1-OE)序列。
1.2.2 shRNA plasmids的生成:专门针对小鼠NMNAT1 mRNA三个非重叠序列设计后构建到H1启动子RNAi载体上(psuper,Oligoengine,USA)。最有效的19-核苷酸靶序列 是 5′-ACGAGTGGATCACCAATGA-3′(KD-shRNA)。非特异性对照寡核苷酸设立为无关序列作为对照,该序列为:5′-TTCTCCGAACGTGTCACGT-3′(Scr-shRNA),含 干扰序列的寡核苷酸在DNA合成过程中,末端引入BgLⅡ和XhoⅠ酶切位点。所有序列均被测序证实正确。
1.2.3 原代神经元的培养和转染:原代新皮层神经元来源于刚出生小鼠(PO小鼠)的胚胎,简而言之,分离新皮层组织,在4℃含6%葡萄糖的磷酸盐缓冲盐水中清洗2次,然后0.3%胰蛋白酶中37℃消化10min,并在补充B27添加剂(Invitrogen)0.5mmol/L、左旋谷氨酸和20mmol/L HEPES的无血清培养基中轻轻磨碎分离,pH 7.4,在体外培养3~6 d后,神经元用于形态学实验研究。培养的神经元通过电穿孔的方法转染。简单地说,一个包含有质粒、电穿孔缓冲物和神经元的混合物移到一个的容器中,用转染试剂盒按程序通过电穿孔技术转染。
1.2.4 免疫印记分析:神经元溶解在细胞溶解缓冲液中(10mmol/L Tris-HCL、5mmol/L EDTA、140mmol/L NaCl、0.2%聚乙二醇辛基苯基醚),包含蛋白酶抑制剂的混合物中1h,1 300r离心10min,以合适的SDS-PAGE胶进行蛋白电泳,转移到PVDF(Millipore)膜上,用封闭液稀释一抗,将已封闭的膜置于一抗溶液中4℃过夜,然后放入用辣根过氧化物酶标记的二抗中孵化(1∶5000,Jackson Immuno Research),细胞膜用荧光检测试剂(GE,USA)检测,小鼠的单克隆抗体和小鼠的抗-action抗体,分别来自于Santacruz(sc-30842)和Chemicon(MAB1501)。
1.2.5 免疫细胞化学:细胞固定于含4%多聚甲醛和4%蔗糖的PBS缓冲液中,用5%BSA 和0.2%Ttriton-100在PBS缓冲液中封闭和透化后,细胞在一抗中4℃孵化一夜,然后细胞用Alexa488和Alexa568共轭二抗在室温下清洗孵化1h。小鼠单克隆抗-Taul(MAB2239)和小鼠单克隆抗体Map2(AB5622)购置于Chemicon。
1.2.6 成像和图像分析:胶片在荧光显微镜下扫描(尼康,日本)。分析神经突的延长和分支,关键是能够成像一个单一神经元的全部过程,并能区别它们是轴突还是树突,对成像轴突,需要使用相对低功率放大(20×)获得图像,包括神经元的成像。对成像的树突分支(40×)物象提供最优放大。被转染的细胞用绿色荧光GFP和树突特异性标记MAP2免疫双标神经元树突,Neurolucida软件用来分析树突的生长,并计算树突的长度。
1.3统计分析计量数据用均数±标准差表示,树突的复杂度通过计算从神经元发出的主要树突的分支点计算,分析得到的数据使用统计软件Prism 5.0进行统计分析,组间比较采用one-way ANOVE(方差分析)及post-hoct-test方法。P<0.05为差异有统计学意义。
2 结果
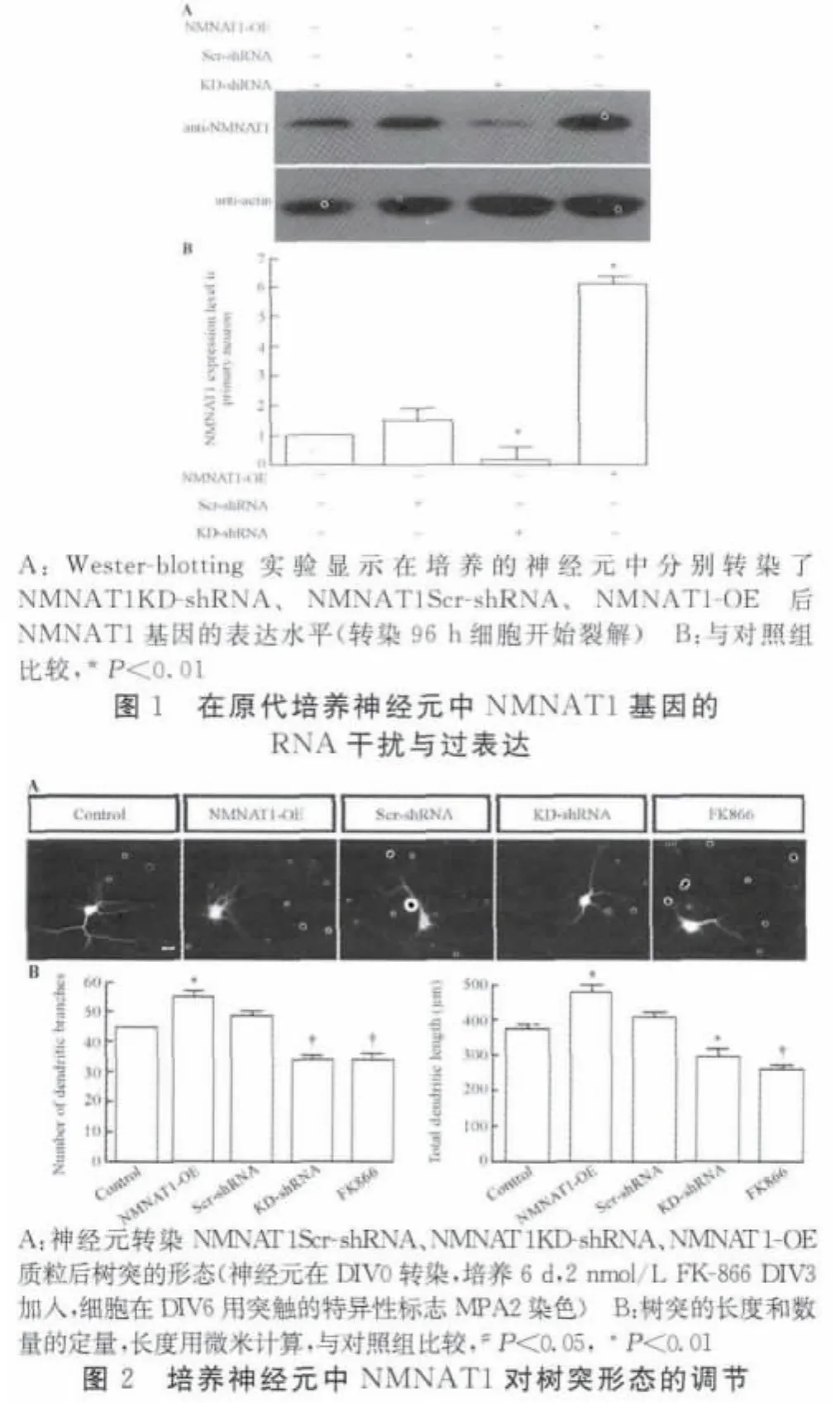
2.1小鼠NMNAT1shRNA和过表达载体在培养的神经元中有效构建为研究NMNAT1在中枢神经系统发育中的功能,我们设计了一个针对小鼠NMNAT1mRNA的shRNA结构(NMNAT1KD-shRNA),我们也设计了无针对性对照的shRNA(NMNAT1Scr-shRNA),我们把每个shRNA结构转染原代培养的神经元,检验敲除内源性NMNAT1蛋白的能力,Western-blotting分 析显 示过 表达 NMNAT1(NMNAT1-OE)高表达 NMNAT1而 KD-shRNA 有效敲除了NMNAT1基因(图1A和1B),而Scr-shRNA未影响到NMNAT1表达。这些结果证明小鼠NMNAT1过表达和干扰慢病毒载体构建在原代培养小鼠神经元中是有效的。
2.2 NMNAT1在培养的小鼠神经元中调控树突的形态以前的研究显示NMNAT1在中枢神经系统的不同区域广泛表达,我们假定NMNAT1可能在神经元形态方面起一定作用,为探索NMNAT1对树突形态的作用,我们用NMNAT1过表达和NMNAT1干扰的慢病毒载体转染了DIV0的神经元,在DIV6用GFP和树突特异标记MAP2免疫双标这些细胞。我们发现过表达NMNAT1(NMNAT1-OE)能够增加树突分支的数量和整个树突的总长度。相反,NMNAT1KD-shRNA损害了树突的生长,因为引起树突分支和总长度的减少(图2A和2B)。烟酰胺单核苷酸腺苷酰转移酶是NAD合成途径中的限速酶,过表达烟酰胺单核苷酸腺苷酰转移酶能在体外显示较强的轴突保护功能。为证明我们实验性的形态学系统的完整性,一个高度特定的烟酰胺单核苷酸腺苷酰转移酶抑制剂,与以前下调NMNAT1的数据一致,在体外2nmol/L的FK-866抑制了树突形态的发育(图2A和2B)。总之,这些结果显示在皮层神经元NMNAT1和树突的发育密切相关,它能够在皮层神经元形态发育的早期促进树突的发育。
3 讨论
最近的研究发现烟酰胺腺嘌呤二核苷酸(NAD)合成酶烟酰胺单核苷酸腺苷酰转移酶1(NMNAT1)能够影响小鼠和果蝇的轴突Wallerian's变性。NMNAT1能保护神经元变性。然而NMNAT1在中枢神经系统神经元中的作用还不十分清楚,是否影响树突的发生也不清楚。NMNAT催化NAD的合成[1-2]。NAD在所有活细胞的新陈代谢中起关键作用,尤其是在中枢神经系统中作为辅酶参与大量转移反应[3],NMNAT1在 NAD 合成途径中是主要酶[4],NMNAT1显示广泛分布在被检组织中,包括脑组织的各个亚区[5]。因此,寻找NMNAT1在中枢神经系统中的作用很重要。
本研究我们研究了在体外NMNAT1在中枢神经系统神经元早期发育阶段对神经元形树突发育的影响。我们发现与转染了Scr-shRAN的神经元比较,NMNAT1KD-shRNA引起了树突分支的显著减少以及总长度的减少。且过表达NMNAT1促进了树突的生长,这和过去报道的培养的脊髓背根神经节的神经元相一致[6]。我们的数据表明NMNAT1在大脑中高水平表达,在体外培养的大脑皮质神经元中参与促进轴突和树突生长和复杂度的形态变化。总之,我们揭示了NMNAT1在神经元形态发生和神经退行性疾病中的一个重要作用。
树突异常和神经退行性疾病的病理特征一致。目前,大多数的研究集中于神经退行性疾病的遗传综合征,因为它们提供了可能了解中枢神经系统树突异常的病因机制[7]。
一项在果蝇的研究表明NMNAT1是作为一个伴护蛋白而起作用[8],关于 Wallerian's变性的几项研究显示,NMNAT1的NAD合成活动需要它对轴突的保护作用[9-13],然而对于中枢神经元树突是否有保护作用,尤其是神经元经历变性的过程时NMNAT1是否作为一个保护蛋白或酶而发挥功能知道的很少。因此,在不同的变性过程中,NMNAT1的不同功能特征将帮助我们理解它在神经退行性疾病中的作用。据我们所知,我们的结论是第一次展示了NMNAT1在中枢神经系统树突生长和成熟中所起的作用。这里关于树突形态异常与神经变性的发现以及以往的关于轴突异常与神经变性的关系支持这样的观点:NMNAT1失活在神经元发育的早期关键阶段影响轴突和树突形态发育,因此导致中枢神经系统的神经退化,然而,NMNAT1对神经形态和变性的影响机制还有待了解。
[1]Magni G,Amici A,Emanuelli M,et al.Enzymology of NAD+ homeostasis in man[J].CellMol Life Sci,2004,61:19-34.
[2]Magni G,Amici A,Emanuelli M,et al.Structure and function of nicotinamide mononucleotide adenylyltransferase[J].Curr Med Chem,2004,11:873-885.
[3]Berger F,Lau C,Dahlmann M,et al.Subcellular compartmentation and differential catalytic properties of the three human nicotinamide mononucleotide adenylyltransferase isoforms[J].J Biol Chem,2005,280:36 334-36 341.
[4]Lau C,Niere M,Ziegler M.The NMN/NaMN adenylyltransferase(NMNAT)protein family[J].Front Biosci,2009,14:410-431.
[5]Emanuelli M,Carnevali F,Saccucci F,et al.Molecular cloning,chromosomal localization,tissue mRNA levels,bacterial expression,and enzymatic properties of human NMN adenylyltransferase[J].J Biol Chem,2001,276:406-412.
[6]Zhai RG,Zhang F,Hiesinger PR,et al.NAD synthase NMNA T acts as a chaperone to protect against neurodegeneration[J].Nature,2008,452:887-891.
[7]Kaufmann WE,Moser HW.Dendritic anomalies in disorders associated with mental retardation[J].Cereb Cortex,2000,10:981-991.
[8]Watts RJ,Hoopfer ED,Luo L.Axon pruning during Drosophila metamorphosis:evidence for local degeneration and requirement of the ubiquitin-proteasome system[J].Neuron,2003,38:871-885.
[9]Zhai RG,Rizzi M,Garavaglia S.Nicotinamide/nicotinic acid mononucleotide adenylyltransferase,new insights into an ancient enzyme[J].Cell Mol Life Sci,2009,66:2805-2818.
[10]Raff MC,Whitmore AV,Finn JT.Axonal self-destruction and neurodegeneration[J].Science,2002,296:868-871.
[11]Yan T,Feng Y,Zheng J,et al.Nmnat2delays axon degeneration in superior cervical ganglia dependent on its NAD synthesis activity[J].Neurochem Int,2010,56:101-106.
[12]Luo L,O'Leary DD.Axon retraction and degeneration in development and disease[J].Annu Rev Neurosci,2005,28:127-156.
[13]Coleman M.Axon degeneration mechanisms:commonalityamid diversity[J].Nat Rev Neurosci,2005,6:889-898.

