HIF-1α在前列腺癌组织中的表达及与MVD的关系
闫红丽 张伟 安丰 张金立 郑冰 田红英 王薇
前列腺癌(prostatic cancer,PCa)是男性泌尿系统常见肿瘤。缺氧诱导因子-1α(hypoxia inducible factor-1,HIF-1α)是介导细胞对缺氧环境进行适应性反应的关键性转录调控因子[1]。其在多种恶性肿瘤及癌前病变中呈过度表达状态,被认为是肿瘤血管形成环节中的关键启动因子[2-4]。肿瘤微血管密度(microvessel density,MVD)是指对肿瘤血管最密集部位所进行微小血管计数,是目前最能反映肿瘤血管形成能力的指标之一,它与多种肿瘤的恶性行为、复发、转移密切相关[5]。国内对于HIF-1α与MVD之间的关系,目前尚无定论。本研究采用免疫组化SP法,对不同病理分级的72例前列腺癌组织HIF-1α进行检测、用八因子相关抗原(Ⅷ-R-Ag)标记MVD,探讨HIF-1α与前列腺癌血管生成的关系。
1 资料与方法
1.1 一般资料 选取河北大学附属医院泌尿外科2006年6月至2011年12月手术切除前列腺癌组织、前列腺针吸活检癌组织72例;患者年龄59~71岁,平均年龄61.12岁。术后立即取材,经10%中性甲醛固定,石蜡包埋,5μm连续切片4张,常规HE染色行病理组织学诊断,按世界卫生组织(WHO)建议使用的Mostofi分级方法,其中高分化20例,中分化28例,低分化24例。
1.2 主要仪器及试剂 Leica RM2125转轮石蜡切片机(上海徕卡仪器有限公司)、光学显微镜型号893799(日本OLYMPUS公司)。鼠抗人HIF-1α单克隆抗体(福州迈新生物技术开发公司);兔抗人八因子相关抗原(Ⅷ-R-Ag)多克隆抗体(北京中山生物技术有限公司);SP免疫试剂盒和羊血清(福州迈新生物技术开发公司);DAB显色试剂盒(福州迈新生物技术开发公司)。一抗稀释度:兔抗人Ⅷ-R-Ag多克隆抗体1∶200。H1F-1α为工作液。
1.3 免疫组织化学染色方法 采用Streptavidin Peroxdase Conjugated Method即SP法进行免疫组织化学染色,检测前列腺癌组织中HIF-1α的表达情况,并用Ⅷ-R-Ag标记前列腺癌组织MVD。实验步骤:切片常规二甲苯脱蜡,梯度酒精至水。以3%H2O2溶液室温下孵育10 min。将切片置于0.01 mmol/L枸椽酸钠缓冲液(pH值6.0)中或0.01 mmol/L EDTA组织抗原修复液(pH值8.0)中,医用微波炉抗原热修复。滴加正常山羊血清10μl。滴加适当比例稀释的一抗,4℃过夜(16~18 h)。加入生物素标记二抗。加入辣根酶标记链霉卵白素工作液。取二氨基苯联胺(DAB)试剂盒中的A、B、C三种试剂,滴入1 ml去离子水中混匀,滴加溶液显色。苏木素染细胞核,梯度酒精脱水、二甲苯透明、中性树胶封片。
1.4 结果判断 以阳性肿瘤细胞的百分比和染色强度综合评价判断免疫组化染色结果。阳性肿瘤细胞百分比通过400倍高倍镜下至少5个视野确定,按以下5个范围计分:阳性细胞百分数评分分别为:0分(0~4%),1分(5~24%),2分(25~49%),3分(50~74%)和4分(75~100%)。肿瘤细胞免疫染色的强度计分:无色为0分、浅黄色为1分、棕黄色为2分、棕褐色为3分;阳性肿瘤细胞的百分比和染色强度乘积的加权数,即免疫组化染色指数=阳性细胞百分数×染色强度。标准:0分为阴性(-),1~2分为弱阳性(+),3~4分为中等阳性(++),4分以上为强阳性(+++)。MVD:用八因子相关抗原单克隆抗体标记血管内皮细胞,癌细胞间质内有孤立的棕黄色血管内皮细胞、细胞簇或血管腔面积小于8个红细胞,且管壁无肌层代表1条单独的微血管。先在低倍视野下找肿瘤组织内MVD最高区域,然后在200倍视野下计数3个视野内的微血管数,再将总数除以3,取其平均值作为肿瘤该视野下的MVD。
1.5 统计学分析 应用SPSS16.0统计软件,数比较采用单因素方差分析(one-way ANOVA),计量资料以±s表示,采用t检验,计数资料采用χ2检验,相关性分析采用Spearman等级相关分析进行统计学检验,P<0.05为差异有统计学意义。
2 结果
2.1 HIF-1α在前列腺肿瘤细胞的表达情况 HIF-1α在肿瘤细胞胞核进行表达,部分肿瘤细胞胞质可见少量表达,其在肿瘤组织边缘或与正常组织交界处的细胞及坏死的肿瘤组织中多见。分化程度高的前列腺癌细胞胞核多数有棕黄色细颗粒,染色淡,阳性细胞少;分化程度低的前列腺癌细胞胞核棕黄色,着色较深,阳性细胞数目多。
2.2 不同级别前列腺癌组织HIF-1α的阳性表达及相关性本组72例前列腺癌组织HIF-1α的表达阳性率为69.4%(50/72)。在高分化、中分化和低分化的前列腺癌组织中HIF-1α的阳性表达率分别为95.83%、64.29%和45.00%,差异有统计学意义(χ2=52.06,P<0.01)。HIF-1α的表达和前列腺癌的病理分级有相关性(r=0.49,P<0.05),分化程度越低,HIF-1α表达越高。见表1,图1~3。

表1 前列腺癌组织HIF-1α的表达与病理分级关系 例

图1 低分化前列腺癌细胞中HIF-1α表达(SP×400)
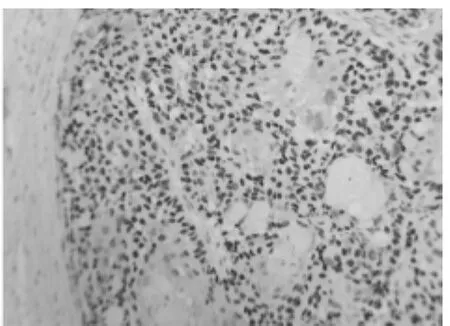
图2 中分化前列腺癌细胞中HIF-1α表达(SP×400)

图3 高分化前列腺癌细胞中HIF-1α表达(SP×400)
2.3 前列腺肿瘤微血管形态表现 内皮细胞形态各异,以大量芽状或细索状血管为主,血管床数目增多,分支紊乱,管腔不规则,管腔扩张或狭窄、变形,并缺乏完整的基底膜。
2.4 MVD在不同级别前列腺癌组织中的计数情况 MVD在高分化、中分化和低分化的前列腺癌组织中分别为11.40±2.70,29.00±1.87,49.20±2.86,MVD 在各级别前列腺癌组织之间表达差异有统计学意义(F=282.45,P<0.01)。
2.5 前列腺癌组织中HIF-1α的表达与MVD的关系 HIF-1α阳性表达组前列腺癌组织中MVD为48.20±3.27,HIF-1α阴性表达组的前列腺癌组织MVD为14.00±2.73,HIF-1α阳性组明显高于HIF-1α阴性组(F=321.73,P <0.01)。MVD的数值与HIF-1α的染色积分呈正相关(r=0.65,P<0.05)。
3 讨论
HIF-1是一个具有螺旋-环-螺旋结构的转录因子,它通过与靶基因的缺氧元件结合,调节细胞对缺氧的适应反应[6,7]。HIF-1由HIF-1α和HIF-1b两种亚单位构成。HIF-1α可能通过刺激肿瘤血管新生、维持肿瘤细胞能量代谢、促进肿瘤增值等引起肿瘤细胞侵袭、转移等生物学行为密切相关。Zhong等[8]对14例高级别前列腺上皮内瘤变组织进行免疫组化分析研究,发现HIF-1α表达明显增高。所以推断HIF-1α可能是潜在性评估前列腺癌前病变的生物标记物,有可能成为新的治疗靶点。Lekas等[9]报道与良性前列腺增生比较HIF-1α在前列腺癌组织中呈过度表达状态。HIF-1α在晚期前列腺癌病例中发现其表达明显上调[10]。其发病机制尚不明了。本研究证实HIF-1α在前列腺癌组织中呈过度表达状态,其临床分化越低其表达率越高。以上结果表明HIF-1α参与前列腺癌的发展、侵袭和转移。
肿瘤新生血管的生成在其发生、发展、侵袭、转移中起着重要作用。血管内皮生长因子(VEGF)是最重要的血管内皮生成诱导因子,它能够促进血管内皮细胞成熟并增加通透性。MVD是新生血管的重要衡量指标,与肿瘤细胞的增值和转移密切相关[11]。本研究证实微血管密度随着前列腺癌的恶性程度增加而增大,恶性程度越高微血管密度越大。反映出MVD与前列腺癌的分化程度相关。本实验发现以Ⅷ因子相关抗原染色肿瘤组织中肿瘤微血管的形态的特征,符合肿瘤组织微血管特点,肿瘤内新生血管以大量芽状或细索状血管为主,血管床数目增多,分支紊乱,管腔不规则,管腔狭窄、扩张或变形,且缺乏完整的基底膜,并且在部分高度恶性前列腺癌中,会出现肾小球状血管,内皮细胞的形态各异,呈现肿瘤新生血管的特征。微血管密度最高区域多数位于瘤组织与正常组织交界处,即所谓“浸润边缘”,所以该处是肿瘤细胞生长浸润最活跃的部位,这提示高密度的微血管能够给周边瘤细胞提供更充足的养分,从而加强浸润能力。同时,发现瘤旁区到正常区的微血管形态逐渐规整,数量呈逐渐减少。肿瘤新生血管基底膜缺乏或不完整,管壁薄弱,平滑肌不完整,故此血管结构易于发生自发性出血,有利于前列腺癌细胞穿过血管壁进入循环系统,是肿瘤浸润和转移的第一站,同时也是肿瘤血管促进转移的原因之一。因此前列腺癌血管生成不仅为肿瘤细胞离开原发灶进入循环提供途径,也为转移瘤的生了长创造条件,反映出肿瘤的侵袭性与诱导血管形成能力是平行的。
本研究通过分析HIF-1α与MVD的相关性证实HIF-1α和微血管密度密切相关,因此有可能HIF-1α作为缺氧的固有标志,将为肿瘤提供一个更为准确的检测手段和治疗靶点。这也提示临床可通过阻断HIF-1α的生成或促使其降解来降低前列腺癌细胞的生长、浸润和转移,为前列腺癌的治疗提供一种新思路。
1 Powis G,Kir Kpatrick L.Hypoxia inducible factor-Lalpha as acancer drug target.Mol Cancer Ther,2004,3:647-654.
2 Qiu MZ,Han B,Luo HY,etal.Expressions of hypoxia-inducible factorlalpha and hexokinase-Ⅱin gastric adenocarcinoma;the impact on prognosis and correlation to clinicopathologic features.Tumour Biol,2010.[Epub ahead of print]
3 Pistollato F,Rampazzo E,Persano L,etal.Interaction of hypoxia-inducible factor-Ialpha and notch signaling regulates medullo-blastoma precursor proliferaition and fate.Stem Cells,2010,28:1918-1929.
4 kong HS,Lee S,Beebe K,etal.Emetime promotes von Hippel-Lindau-independent degradation of hypoxia inducible factor-2{alpha}in clear cell renal carcinoma.Mol Pharmacol,2010,78:1072-1078.
5 Weidnr N,Carroll PR,Flax J,etal.Tumor angiogenesis correlates with metastasis in invasive prostste carcinoma.Am J Pathol,1993,143:401-409.
6 Pugh CW,Tan CC,Jones RW,etal.Functional analysis of anoxygen-regulattel tnanscriptional enhancer lying 3,to the mouse erythropoietin gene.Proc Natl Acad Sci USA,1991,88:10553-10557.
7 Semenza GL,Neifelt MK,Chi SM,etal.Hypoxia-inducible nuclear factors bind to an enhancer element located 3,to the human erythropoietin gene.Proc Natl Acad Sci USA,1991,88:5680-5684.
8 Zhong H,Semenza GL,Simons JW,etal.Up-regulation of hypoxia-inducible factor lalpa is an early event in pnstate careci-nogencsis.Cancer Detect Prev,2004,28:88-93.
9 Lekas A,Lazanis AC,Deliveliotis C,etal.The expression of hy-poxia-inducible factor-lalpha(HIF-1alpha)and angiogenesis markers in hyperplastic and malignant pnstaate tissue.Anti-cancer Res,2006,26:2989-2993.
10 Zhong H,De Marzo AM,Laughner E,etal.Overepression of hypoxia-inducible fsctor lalpa in common human cancers and their melastases.Cancer Res,1999,59:5830-5835.
11 Folkman J,Cotran R.Relation of vascular proliferation to tumor growth.Int Rxp PATHOL,1976,16:207-248.

