关于铜和浓硫酸反应的再探究
童 标
(江苏省黄埭中学 江苏 苏州 215143)
一、问题的提出
在高一化学中讲到浓硫酸的强氧化性时,我们会做铜片和浓硫酸反应的课堂演示实验。

作为教师我们有责任去思考并弄清楚以下几个问题:1.铜片表面一开始的黑色物质以及后来溶液中的黑浑物质到底是什么?能不能避免?2.能不能让学生在加热过程中始终都能看到明显的蓝色溶液?笔者拟从这两点出发做粗略探究,以期与同行交流讨论。
二、黑色物质的探究
已有的理论阐述:
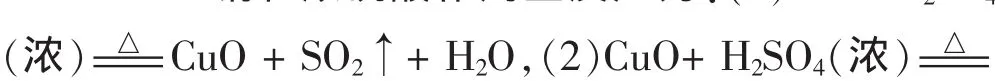

从上述两类解释可知,对于出现的黑色物质的主要成分有一些分歧。笔者的验证思路:首先从质量守恒中元素种类不变的角度出发猜测黑色物质的可能范围,经查阅资料发现 CuO、CuS、Cu2S、Cu2SO4的颜色均为灰黑色系列。其次分别查找这四种物质的性质,以期能找到区分它们的实验方法。下表物质性质经由网络化工引擎 http://www.chemyq.com/xz.htm 和百度百 科 http: //baike.baidu.com/view/1339650.htm 综 合查得:

CuO CuS Cu2S Cu2SO4棕黑色无定形粉末 黑色结晶粉末 灰黑色结晶或粉末 灰色固体溶于稀酸、氯化铵、碳酸铵和氰化钾溶液,溶于硝酸、热盐酸、硫酸、氰化钾, 溶于硝酸、稍溶于氨水 溶于水或加热发生歧化反应(Cu2SO4 → Cu+CuSO4)不溶于水和醇 不溶于水、醇、碱 不溶于水和稀酸
由上表可见:先用水洗涤黑色固体看是否溶解就能轻易分辨出是否为Cu2SO4;如果不溶于水就用稀盐酸(加热)将CuO、CuS与Cu2S区分开来;如果溶解于稀盐酸(加热)则可通过实验过程中有无臭鸡蛋气味气体放出细分出CuO与CuS;如果不溶于稀盐酸(加热)则还可以通过浓氨水来辅助对Cu2S的确认。
3.具体实验和结果汇总
说明:以下实验所用小铜片约为 0.6cm×0.5cm,约0.07g,中铜片约为 1cm×1.1cm,约 0.33g,浓硫酸为新开封,稀盐酸为浓盐酸与水1∶2体积比配制,大试管容积约为 45~50mL。。

表1 铜片刚刚变黑时表面物质的验证

表2 出现大量黑混时黑色颗粒的验证

表3 持续加热的意外发现
笔者为了排除实验中偶然因素的影响,多次重复了上述实验,所得现象基本相似。由此初步得出:黑色物质在不同阶段有不同的组成——铜片表面刚变黑时该黑色物质主要为CuS,而如果后期溶液中出现的大量黑浑物质主要是Cu2S。
三、实验改进的尝试
从课堂演示实验的可见性和目的引导性出发,笔者认为对该实验改进的方向应该是:能使学生在整个实验过程中较长时间地观察到清晰的蓝色溶液的现象,尽可能减少黑浑现象的干扰。
1.能否让铜片表面不变黑?
铜片表面在反应开始时出现的黑色物质是希望避开的,因为这会干扰学生对书本给出的方程式的理解。笔者初步怀疑是温度上升过快过高导致,为此进行了如下尝试:
2.如何能减少溶液黑浑现象的干扰?即让加热过程中蓝绿色溶液的现象清晰和延长?笔者从铜片和浓硫酸的配比上做了如下实验尝试:

表4 缓热时铜片表面的颜色变化

表5 铜片(均为1片小铜)与浓硫酸不同比例加热过程中蓝绿色的持续时间

表6 冷却后的意外发现
四、实验小结
笔者在现有中学化学实验条件下通过对浓硫酸和铜片反应的再探究,只能得出一些较为粗糙的初步结论:①铜片表面要产生明显气泡,则其表面变黑难以避免。但调整好浓硫酸的用量,不仅可以使溶液始终呈现蓝绿色,而且还能避免黑浑现象。②出现的黑色物质的主要成分呈阶段性:即铜片表面初期变黑时的黑色物质主要为CuS。而当铜片较多浓硫酸较少时,后期溶液中出现的黑浑物质主要为Cu2S。限于实验条件和本人研究水平,文中有些操作和观点尚有欠缺,希望同行能批评指正。
[1] 黄佩丽编.无机元素化学实验现象剖析[M].北京:北京师范大学出版社,1990.4:93
[2] 王祖浩,吴星主编.高中化学教学参考书 化学1(必修)[M].南京:江苏教育出版社,2007.6:92

