绿色荧光蛋白基因标记棉花黄萎病菌
徐 明, 桂月晶, 祁伟彦, 柳少燕, 陈捷胤, 戴小枫
(中国农业科学院农产品加工研究所,北京 100193)
大丽轮枝菌(VerticilliumdahliaeKleb.)是引起棉花黄萎病的主要病原菌,可导致棉花叶片变黄萎蔫甚至枯死,给棉花生产带来了巨大的经济损失。我国棉花黄萎病尤为严重,已经成为棉花生产上第一大病害,尤其是1993、1995、1996和2003年的大暴发,导致棉田损失惨重,严重的田块甚至绝收[1-3]。它同时还危害番茄、茄子、辣椒、黄瓜、莴苣等200多种主要经济作物,是典型的土传性维管束真菌病害[4-5]。大丽轮枝菌是一种丝状真菌,分类学上属于子囊菌门(Ascomycota)、粪壳菌纲(Sordariomyce-tes)、黑痣菌目(Phyllachorales)、丛梗孢科(Moniliaceae)、轮枝菌属(Verticillium)[4]。野生型大丽轮枝菌在马铃薯葡萄糖培养基上的培养性状为圆形菌落,产生白色菌丝、大量黑色微菌核的黑色菌落或者介于两者之间的中间形态,培养型和菌株的致病力无显著关联[6-7]。
绿色荧光蛋白(green fluorescence protein,GFP)大量应用于多种细菌、真菌、植物和哺乳动物细胞的研究[8],其表达不需要任何外源底物或辅助因子,对细胞的正常生长和功能等没有毒性,在荧光显微镜或紫外光下能直接检测到绿色荧光,具有快速、方便、动态监测、定量分析等优点[8]。绿色荧光蛋白在植物病理学中有着广泛应用,包括抗病基因亚细胞定位、启动子活性分析、基因表达分析、病原菌与植物互作研究等,尤其是用于跟踪病原菌侵染寄主途径的研究,可直观、实时监测病原菌的发生、定殖和侵染过程[9-10]。如利用GFP标记的烟草疫霉(Phytophthoraparasiticavar.nicotianae)研究其侵染烟草过程中的生长动态和与寄主互作方式[11];应用GFP基因标记大丽轮枝菌研究其在莴苣整个生长期侵染的情况[12];利用GFP标记马铃薯细菌性软腐病菌(Dickeyasp.)研究其侵染情况和在整个植株中的动态变化情况[13];观察尖孢炭疽菌(Colletotrichumacutatum)侵染草莓的规律[14];跟踪香蕉黑条叶斑病菌(Mycosphaerellafijiensis)、香蕉黄条叶斑病菌(M.musicola)和斑枯病菌(M.eumusae)在叶片组织中的生长动态以及随着菌丝侵入引起叶片逐渐褪绿和坏死过程[15];检测大豆疫霉对大豆叶片、下胚轴和根部的侵染行为[16]。在大丽轮枝菌研究方面,已经成功构建绿色荧光蛋白基因的大丽轮枝菌,并对莴苣、马铃薯、花椰菜、菠菜等寄主的侵染过程进行了研究[17-20]。因此,GFP标记已经成为研究病原菌与植物互作的有力工具,避免了传统组织印迹法、放射性标记核酸探针法、GUS染色法等非活体检测的局限性,极大地推动了病原菌致病机理的研究。
本研究的主要工作是将克隆的荧光蛋白基因sGFP连接到pCTHyg上,构建带有绿色荧光蛋白标记的载体p CH-sGFP;通过农杆菌介导的大丽轮枝菌遗传转化和筛选,获得带有荧光蛋白表达的大丽轮枝菌转化株;进一步通过表型鉴定和对棉花的致病力检测,筛选到绿色荧光蛋白表达稳定、发光强、表型和致病力与野生型类似的sGFP标记大丽轮枝菌,为下一步观察大丽轮枝菌侵染棉花过程的组织学和致病机理研究提供材料。
1 材料与方法
1.1 材料
供试棉种为高感黄萎病‘军棉1号’(Gossypiumhirsutum‘Junmian 1’)。棉花高致病性大丽轮枝菌Vd991为中国农业科学院植物保护研究所简桂良研究员馈赠,根癌农杆菌AGL-1由本实验室保存。携带有绿色荧光蛋白基因sGFP的质粒gGFP购自美国真菌遗传学信息中心(Fungal Genetics Stock Center,American),质粒pCTHyg为本试验室构建。
1.2 绿色荧光蛋白表达载体构建
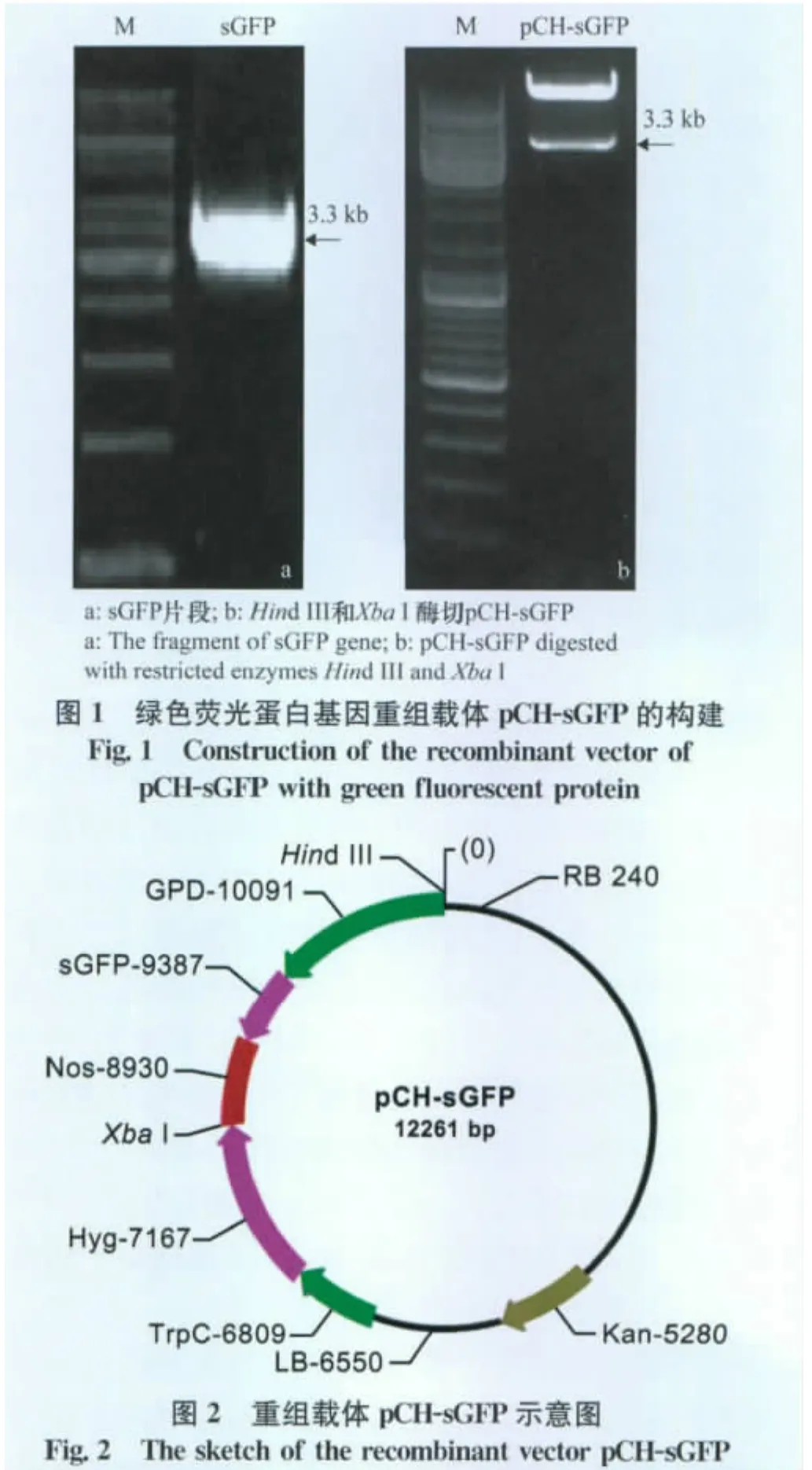
根据质粒gGFP序列信息设计带有HindⅢ和XbaⅠ酶 切 位 点 的 引 物 (gGFP-F:AAGCTTCTTTCGACACTGAAATACGTCG;gGFP-R:TCTAGAGCATCAGAGCAGATTGTACTGAGAG),以质粒gGFP为模板,扩增获得带有构巢曲霉GPD启动子和Nos终止子的绿色荧光蛋白标记基因sGFP(扩增条件:94℃10 min;94℃30 s,60℃30 s,72℃3.5 min,循环36次;72℃10 min),随后利用HindⅢ和XbaⅠ酶切位点将GPD-sGFP-Nos片段整合到p CTHyg载体,获得重组载体pCH-sGFP。
1.3 大丽轮枝菌遗传转化
农杆菌介导的大丽轮枝菌遗传转化参照Mullins等的方法进行[21]。将pCH-sGFP载体导入农杆菌AGL-1,挑取克隆接种于 MM 培养基[22],28℃振荡培养48 h,离心收集菌体并用IM液体培养基[23]重悬并稀释至A600≈0.15,加入乙酰丁香酮至200μmol/L,继续振荡培养至A600≈0.5。大丽轮枝菌接种于CM 液体培养基[24],25 ℃,150 r/min振荡培养4 d后稀释孢子悬浮液浓度至5×106个/m L。等比例混合制备好的农杆菌和孢子悬浮液后,吸取200μL混合菌液涂布于含有200μmol/L乙酰丁香酮的IM固体培养基,支撑膜为微孔滤膜。25℃培养48 h后将微孔滤膜转移至含有200μg/m L头孢霉素和30μg/mL潮霉素的PDA培养基(去皮马铃薯,200 g/L;葡萄糖,20 g/L;琼脂,15 g/L),继续培养直至转化子菌落出现。
1.4 绿色荧光蛋白标记的大丽轮枝菌的筛选
挑取转化子于无菌水中,在含有抗性的培养基中单孢分离3代。选取9个转化子进行分子鉴定。基因组提取采用天根公司的DNA提取试剂盒(DP320-02),根据sGFP基因设计引物(sGFP-F:ATGGTGAGCAAGGGCGAGG;sGFP-R:TTCTGCTGGTAGTGGTCGGC)并进行PCR扩增(扩增条件:94 ℃ 10 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃1 min,循环30次;72℃10 min),筛选阳性转化子。
1.5 绿色荧光蛋白标记的大丽轮枝菌的荧光检测和表型鉴定
用无菌牙签刮取少量菌丝于载玻片上的无菌水中,置于激光共聚焦扫描显微镜(Leica TCS SP2,Germany)下进行荧光检测,激发光波长为488 nm,发射波长为540 nm,野生型Vd991为对照。
选取荧光信号较强的4个转化子,以野生型菌株Vd991为对照,吸取20μL孢子悬浮液(5×106个/m L)涂布于含有30μg/m L潮霉素的PDA平板中,置于25℃ 恒温培养12 d,观察转化子生长表型;吸取5μL的大丽轮枝菌孢子悬浮液对感病棉种‘军棉1号’进行穿刺接种,参照Alcazar等方法进行[25],穿刺15株,3个重复,接菌后的第2、3、4、5和6周调查病情。分级标准为:0级—健株,子叶、真叶无病状;1级—1片子叶发病;2级—2片真叶发病;3级—3片及3片以上真叶发病;4级—棉苗所有叶片发病,生长点枯死。病情指数=100×∑(各级病叶数×各级代表值)/(调查总叶数×最高级代表值)。筛选表型、致病力均与野生型Vd991一致的sGFP标记转化子。
1.6 绿色荧光蛋白标记大丽轮枝菌侵染棉花的发光检测
感病棉种‘军棉1号’种子于5%NaCl O溶液中处理20 min,无菌水清洗后转移到盛有适量无菌水的三角瓶,25℃浸泡萌发。萌发后的种子种植于经高压灭菌2 h的蛭石中继续培养(光周期14 h,白天25℃,晚上21℃,相对湿度85%),直至子叶平展。
制备带有绿色荧光蛋白基因标记的大丽轮枝菌的孢子悬浮液(5×106个/m L),幼苗根系用无菌水冲洗后置于孢子悬浮液中浸泡2 min,随后转移到新灭菌的蛭石中继续培养,接菌14 d后取样。用无菌刀片对棉苗茎部组织进行徒手切片,厚度约100μm。借助激光共聚焦扫描显微镜观察大丽轮枝菌侵染过程绿色荧光蛋白的发光情况,激发光波长为488 nm,发射光波长分别为540 nm和560~670 nm。
2 结果与分析
2.1 绿色荧光蛋白基因的重组载体构建
以gGFP为模板,利用引物gGFP-F/R进行PCR扩增获得 GPD-sGFP-Nos片段,约3.3 kb(图1a)。经HindⅢ和XbaⅠ双酶切连接到pCTHyg载体上,酶切验证获得携带有GPD-sGFP-Nos基因元件的重组载体pCH-sGFP(图1b)。重组载体pCH-sGFP中增强型绿色荧光蛋白基因sGFP以构巢曲霉GPD为启动子,抗性筛选标记基因Hyg以TrpC为启动子,2个基因均以Nos为终止子(图2)。
2.2 绿色荧光蛋白基因的整合与转化子筛选
重组载体pCH-sGFP导入到农杆菌AGL-1,并通过遗传转化后获得大丽轮枝菌转化子208个(图3a、b)。随机选取9个转化子进行单孢分离,对第3代的转化子进行了PCR验证。结果表明,所挑选的9个转化子的sGFP均成功整合到大丽轮枝菌基因组中(图3c),获得了绿色荧光蛋白标记的大丽轮枝菌。
2.3 绿色荧光蛋白标记大丽轮枝菌的荧光检测
对9个已经整合sGFP的大丽轮枝菌转化子进行荧光检测发现,Vd-gfp19、Vd-gfp77、Vd-gfp80和Vd-gfp107无论是处于孢子阶段还是菌丝阶段均能表达绿色荧光蛋白,其中Vd-gfp77最为显著,孢子和菌丝均能发出强烈的荧光信号(图4a、b、c、d)。在无潮霉素抗性选择压力下连续继代(5代)的大丽轮枝菌Vd-gfp19、Vd-gfp77、Vd-gfp80和 Vd-gfp107,转接后均能在含有潮霉素抗性的培养基正常生长,且均能产生绿色荧光信号,其中Vd-gfp77的荧光信号表现较为稳定和均一(图4e)。
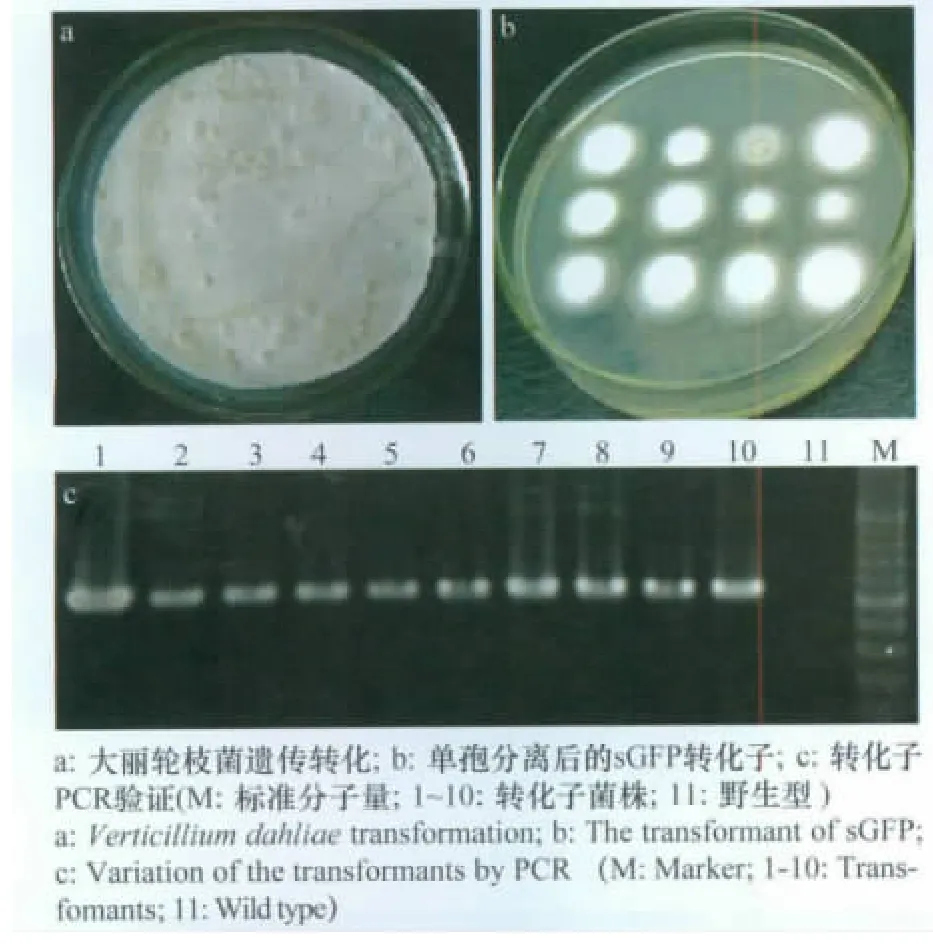
图3 重组载体pCH-sGFP的转化及转化子验证Fig.3 Transformation of the recombinant vector pCH-sGFP and transformants variation
2.4 绿色荧光蛋白标记大丽轮枝菌表型与致病力测定
对 Vd-gfp19、Vd-gfp77、Vd-gfp80 和 Vd-gfp107转化子的表型进行检测,绿色荧光蛋白标记的大丽轮枝菌在PDA培养基上的生长形态与野生型Vd991类似(图5a),如 Vd-gfp19、Vd-gfp77和 Vdgfp107的形态均为圆形、白色、气生菌丝发达且致密(图5b、c和e)。但绿色荧光蛋白标记的大丽轮枝菌Vd-gfp80的表型则发生了显著变化,在PDA培养基上表现为产生黑色素的特性(图5d)。结合Vdgfp77绿色荧光的稳定性和均一性以及生长表型的一致性,选择其作为侵染过程研究的候选绿色荧光蛋白标记的大丽轮枝菌。
进一步对绿色荧光蛋白标记的大丽轮枝菌Vdgfp77的致病力进行鉴定,与野生型Vd991类似,侵染2周后感病棉种即开始发病,病情指数为37.77;此后,病情迅速扩展,各周调查的病情指数与野生型Vd991相似;侵染6周后,野生型Vd991侵染棉花的病情指数为78.33,Vd-gfp77侵染棉花的病情指数为78.78(图6b),而且两者均引起了棉花叶片萎蔫变黄和落叶的典型黄萎病症状(图6c、d)。结果说明,sGFP整合到Vd991基因组对其自身的特性影响很小,Vd-gfp77是一株类似于野生型Vd991的高致病力绿色荧光蛋白标记的大丽轮枝菌。


图6 绿色荧光蛋白标记大丽轮枝菌Vd-gfp77的致病力测定Fig.6 Virulence of the transformant Vd-gfp77 to cotton plants
2.5 绿色荧光蛋白标记的大丽轮枝菌Vd-gfp77侵染棉花过程的荧光检测
为了检测绿色荧光蛋白标记的大丽轮枝菌在活体侵染条件的稳定性,对Vd-gfp77侵染感病棉花的组织学进行了初步研究。侵染14 d后,组织切片观察发现,大丽轮枝菌Vd-gfp77侵染棉花后可借助于激光共聚焦显微镜进行观察,定殖与扩展的菌丝富集在根冠区(图7a)和维管束(图7b),而且可以明显观察到萌发的孢子(图7c)。结果说明,高致病力绿色荧光蛋白标记的大丽轮枝菌Vd-gfp77类似于Vd991,可快速侵染棉花并在侵染过程中表达绿色荧光蛋白。至此,本研究成功构建了适合用于侵染植物(棉花)过程组织学研究的绿色荧光蛋白标记的大丽轮枝菌。

图7 Vd-gfp77侵染棉花过程的荧光检测Fig.7 Detection of fluorescence in cotton plants inoculated with Vd-gfp77
3 讨论
绿色荧光蛋白基因整合到大丽轮枝菌基因组中,由于插入位置效应可能引起生长异常或者致病力丧失,不适宜用于后续研究。本试验采用了p CTHyg载体构建了含有绿色荧光蛋白基因的载体pCH-sGFP(图1、图2),通过农杆菌介导的遗传转化法成功导入到大丽轮枝菌并获得了阳性转化株(图3),骨架载体采用了潮霉素作为筛选标记在大丽轮枝菌中已经得到成功和广泛应用[26]。这为本试验成功获得大量的遗传转化子提供了保障,便于筛选获得表型稳定和致病力正常的菌株。
绿色荧光蛋白的荧光性质具有稳定、直观、操作方便和无需添加外源底物即可直接检测等优点,已经广泛应用于病原菌与寄主植物互作的研究[8-10,16]。通过改造也衍生出了不同的增强型荧光蛋白,如将第65位丝氨酸突变成苏氨酸,其荧光强度较野生型GFP强5倍[27],在病原菌与植物互作研究过程中显示了独特的优越性。在大丽轮枝菌研究方面,已有研究报道对从莴苣、马铃薯、花椰菜、菠菜等分离出的菌株进行了荧光标记并开展侵染过程研究[17-20],但对危害严重的棉花的侵染研究鲜有报道,究其原因是棉花组织的木质化程度较高,侵染过程中报告基因的荧光强度受到影响且稳定性差,加上棉花根部的本底荧光较强,严重干扰了研究结果的稳定性和重现性,如利用标记棉花大丽轮枝菌(落叶型的V07DF2和非落叶型的Bp2)接种寄主棉花上(‘泗棉3号’),由于本底荧光的影响,导致很多细节无法分辨[28]。本研究应用改良的增强型绿色荧光蛋白sGFP具有荧光信号强、遗传稳定等优点,筛选获得的Vd-gfp77转化株生长表型正常,致病力与野生型菌株相比无显著差异,侵染寄主棉花后随着大丽轮枝菌的繁殖传代,仍能稳定表达并发出强烈的荧光信号,受棉花组织本底荧光的影响小,易于检测,可以满足后续大丽轮枝菌侵染棉花的组织学过程研究。此外,本研究构建的绿色荧光蛋白表达载体和菌株也可以应用于基因的亚细胞定位、启动子活性分析、基因表达分析、基因功能和寄主蛋白等研究。
本研究构建了增强型绿色荧光蛋白重组质粒pCH-sGFP,通过农杆菌介导遗传转化法获得了绿色荧光蛋白标记的大丽轮枝菌,筛选到一株具有强烈荧光信号的转化株Vd-gfp77,其表型和对棉花的致病力与野生型Vd991类似,连续传代后抗性筛选标记、荧光信号、表型和致病力均能够稳定遗传,侵染棉花后绿色荧光蛋白表达稳定,由此获得了适合用于侵染植物(棉花)过程组织学研究的绿色荧光蛋白标记的大丽轮枝菌。
[1]杜威世,杜雄明,马峙英.棉花黄萎病抗性遗传和分子生物学研究进展[J].棉花学报,2002,14(5):311-317.
[2]简桂良,邹亚飞,马存.棉花黄萎病连年流行的原因及对策[J].中国棉花,2003,30(3):13-14.
[3]杨华,蔡立旺,潘群斌,等.棉花黄萎病研究进展浅述[J].江西棉花,2006,28(6):3-6.
[4]Fradin E F,Thomma B P.Physiology and molecular aspects ofVerticilliumwilt diseases caused byV.dahliaeandV.albo-atrum[J].Molecular Plant Pathology,2006,7(2):71-86.
[5]Klosterman S J,Subbarao K V,Kang S,et al.Comparative genomics yields insights into niche adaptation of plant vascular wilt pathogens[J].PLoS Pathogens,2011,7(7):e1002137.
[6]朱荷琴,宋晓轩,孙君灵,等.棉花黄萎病菌安阳菌系致病类型变异研究[J].棉花学报,1999,11(6):312-317.
[7]林玲,章如意,张昕,等.江苏省棉花黄萎病菌的培养特性及致病力分化监测[J].棉花学报,2012,24(3):199-206.
[8]Chalfie M,Tu Y,Euskirchen G,et al.Green fluorescent protein as a marker for gene expression[J].Science,1994,263(5148):802-805.
[9]Li X Z,Zhou T,Yu H.Transformation ofBotrytiscinereawith a green fluorescent protein(GFP)gene for the study of host-pathogen interactions[J].Journal of Plant Pathology,2006,6:134-140.
[10]蒋明,吕枷薪,黄余磊,等.绿色荧光蛋白在植物病理学研究中的应用[J].植物保护,2011,37(5):39-43.
[11]Bottin A,Larche L,Villalba F,et al.Green fluorescent protein(GFP)as gene expression reporter and vital marker for studying development and microbe-plant interaction in the tobacco pathogenPhytophthoraparasiticavar.nicotianae[J].FEMS Microbiology Letters,1999,176(1):51-56.
[12]Vallad G E,Subbarao K V.Colonization of resistant and susceptible lettuce cultivars by a green fluorescent protein-tagged isolate ofVerticilliumdahliae[J].Phytopathology,2008,98(8):871-885.
[13]Czajkowski R,de Boer W J,Velvis H,et al.Systemic colonization of potato plants by a soilborne,green fluorescent protein-tagged strain ofDickeyasp.biovar 3[J].Phytopathology,2010,100(2):134-142.
[14]Horowitz S,Freeman S,Sharon A.Use of green fluorescent protein-transgenic strains to study pathogenic and nonpathogenic lifestyles inColletotrichumacutatum[J].Phytopathology,2002,92(7):743-749.
[15]Balint-Kurti P J,May G D,Churchill A C.Development of a transformation system forMycosphaerellapathogens of banana:a tool for the study of host/pathogen interactions[J].FEMS Microbiology Letters,2001,195(1):9-15.
[16]陈孝仁,程保平,王新乐,等.利用绿色荧光蛋白研究大豆疫霉与大豆的互作[J].科学通报,2009,54(13):1894-1901.
[17]Andire R M,Martinez J P,Ciuffeth L M.Development of Tox A and Tox B promoter driven fluorescent protein expression vectors for rise in filamentous ascomyceles[J].Mycologia,2005,97(5):1152-1161.
[18]Vallad G E,Subbarao K V.Colonization of resistant and susceptible lettuce cultivars by a green fluorescent protein tagged isolate ofVerticilliumdahliae[J].Phytopathology,2008,98(8):871-885.
[19]Maruthachalam K,Klosterman S J,Anchieta A,et al.Colonization of spinach byVerticilliumdahliaeand effects of pathogen localization on the efficacy of seed treatments[J].Phytopathology,2013,103(3):268-280.
[20]Njoroge S M,Vallad G E,Park S Y,et al.Phenological and phytochemical changes correlate with differential interactions ofVerticilliumdahliaewith broccoli and cauliflower[J].Phytopathology,2011,101(5):523-534.
[21]Mullins E D,Kang S.Transformation:a tool for studying fungal pathogens of plants[J].Cellular and Molecular Life Sciences,2001,58(14):2043-2052.
[22]Bundock P,den Dulk-Ras A,Beijersbergen A,et al.Transkingdom T-DNA transfer fromAgrobacteriumtumefacienstoSaccharomycescerevisiae[J].EMBO Journal,1995,14(13):3206-3214.
[23]Hooykaas P J J,Roobol C,Schilperoort R A.Regulation of the transfer of TI plasmids ofAgrobacteriumtumefaciens[J].Journal of General Microbiology,1979,110:99-109.
[24]Rauyaree P,Ospina-Giraldo M D,Kang S,et al.Mutations inVMK1,a mitogen-activated protein kinase gene,affect microsclerotia formation and pathogenicity inVerticilliumdahliae[J].Current Genetics,2005,48(2):109-116.
[25]Bejarano-Alcázar J,Blanco-lópez M A,Melero-Vara J M,et al.Etiology,importance,and distribution ofVerticilliumwilt of cotton in southern Spain[J].Plant Disease,1996,80:1233-1238.
[26]徐荣旗,汪佳妮,陈捷胤,等.棉花黄萎病菌T-DNA插入转化子表型特征和侧翼序列分析[J].中国农业科学,2010,43(3):489-496.
[27]Heim R,Cubitt A B,Tsien R Y.Improved green fluorescence[J].Nature,1995,6516:663-664.
[28]邓晟,王彩月,张昕,等.大丽轮枝菌的绿色荧光蛋白标记[J].江苏农业学报,2012,28(5):1197-1199.

