低强度超声对Rhodotorula mucilaginosa Z1降解硝基苯的强化作用
金 若 菲, 柳 广 飞, 王 竞, 滕 丽 曼, 周 集 体
(1.大连理工大学 工业生态与环境工程教育部重点实验室,辽宁 大连 116024;2.大连理工大学 环境学院,辽宁 大连 116024)
0 引 言
生物学研究表明,低频率(20~50kHz)低强度(声强小于10W/cm2)的超声具有独特的生物效应,它不会破坏细胞的完整结构,能提高酶的活性,促进细胞生长,提高细胞膜的通透性[1-2],同时还可提高基因转化和表达等[3-5].Lin等发现利用低功率的超声(功率密度<113.9mW/cm2,照射周期1~8min)辐照紫草细胞可以显著增加紫草素合成量并增加细胞膜的通透性[6].Pitt等发现低频率低强度的超声(70kHz,2W/cm2)可以增加表皮葡萄球菌细胞的增殖速度[7].一般认为这些生物效应主要是由超声空化作用和机械传质作用引起的,同时这些效应的表现在不同种群的微生物中差异很大[8].
近年来,研究者将低强度超声引入活性污泥这种复杂的微生物生态系统中对生物处理过程进行强化,利用其生物效应,提高生物活性和处理效果,增加容积负荷.Zhang等利用低强度超声强化SBR反应器考察不同碳氮比条件下的脱氮效果,在碳氮比为5∶1时,经过超声处理后污泥的负荷分别提高44.6%和50%,同时超声对其微生物群落结构也有很大的影响,超声强化组的群落结构简单且稳定[9].Xie等研究表明0.1~1.2W/cm2的超声对生物硝化作用影响不显著而对反硝化的强化作用明显,反硝化速率提高16%[10].以上研究证明了低强度超声对生物降解作用的强化,但对其强化机理的分析,一般只是简单引用医学和生物学研究结论.超声对活性污泥中微生物活性和新陈代谢的影响规律及超声作用参数的选取原则还需深入研究.
本文以一株对硝基苯具有高效降解能力的黏性红圆酵母(RhodotorulamucilaginosaZ1,R.mucilaginosaZ1)为研究对象,在其对硝基苯降解过程中,考察超声强化作用对菌种的增殖、细胞膜的通透性及关键酶活性的影响,以期对超声强化的效果及作用机理有深入的了解.
1 材料与方法
1.1 菌株及废水
R.mucilaginosaZ1由本研究室分离纯化,该菌可以以硝基苯为唯一碳、氮源生长,目前保藏于中国普通微生物菌种保藏中心,编号为CGMCC No1758[11].
实验用硝基苯废水为模拟废水,其组成为不同浓度的硝基苯、0.002g/L柠檬酸铁、0.01g/L CaCl2·2H2O、0.02g/L MgSO4·7H2O、1.0g/L KH2PO4、7.0g/L Na2HPO4·12H2O.
1.2 超声强化降解实验
超声强化降解实验在500mL无菌三角烧瓶中进行,将活化后的R.mucilaginosaZ1投加到模拟硝基苯废水中,使反应体积为300mL,用棉花塞密封.首先在超声清洗机上进行超声辐照处理,处理条件为25kHz,180W,25℃,15min.处理后体系移到30℃恒温摇床中进行降解实验,定时取样测定硝基苯的降解及R.mucilaginosaZ1的生长情况,同时以不进行超声处理的体系作为对照.
1.3 硝基苯及菌体浓度的测定方法
硝基苯浓度的测定采用紫外可见分光光度法,即在268nm处测其吸光度,然后根据质量浓度与吸光度的回归方程计算其浓度.
R.mucilaginosaZ1的生长量用降解体系660nm处的吸光度表示.
1.4 R.mucilaginosa Z1中粗酶含量及酶活的测定
收集不同降解时间的菌体,用Na3PO4缓冲溶液(pH=7.2,20mmol/L)洗涤后离心(4 ℃,12 000g,10min).4 ℃下破碎后离心(4 ℃,12 000g,20min),上清液即为粗酶,用考马斯亮蓝G-250染色法测定粗酶浓度.
酶活的测定体系为0.3~1.0mg粗酶,0.3 μmol邻苯二酚或2-氨基苯酚,用Tris-HCl缓冲溶液(50mmol/L,pH=8.0)定容至3mL.检测260nm处顺,顺-己二烯二酸的吸光度(邻苯二酚-1,2-双加氧酶的酶活)、375nm 处2-羟基粘康酸半缩醛的吸光度(邻苯二酚-2,3-双加氧酶的酶活)及380nm处2-氨基粘康酸半缩醛的吸光度(2-氨基苯酚-1,6-双加氧酶的酶活)[12-13].
1.5 硝基苯在R.mucilaginosa Z1细胞内外的分布及降解率计算
硝基苯在R.mucilaginosaZ1细胞外、内及细胞膜上的浓度分布测定方法见文献[14-15].计算表观降解率和真实降解率为


式中:ρ1为初始硝基苯浓度,ρ2、ρ3、ρ4分别为R.mucilaginosaZ1细胞外、内及细胞膜上的硝基苯浓度.
2 结果与讨论
2.1 超声对硝基苯降解及R.mucilaginosa Z1生长的影响
配制浓度分别为105.0、304.5、589.5mg/L硝基苯模拟废水,考察低强度超声的辐照作用对不同浓度硝基苯的降解影响,同时测定浓度为589.5mg/L的硝基苯废水降解过程中菌体的生长量,实验结果如图1所示.
由图1可知,对于初始浓度为105.0mg/L硝基苯的降解,低强度超声的强化作用不明显,超声组和对照组在10h左右去除率都达到了90%以上.对于初始浓度为304.5mg/L硝基苯,低强度超声具有一定的强化效果,超声组在15h时降解率达到了90%,而对照组在20h的时候才达到,说明超声提高了降解速率,但两者的最终去除率类似,都可以达到92%.对于初始浓度为589.5 mg/L硝基苯,低强度超声的强化作用更加明显,尤其是在降解的前8h中,超声组和对照组的降解率分别为44.2%和25.4%,超声组可以显著提高R.mucilaginosaZ1对高浓度硝基苯的适应性,而对照组的降解存在着很大的抑制,但与中浓度硝基苯的降解类似,超声只是提高了降解速率,并没有提高最终的去除率,两者最终的去除率均可以达到89%.

图1 R.mucilaginosa Z1对不同初始浓度硝基苯的降解情况Fig.1 Degradation of different concentrations of nitrobenzene by R.mucilaginosa Z1
测定初始浓度为589.5mg/L硝基苯降解体系中菌体的生长情况,与降解效果一致,超声组由于降解速率较高,其生长速率也较快,但菌体的最终OD660均可达到0.56左右,说明R.mucilaginosaZ1可以很好地利用硝基苯作为唯一碳、氮源生长,但超声作用并没有提高菌体的生长量.
2.2 超声对R.mucilaginosa Z1粗酶含量的影响
将降解结束的超声组及对照组中的R.mucilaginosaZ1收集,测定其粗酶含量.经测定,对照组和超声组R.mucilaginosaZ1的粗酶含量分别为20.97mg/L和23.12mg/L,超声组释放的粗酶较对照组增加了10%.可能是超声对菌体产生刺激,菌体为了应对这种来自外界的刺激,产生应激反应,改变体内某些蛋白的合成过程,使蛋白合成量增加.
2.3 超声对R.mucilaginosa Z1酶活的影响
考察不同降解时间,R.mucilaginosaZ1的邻苯二酚-1,2-双加氧酶、邻苯二酚-2,3-双加氧酶和2-氨基苯酚-1,6-双加氧酶酶活的变化,硝基苯初始浓度为589.5mg/L,结果如图2所示.
由图2可知,无论是超声组还是对照组,都是以2-氨基苯酚-1,6-双加氧酶的活性为主,酶活在0.13~0.42U·mg-1变化,而邻苯二酚-1,2-双加氧酶和邻苯二酚-2,3-双加氧酶的酶活在0.003~0.012U·mg-1变化,说明R.mucilaginosaZ1对硝基苯的降解遵循的是部分还原氧化途径,超声强化作用并没有改变其降解途径.同时在整个降解过程中超声组的2-氨基苯酚-1,6-双加氧酶的活性均比对照组高,最高可以达到0.42U·mg-1,平均比对照组高出8.8%,说明菌体为了抵御超声这种外界刺激提高了降解酶的活性.
2.4 R.mucilaginosa Z1细胞内外硝基苯浓度的分布情况
配制不同的硝基苯模拟废水,其浓度分别为105.0、183.0、304.5、523.8、589.5mg/L,在降解10h时分别测定R.mucilaginosaZ1细胞内、外及细胞膜上硝基苯浓度的分布情况,如表1所示.
由表1可知,对于不同初始浓度,硝基苯在细胞内、外及细胞膜上的分布规律类似,在细胞内和细胞外超声组的浓度均低于对照组,而在细胞膜上两者类似.以初始浓度为523.8mg/L为例,细胞外对照组的浓度为239.5mg/L,而超声组为218.0mg/L,比对照组低8.9%,这可能是因为低强度超声的干预使得细胞膜的通透性发生了改变,使得从细胞外到细胞内的传质阻力减小,硝基苯更容易穿过细胞膜进入细胞内部在相应酶的作用下被降解;对照组与超声组细胞内的浓度分别为27.3mg/L和24.4mg/L,这说明超声增加了细胞内酶的活性,提高了细胞内硝基苯的降解速率.
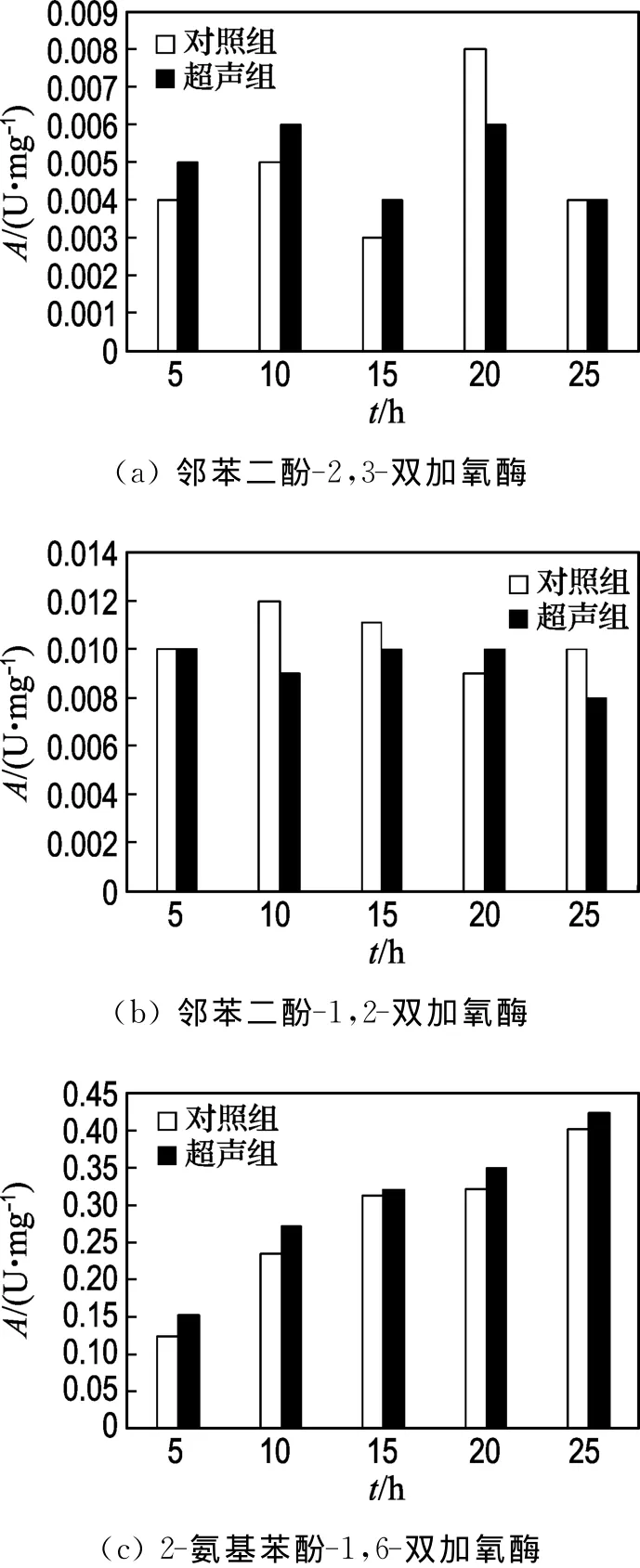
图2 R.mucilaginosaZ1降解硝基苯过程中酶活的变化Fig.2 Changes of enzyme activities of R.mucilaginosa Z1during biodegradation of nitrobenzene

表1 不同初始硝基苯浓度下R.mucilaginosa Z1细胞内、外及细胞膜上硝基苯的分布Tab.1 Cellular nitrobenzene distribution of R.mucilaginosa Z1in the presence of different initial concentrations of nitrobenzene
2.5 超声对硝基苯的表观降解率及真实降解率的影响
根据2.4中不同初始硝基苯浓度下,硝基苯在细胞外、细胞膜及细胞内的分布情况计算其表观和真实降解率D,结果如图3所示.

图3 R.mucilaginosa Z1对不同初始浓度硝基苯的降解率Fig.3 Degradation efficiencies of R.mucilaginosa Z1 for different initial concentrations of nitrobenzene
由图3可见,对于R.mucilaginosaZ1,无论是否有超声作用,其表观降解率均高于真实降解率.另外超声组的降解率均高于对照组,结合上面实验的分析证明,主要是超声作用改变了细胞膜的通透性和促进了酶活.
3 结 论
(1)对于低浓度硝基苯的降解,低强度超声的强化作用不明显,而对于中高浓度硝基苯的降解,低强度超声具有一定的强化效果,但只是提高了降解速率,并没有提高最终的去除率.同时超声作用没有提高生物的生长量.
(2)超声强化作用可以提高R.mucilaginosaZ1粗酶的含量,超声组粗酶较对照组增加了10%.
(3)R.mucilaginosaZ1对硝基苯的降解中以2-氨基苯酚-1,6-双加氧酶的活性为主,说明降解遵循的是部分还原氧化途径.同时超声提高了2-氨基苯酚-1,6-双加氧酶的活性,超声组平均比对照组高出8.8%.
(4)通过对R.mucilaginosaZ1细胞内、外及细胞膜上的硝基苯分布规律的测定,说明超声改变了细胞膜的通透性,减小了硝基苯从细胞外到细胞内的传质阻力.
[1]Schl fer O,Sievers M,Klotzbücher H,etal.Improvement of biological activity by low energy ultrasound assisted bioreactors [J].Ultrasonics,2000,38(1-8):711-716.
[2]吕霞付,杨海麟,王 武.超声波在生物发酵工程中的应用[J].生物技术通讯,2001,12(4):310-313.LYU Xia-fu,YANG Hai-lin,WANG Wu.The application of ultrasonic in fermentation engineering[J].Letters in Biotechnology,2001,12(4):310-313.(in Chinese)
[3]Aoyama T,Hosseinkhani H,Yamamoto S,etal.Enhanced expression of plasmid DNA-cationized gelatin complex by ultrasound in murine muscle[J].Journal of Controlled Release,2002,80(1-3):345-356.
[4]Anwer K,Kao G,Proctor B,etal.Ultrasound enhancement of cationic lipid-mediated gene transfer to primary tumors following systemic administration[J].Gene Therapy,2000,7(21):1833-1839.
[5]Barton S,Bullock C, Weir D.The effects of ultrasound on the activities of some glycosidase enzymes of industrial importance [J].Enzyme and Microbial Technology,1996,18(3):190-194.
[6]LIN Li-dong, WU Jian-yong.Enhancement of shikonin production in single- and two-phase suspension cultures ofLithospermumerythrorhizoncells using low-energy ultrasound[J].Biotechnology and Bioengineering,2002,78(1):81-88.
[7]Pitt W G,Ross S A.Ultrasound increases the rate of bacterial cell growth[J].Biotechnology Progress,2003,19(3):1038-1044.
[8]Koch S,Pohl P,Cobet U,etal.Ultrasound enhancement of liposome-mediated cell transfection is caused by cavitation effects [J].Ultrasound in Medicine and Biology,2000,26(5):897-903.
[9]ZHANG Rui-na,JIN Ruo-fei,LIU Guang-fei,etal.Study on nitrogen removal performance of sequencing batch reactor enhanced by low intensity ultrasound [J].Bioresource Technology,2011,102(10):5717-5721.
[10]XIE Bei-zhen, LIU Hong.Enhancement of biological nitrogen removal from wastewater by lowintensity ultrasound [J].Water Air and Soil Pollution,2010,211(1-4):157-163.
[11]郑春莉.R.mucilaginosa,S.albidoflavus和M.luteus对硝基苯的好氧生物降解[D].大连:大连理工大学,2007.ZHENG Chun-li.Aerobic biodegradation of nitrobenzene byR.mucilaginosa,S.albidoflavusandM.luteus[D].Dalian:Dalian University of Technology,2007.(in Chinese)
[12]Nishino S F, Spain J C.Degradation of nitrobenzene by aPseudomonaspseudoalcaligenes[J].Applied and Environmental Microbiology,1993,59(8):2520-2525.
[13]Schraa G,Boone M L,Jetten M S,etal.Degradation of 1,4-dichlorobenzene byAlcaligenes sp.Strain A175 [J].Applied and Environmental Microbiology,1986,52(6):1374-1381.
[14]王红旗,姚治华,刘敬奇,等.苯在一株黄杆菌细胞内外的分布与降解率的关系[J].中国环境科学,2006,26(5):583-586.WANG Hong-qi, YAO Zhi-hua,LIU Jing-qi,etal.The relation between the distribution and the degradation rate inside and outside a bacteria strain,Flavobacterium[J].China Environmental Science,2006,26(5):583-586.(in Chinese)
[15]艾海新.耐盐硝基苯降解菌特性分析及其部分基因克隆[D].大连:大连理工大学,2008.AI Hai-xin.The characteristic analysis and partial gene clone of novel salt-tolerant bacteria capable of degrading nitrobenzene [D].Dalian: Dalian University of Technology,2008.(in Chinese)

