不同产地肾茶HPLC指纹图谱研究△
李光,陈曦,李宜航,李学兰
(1.中国医学科学院 药用植物研究所 云南分所,云南 景洪 666100;2.西双版纳州傣药南药重点实验室,云南 景洪 666100;3.中国医学科学院 药用植物研究所,北京 100193)
不同产地肾茶HPLC指纹图谱研究△
李光1,2*,陈曦1,3,李宜航1,2,李学兰1,2
(1.中国医学科学院 药用植物研究所 云南分所,云南 景洪 666100;2.西双版纳州傣药南药重点实验室,云南 景洪 666100;3.中国医学科学院 药用植物研究所,北京 100193)
目的:建立肾茶药材的HPLC指纹图谱分析方法。方法:采用Waters ODS柱(150 mm×4.6 mm,5 μm),流动相为乙腈-水(含0.1%的磷酸),梯度洗脱,检测波长为205 nm,流速为1 mL·min-1。采用《中药色谱指纹图谱相似度评价系统(2004A)版》,计算不同产地肾茶样品的HPLC指纹图谱的整体相似度。结果:共有15个共有峰,13批被测样品的色谱指纹图谱与对照指纹图谱的整体相似度在0.908~0.985。结论:该指纹图谱检测方法简便、重现性好,可作为肾茶药材质量控制的重要方法。
肾茶;指纹图谱;高效液相色谱
肾茶Clerodendranthusspicatus(Thunb.)C.Y.Wu又名猫须草,为唇形科肾茶属多年生草本植物,是傣医药中常用的解药(排解人体内积蓄毒素的药物)品种,也是傣医用于预防和治疗肾、膀胱、尿道疾病的首选药材,在西双版纳地区广泛种植,《贝叶经》(傣医经典论著)中记载其可单方煎汤或开水浸泡当茶饮,具有清热解毒,利水消肿,利尿化石,养肾保肾,凉血止血等功能。近年来,随着国内外学者深入研究,发现肾茶的药理作用不仅仅应用于泌尿系统,同时具有抗炎[1]、降血糖血脂[2]、保肝[3]、提高机体免疫力[4]等一系列药理活性,功效作用明确。随着以肾茶为原料的保健产品及药品的开发,原药材质量控制变得尤为重要,肾茶主产地遍布广西、海南、云南、东南亚等地,同属种类较多,简单来讲分为白花和紫花之分,西双版纳地区使用品种为白花样品,也有报道临床紫花品种质量优于白花品种,所以质量问题亟待解决。
在现阶段,指纹图谱技术是全面、整体地控制中药质量最有效的方法。至目前,未曾见有关肾茶指纹图谱方面的文献报道,为更有效地控制肾茶的质量,实验参照文献[5]应用RP-HPLC方法,建立了肾茶的HPLC指纹图谱分析方法,为其药材鉴别和质量控制提供实验依据。
1 材料、试剂与仪器
1.1 材料与试剂
肾茶样品的产地具体情况见表1。迷迭香酸对照品(批号:ZL20110523MDXS,南京泽朗医药科技有限公司)。乙腈(色谱纯,美国Fisher公司),其余试剂均为分析纯。
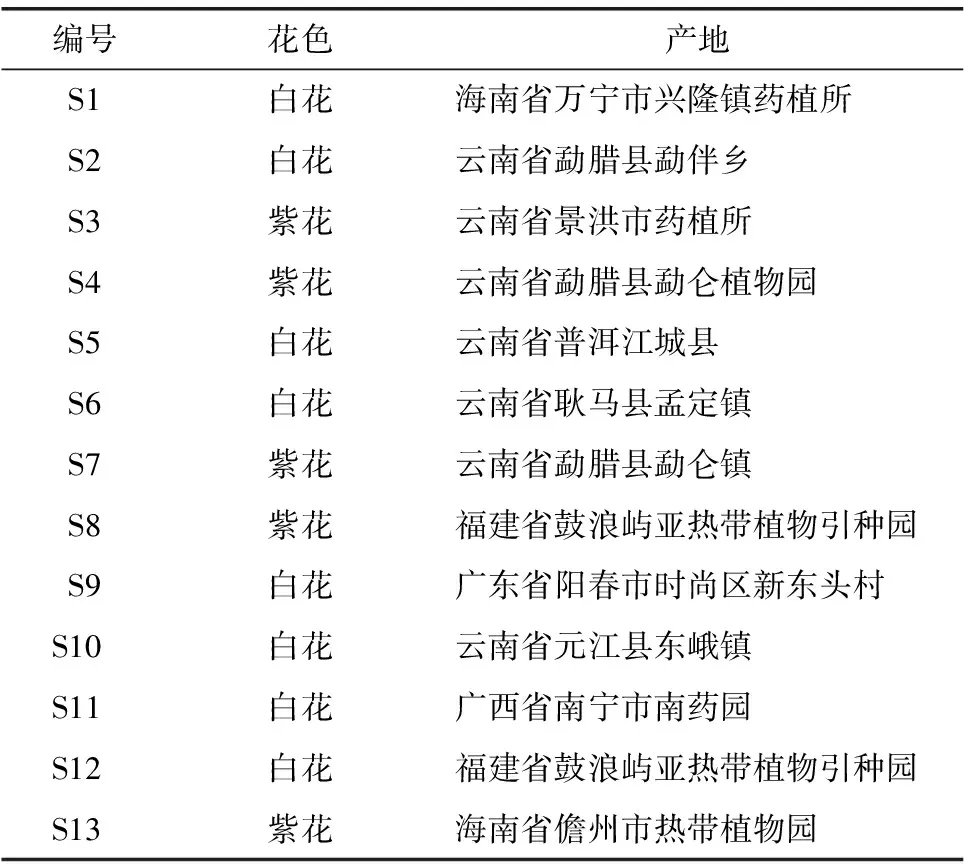
表1 13批肾茶药材的样品信息
1.2 仪器
Waters 600高效液相色谱仪配Waters 2489紫外检测器,Empower色谱工作站(美国沃特世公司);菲罗门ODS柱(150 mm×4.6 mm,5 μm),超声提取器(上海仪器制造厂,SK3200H),电子天平(德国赛多利斯,CP-224S),超声清洗仪(宁波市海曙五方超声设备有限公司,WF-500E),遗传性超纯水仪(英国ELGA公司,ULTRAGE MK2)。
2 方法与结果
2.1 对照品溶液的配制
精密称取迷迭香酸对照品3.55 mg,置于10 mL量瓶中,用甲醇溶解并定容至刻度,摇匀,即得迷迭香酸浓度均为0.355 mg·mL-1的对照品溶液。
2.2 供试品溶液的配制
分别取肾茶粉末(过60目筛)约500 mg,精密称定,置于25 mL量瓶中,加入50%甲醇10 mL,在常温下超声(250 W,40 kHz)提取30 min,过滤,滤液蒸干,加甲醇溶解定容至10 mL,即得供试品溶液。进样前取适量溶液用0.45 μm微孔滤膜过滤。
2.3 色谱条件和系统适用性试验
色谱柱:菲罗门ODS柱(150 mm×4.6 mm,5 μm),以乙腈-水(含0.1%磷酸)为流动相,梯度洗脱(见表2),流速:1 mL·min-1,柱温:40 ℃,检测波长:205 nm。在上述色谱条件下,按迷迭香酸峰计算理论板数不低于4 000,与其他色谱峰的分离度大于1.0。
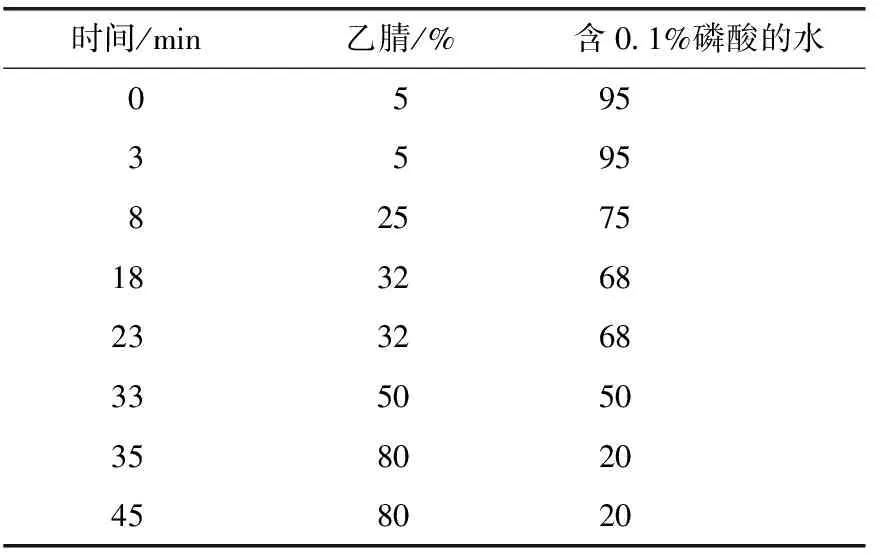
表2 梯度洗脱程序
2.4 标准曲线制备
精密称取迷迭香酸对照品8.875 mg,置25 mL容量瓶中,水溶解定容,在2.3项色谱条件下分别进样1,2,4,6,8,10 μL,以浓度为横坐标(X),峰面积为纵坐标(Y),建立标准曲线,得到迷迭香酸对照品的回归方程为Y=106X+52 387,r=0.999 8,显示迷迭香酸在0.348 6~3.486 μg呈现良好线性关系。
2.5 精密度试验
取同一供试品溶液,连续进样6次,分别对共有峰的保留时间和峰面积比值进行考察。结果表明,各共有峰保留时间的RSD<1.9%,峰面积的RSD<2.3%,表明仪器精密度良好。
2.6 重复性试验
取同一批样品6份,精密称定,按2.2项下方法制备供试品溶液,分别进样测定各共有峰保留时间的RSD<1.8%,峰面积的RSD<3.0%,表明实验方法重现性良好。
2.7 稳定性试验
取同一供试品溶液,室温放置,分别于0,2,4,8,16,24 h进样,测定各共有峰保留时间的RSD<1.2%,峰面积的RSD<2.8%,说明样品稳定性良好。
2.8 肾茶药材指纹图谱建立
取肾茶药材(1~13号样品),按2.2项下方法制备供试品溶液,各取20 μL分别进样,进行HPLC分析;另取迷迭香酸对照品溶液按相同条件进行分析,根据相对保留时间对样品图谱中色谱峰进行归属,并以迷迭香酸色谱峰为参比峰,共得到17个共有峰,结果如图1所示,将指纹图谱信号数据导入2004A版相似度评价软件,生成共有模式即对照指纹图谱,见图2。
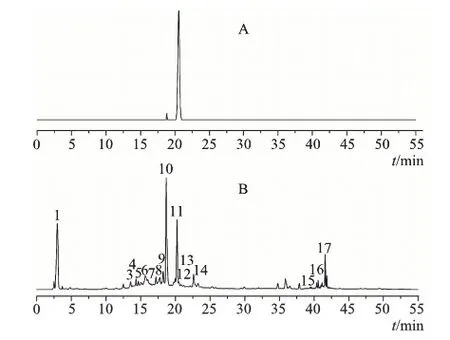
A.迷迭香酸对照品;B.肾茶图1 肾茶及对照品HPLC指纹图谱
2.8.1 指纹图谱及共有指纹峰的标定 按照对照品溶液和供试品溶液的制备方法制备样品溶液,并对对照品(见图1)和13个批次供试品的HPLC图进行检测。结果表明1~17号峰在13批次样品的色谱图中均出现,以迷迭香酸为参照,即11号峰,计算共有峰保留时间分别为2.956、12.525、13.577、13.978、14.295、14.696、15.665、17.234、17.802、18.303、18.678、20.290、21.226、22.695、23.363、39.045、40.364、42.334,共有指纹峰峰面积之和占总峰面积比值均大于90%,符合《中药指纹图谱研究技术指南(试行)》的要求。因此标定此17个峰为共有指纹峰,并据此建立了肾茶的HPLC指纹图谱,见图2。
2.8.2 相似度比较 采用中药指纹图谱相似度评价系统软件,对13批肾茶样品图谱进行相似度比较。以生成对照指纹图谱为模板,13批样品与对照指纹图谱之间相似度为0.908~0.985,见表3。

图2 13批肾茶药材指纹图谱
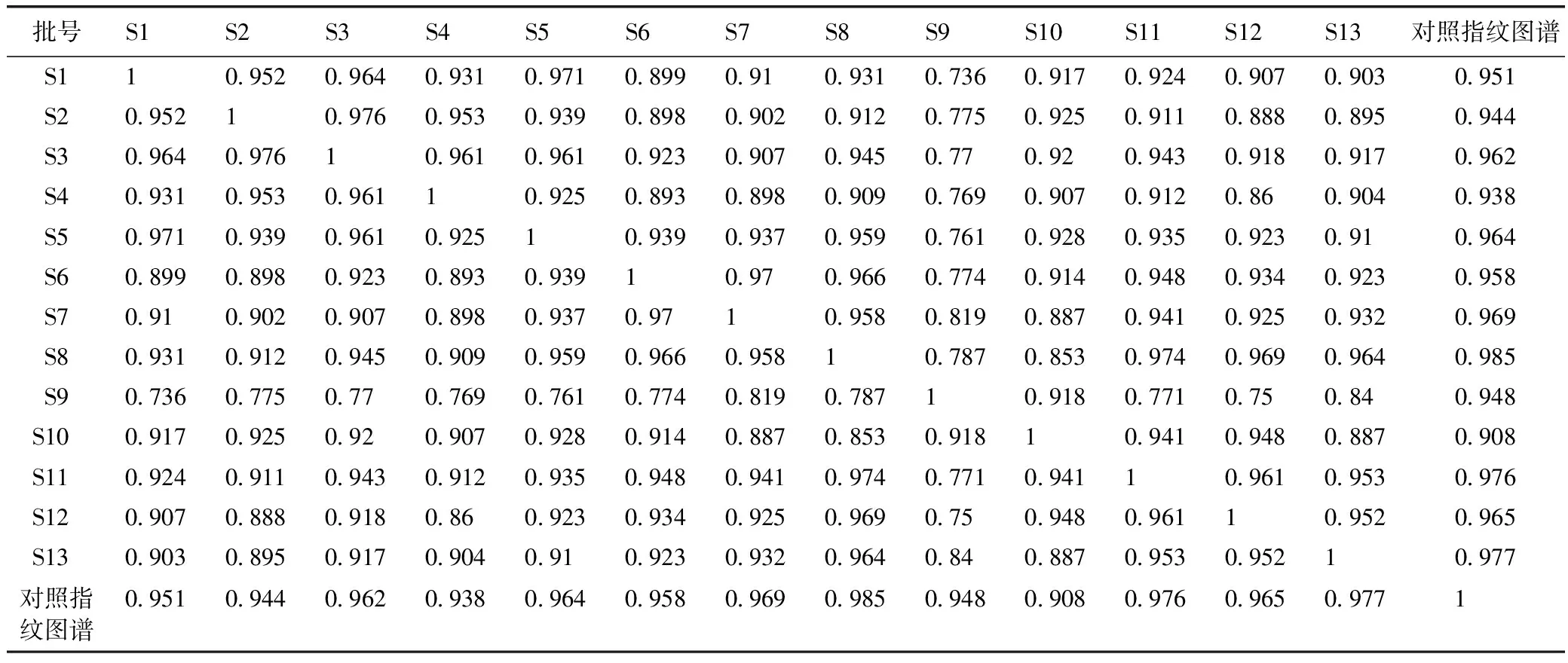
表3 肾茶药材共有峰的相对保留时间
2.8.3 肾茶品质评价 测定13批不同来源肾茶的HPLC指纹图谱,并与共有模式图谱进行比较,计算相似度,以相似度作为优质药材的定量判定标准,见表4。
结果表明,由相似度可以看出,以福建鼓浪屿的紫花肾茶相似度最高,为0.985,紫花与白花肾茶平均相似度分别为0.966 2和0.951 7,说明紫花肾茶较白花肾茶质量更加稳定;由迷迭香酸含量可以看出,以云南景洪市药植所的紫花肾茶含量最高,为1.51%,紫花与白花肾茶迷迭香酸含量平均为0.94%和0.92%,说明紫花肾茶有效成分含量要优于白花肾茶。综合上述,云南地区的紫花肾茶可能为优质品种,药理作用是否更好,还待下一步研究。

表4 13批肾茶来源及HPLC指纹图谱相似度
3 讨论
实验对乙腈-水、乙腈-0.05%磷酸水溶液、乙腈-0.1%磷酸水溶液、乙腈-0.5%醋酸水溶液和乙腈-1%醋酸水溶液系统进行了考察,结果发现只有在乙腈-0.1%磷酸水溶液系统下保留时间较适合且峰形较好,所以将乙腈-0.1%磷酸水溶液系统确定为流动相。
实验对检测波长进行了考察,记录并比较了不同波长的指纹图谱,结果在205 nm检测波长下,指纹图谱中色谱峰较多,信息较丰富,所以选择205 nm为检测波长。
通过比较紫花肾茶与白花肾茶的平均相似度,发现紫花肾茶优于白花肾茶,这也为临床用药提供了技术参考。
实验采用HPLC技术对肾茶样品中黄酮类化合物进行了检测,通过对13批次肾茶样品色谱峰保留时间和峰面积百分比的比较和分析,对共有指纹峰进行了标定,并据此成功建立了肾茶药材的HPLC指纹图谱。经过对不同产地肾茶样品的HPLC图谱的比较,结果表明,实验获得的色谱指纹图谱在不同产地肾茶样品中具有极大的相似性,从而可以有效反映同一物种个体间的相似性,可以作为肾茶专属性的指纹图谱,为肾茶的药材鉴别和质量控制提供依据。
[1] 高南南,田泽,李玲玲,等.肾茶药理作用的研究[J].中草药,1996,27(10):615.
[2] Mohamed E A H,Mohamed A J,Asmawi M.Antihyperglycemic Effect of Orthosiphon Stamineus Benth Leaves Extract and Its Bioassay-Guided Fractions[J].Molecules,2011,16(5):3787-3801.
[3] Mohammed A.Hepatoprotective Effects of Orthosiphon stamineus Extract on Thioacetamide-Induced Liver Cirrhosis in Rats[J].Evidence-Based Complementary and Alternative Medicine,2011,(1):1-6.
[4] 岑小波,王瑞淑.肾茶对小鼠免疫功能的影响[J].现代预防医学,1997,(1):78-79.
[5] 陈志红,徐美奕,龚先玲.紫荆花黄酮类化合物的HPLC指纹图谱研究[J].中国药房,2010,(31):2927-2928.
HPLCFingerprintofDifferentOriginOrthosiphonstamineus
LI Guang1,2*,CHEN Xi1,3,LI Yi-hang1,2,LI Xue-lan1,2
(1.YunnanBranch,InstituteofMedicinalPlant,ChineseAcademyofMedicalSciences,PekingUnionMedicalCollege,Jinghong666100,China;2.KeyLaboratoryofDaiandSouthernMedicineofXishuangbannaDaiAutonomousPrefecture,Jinghong666100 ,China; 3.InstituteofMedicinalPlant,ChineseAcademyofMedicalSciences,PekingUnionMedicalCollege,Beijing100193 ,China)
Objective:To establish the analysis method of fingerprint forOrthosiphonstamineusby HPLC.Methods:A column of Waters ODS(150 mm×4.6 mm,5 μm)was used.The mobile phase consisted of acetonitrile-water(containing 2% acetic acid)with gradient elution. The detective wavelength was 205 nm,and the flow rate was 1.0 mL·min-1.The similarity of different originalOrthosiphonstamineussamples were compared by Similarity Evaluation System for Chromatographic Fingerprint of CMM Version 2004A.Results:The fingerprint consisted of 15 common peaks.And the similarity was in the range of 0.908~0.985.Conclusion:This method is simple,accurate,and with good reproducibility,can be used specifically for the quality control ofOrthosiphonstamineus.
Orthosiphonstamineus; Fingerprint; HPLC
2012-11-20)
△
中国医学科学院北京协和医学院青年科研基金项目(XHYN-01),中央级公益性科研院所基本科研业务专项(YZYN-11-03),云南省科技重大项目——傣药南药特色资源评价及保育技术研究(2008IF018)
*
李光,Tel:(0691)2136981,E-mail:lhbg311@hotmail.com

