蛇床子素对神经退行性疾病的作用及机制
路遥 曾常茜
(大连大学医学院,辽宁大连116622)
蛇床子素(osthole)是最先从伞形科植物中提取分离出的天然香豆素类化合物,其在伞形科一年生草本植物蛇床 Cnidium monnieric(L.)Cuss.的干燥成熟果实中含量较高(约为2%)。现代药理学实验研究表明:蛇床子素具有抗肿瘤、抗炎、抗痉挛、抗凝血等功效[1-3]。随着对蛇床子素的深入研究发现,其在神经系统退行性疾病中亦有重要作用,如减少神经元凋亡、抑制炎症因子释放、维持血脑屏障完整性等[4-6]。本文就蛇床子素对神经退行性疾病的作用及相关机制作一综述。
1 蛇床子素概述
蛇床子素,别名欧芹酚甲醚、甲氧基欧芩酚,其化学名称为7-甲氧基-8-异戊烯基香豆素(7-methoxy-8-[3-methylpent-2-enyl]coumarin),存在于当归属、古当归属、绵果芹属、蛇床属、阿魏属、独活属、岩风属、欧防风属、欧芹属、前胡属、茴芹属、栓翅芹属、亮蛇床属、西风芹属、白芷属等多属植物中[7]。蛇床子素属于香豆素类化合物,分子量为224.29,其结构由苯环、吡喃酮环和异戊烯结构组成,其中苯环和吡喃酮环是其核心结构,如图1所示[8]。低含量(35%,50%等)蛇床子素为黄绿色粉末,高含量(90%以上)蛇床子素为白色针状结晶粉末。蛇床子素可溶于碱溶液、甲醇、乙醇、三氯甲烷、丙酮、醋酸乙酯和沸石油醚等,不溶于水和石油醚。
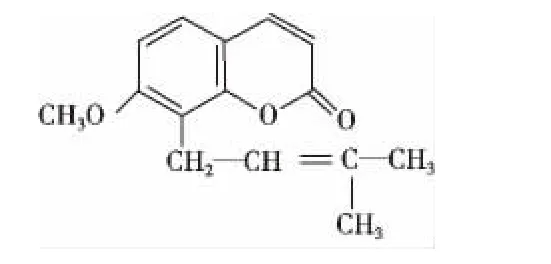
图1 蛇床子素化学结构
2 蛇床子素与神经退行性疾病
2.1 蛇床子素与缺血性脑损伤
脑血管病是危害人类生命和健康的常见病。脑缺血损伤所涉及的病理生理机制十分复杂,包括氧自由基生成过多、炎症因子分泌增加、凋亡相关基因激活、血脑屏障破坏等多种病理过程[9]。
Ji HJ等[4]通过永久性结扎双侧总动脉闭塞(permanent occlusion of bilateral common carotid arteries,2VO)大鼠建立脑缺血性损伤模型,通过Morris水迷宫①Morris水迷宫是英国心理学家Morris于20世纪80年代初(1981)设计并应用于脑学习记忆机制研究的一种实验手段,其在阿尔茨海默病(AD)研究中的应用非常普遍实验发现蛇床子素可以明显改善2VO大鼠的空间学习及记忆能力,研究结果表明:蛇床子素可以改善大鼠缺血性脑损伤认知缺陷。Mao X等[6]通过大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)建立大鼠局灶性脑缺血模型,观察蛇床子素对改善脑缺血所致的认知缺陷及神经元损伤的作用,结果发现,蛇床子素预处理MCAO大鼠 7 d,其神经病理学得分为1.43±0.20,较MCAO大鼠明显降低(P<0.05),神经病理学损伤明显改善,梗死面积较未用蛇床子素处理组大鼠明显减少。Chen T等[10]将皮质神经元置于缺氧缺糖(OGD)环境中培养 4 h,并用 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)实验研究蛇床子素对OGD损伤模型神经元存活率的影响,结果发现,在OGD前2 h,分别用不同浓度蛇床子素预处理的神经元,其存活能力随着蛇床子素的浓度增加而增加。以上研究表明:蛇床子素对缺血性脑损伤所致神经元损伤具有保护作用。
2.1.1 在脑缺血性损伤时 脑内自由基产生、清除状态受到破坏,氧自由基大量产生并攻击生物膜的脂类、糖、蛋白质及细胞内的核酸,从而导致神经细胞死亡[9]。Ji HJ等[4]用2VO模型研究蛇床子素的抗氧化能力发现,蛇床子素处理2VO大鼠3周后,大鼠的海马匀浆中丙二醛(MDA)含量显著低于2VO组大鼠;蛇床子素处理组大鼠海马匀浆中过氧化氢酶、谷胱甘肽过氧化物酶(GPx)活性明显高于2VO组大鼠。Chao XD等[5]采用MCAO模型,发现蛇床子素预处理组大鼠脑梗死区和缺血半暗区较MCAO组谷胱甘肽(GSH)活性明显增加,髓过氧化物酶(MPO)活性及MDA含量明显降低。由此可见,蛇床子素通过减弱过量氧自由基形成并且增加抗氧化能力发挥保护神经元的作用。
2.1.2 脑缺血损伤后 白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)等产生增加,诱导缺血区脑组织中白介素-8(IL-8)生成增加。IL-8是免疫性炎症反应过程中的炎性趋化细胞因子,在缺血性脑损伤中起着重要作用。脑缺血损伤后,缺血区脑组织中IL-8生成增加,使大量中性粒细胞激活,促进其趋化和浸润,并释放毒性氧自由基、细胞因子和一些炎症介质,导致局部脑水肿和脑组织坏死。一氧化氮合酶(NOS)是一氧化氮(NO)合成的限速酶,诱导型NOS(iNOS)在生理条件下不表达,在神经元受到损伤或炎症反应时被大量激活,持续产生大量NO,发挥细胞毒性作用,诱导神经元细胞凋亡[11]。 Chao DX 等[5]、Li F 等[12]研究发现,蛇床子素可以明显降低 MCAO 大鼠 IL-1β,IL-8,TNF-α,环氧合酶-2(COX-2),iNOS等炎症因子,表明蛇床子素可以通过抗炎作用对抗脑缺血损伤。
B细胞淋巴瘤因子-2(Bcl-2)是一种抗凋亡蛋白,Bcl-2相关X蛋白(Bax)是一种促凋亡蛋白,Bax/Bcl-2的比例关系是决定细胞凋亡抑制作用强弱的关键因素,而且半胱氨酸天冬氨酸蛋白酶-3(caspase-3)在凋亡起始阶段起主要作用。Ji HJ等[4]通过检测2VO大鼠海马组织凋亡相关蛋白,发现2VO大鼠海马Bcl-2蛋白表达下调、Bax蛋白表达上调、caspase-3激活,而蛇床子素明显抑制Bcl-2表达下调、Bax表达上调并减轻caspase-3的激活;由此提示,蛇床子素对缺血性脑损伤具有一定的保护作用,其机制可能与通过调控凋亡相关蛋白,抑制细胞凋亡有关。
在缺血性脑损伤大鼠神经元中c-Jun氨基端激酶(JNK)通路高度激活c-Jun磷酸化,并且在缺血所致的凋亡中具有重要作用[13]。在MCAO模型建模后3 h,给大鼠腹腔注射0.1 mg/kg D-JNKI1(JNK抑制剂),使脑损伤区域从(8.2± 8.5)mm 降低到(13.9 ± 6.2)mm[13]。 Chen T 等[10]又进一步通过蛋白质印记(Western blot)检测神经元胞外信号调节激酶(ERK)1 和 ERK 2(统称为 ERK1/2)及JNK活化情况,结果发现,蛇床子素能明显延长ERK1/2的活化时间并抑制JNK活化,表明蛇床子素对脑缺血神经元损伤具有保护作用,其机制与蛇床子素通过调控ERK1/2、JNK信号通路,进一步发挥其抗凋亡作用有关。
文献报道基质金属蛋白酶(matrix metalloproteinases,MMP)在脑缺血的病理过程中具有重要作用。脑缺血患者脑组织MMP-9酶原和活化的MMP-9迅速增加,活化的MMP异常增加将促进蛋白质的异常水解,因此而破坏血脑屏障的完整性及增加梗死面积[14]。Mao X等[6]通过Western blot和明胶酶谱分析法研究发现MCAO组大鼠海马MMP含量及活性增高,蛇床子素可以明显降低MMP含量、抑制MMP活性,提示蛇床子素可能是通过抑制MMP,进而保存血脑屏障完整性从而发挥神经保护作用。
2.2 蛇床子素与自身免疫性脑脊髓炎(EAE)
EAE是一种主要由CD4(人体免疫系统中的1种重要免疫细胞)阳性Th1细胞(CD4+Th1)介导的,以中枢神经系统内小血管周围单核细胞浸润和髓鞘脱失为特征的自身免疫性疾病。
在EAE的炎症应答反应中Th1细胞激活小胶质细胞,并促进小胶质细胞分泌子干扰素-γ(IFN-γ)、白介素-2(IL-2)、TNF-α 等促炎因子,导致神经纤维脱髓鞘。神经生长因子(NGF)可以通过调节中枢神经系统细胞亚群(Th1与Th2)细胞因子之间的平衡而作为一种抗炎介质,并且可以降低 EAE中IFN-γ的水平[15]。Chen XH等[16]通过给C57BL/6小鼠注射髓鞘少突胶质细胞糖蛋白35-55氨基酸肽(MOG35-55)建立 EAE模型,并在注射MOG35-55 7 d(亚临床阶段)和13 d(临床阶段)后分别用蛇床子素处理,结果发现,在亚临床阶段用蛇床子素治疗可以推迟疾病过程,而在以上2种阶段用蛇床子素治疗均可以减弱小鼠炎症和髓鞘脱失并改善磁共振成像结果。此外,蛇床子素可以增加NGF分泌并抑制IFN-γ分泌。由此可见:蛇床子素通过调节IFN-γ对EAE发挥保护作用。
2.3 蛇床子素与帕金森病(PD)
PD又称震颤麻痹,是一种常见的神经功能障碍疾病,是中老年人最常见的中枢神经系统疾病,其病理特征以黑质部位的多巴胺能神经元变性为主。
乳酸脱氢酶(lactate dehydrogenase,LDH)正常情况下存在于细胞质中,一旦细胞膜受损,LDH即被释放到细胞外,因此,通过检测脑组织中LDH的活性,可判断细胞受损的程度。细胞色素C(细胞色素的1个亚类)是一种水溶性蛋白,具有调控细胞能量代谢和凋亡的双重功能。Liu WB等[17]使用N-甲基哌嗪(MPP+)处理PC12细胞(1种常用的神经细胞株)建立多巴胺能神经元损伤模型,并观察蛇床子素预处理后对MPP+损伤PC12细胞的保护作用,结果发现,蛇床子素预处理可以明显改善PC12细胞活性,降低LDH的释放,表明蛇床子素对多巴胺能神经元细胞具有保护作用。进一步通过Western blot技术检测PC12细胞Bax,Bcl-2和细胞色素C的蛋白表达水平,结果发现:蛇床子素+MPP+处理组与单纯MPP+处理组相比Bax表达升高幅度和Bcl-2表达下降幅度均显著减少,Bax/Bcl-2的比值也明显降低,细胞色素C释放量明显减少。表明蛇床子素可能通过降低Bax/Bcl-2的比值减少神经元的凋亡,减少细胞色素C的释放来调控能量代谢,从而发挥保护多巴胺能神经元的作用。
2.4 蛇床子素与AD
AD是一种以认知障碍、记忆减退为临床特征的老年性中枢神经退行性疾病,其病理学特征为β-淀粉样蛋白(Aβ)在脑内异常聚集,胶质细胞过度活化并释放炎性介质引起神经毒性作用,最终导致神经元凋亡[18]。
神经炎症在AD发病过程中的作用越来越受到重视,现在研究表明[19],在AD脑中存在持久的炎症反应。龚其海等[19]通过侧脑室注射脂多糖诱导大鼠的神经炎症模型,蛇床子素组大鼠在造模前3 d,每日1次灌胃40 mg/kg蛇床子素,造模后5 d,开始Morris水迷宫检测大鼠的空间记忆能力,苏木精-伊红染色(HE染色)观察大鼠海马神经元损伤情况,发现蛇床子素可明显缩短大鼠定向航行实验中的逃避潜伏期,延长空间探索实验中的校正逃避潜伏期,减轻海马神经元损伤;进一步通过实时定量PCR(real time-PCR)法测定海马炎症因子信使核糖核酸(mRNA)水平,结果发现,蛇床子素显著降低大鼠海马组织中TNF-α,IL-1β,NOS2和Cox-2的mRNA表达水平。表明蛇床子素可减轻脂多糖诱导的大鼠学习记忆减退及海马神经元损伤,其机制与抑制炎症相关基因的mRNA表达有关。
细胞在静息状态下,核因子-κB(NF-κB)以无活性的潜在状态存在于细胞浆中,与NF-κB抑制性蛋白(IκB)结合组成异源多聚体(p50-p65-IκBα或 p50-p65-IκBβ)。当细胞受到 NF-κB 激活剂刺激时胞浆中的 NF-κB三聚体复合物中的 IκB发生磷酸化,随后赖氨酸残基发生泛素化,在蛋白酶小体作用下裂解,从三聚体中解离出来,从而使p50-p65异二聚体表现出NF-κB活性,活化的NF-κB从细胞浆易位至细胞核内,与NF-κB序列结合,发挥转录调控作用。在病理情况下,脑内大量沉积的Aβ能够诱导星形胶质细胞内的 NF-κB过度活化,释放炎症因子、产生氧化应激反应等,促进神经元凋亡。程淑意等[20]用40μmol/L的Aβ25-35作用于星形胶质细胞 24 h,结果发现,NF-κB过度活化,IκBα(NF-κB 的抑制 蛋 白 )发 生 磷 酸 化 及 降解。蛇床子素(0.01~ 1μmol/mL)可显著抑制Aβ25-35诱导的 NF-κB过度活化,上调细胞核内IκBα的表达。表明蛇床子素通可以拮抗 Aβ25-35的神经毒性作用,延缓AD发生发展的作用机理可能与上调星形胶质细胞中IκBα的表达,抑制NF-κB的过度活化表达有关。
2.5 蛇床子素与癫痫
癫痫(epilepsy)是由多种原因引起的神经元反复同步化异常放电所致的突然性、反复性和短暂性的运动、感觉、意识、精神、植物神经等功能异常的脑部疾病,典型的临床表现为癫痫持续状态。Luszczki JJ等[21]通过对小鼠最大电休克诱导癫痫模型,并在腹腔注射蛇床子素后15,30,60及120 min分别观察其抗惊厥作用,结果发现,其半数有效量(ED50)为 259~631 mg/kg。Luszczki JJ 等[22]对蛇床子素、欧前胡素和丙戊酸3种药物的抗惊厥和神经毒害作用进行比较,结果发现,3者的 ED50分别为 253~639,167~290,167~290 mg/kg,半数中毒量(TD50)为:329~443,531~648,363~512 mg/kg,保护指数(TD50/ED50)分别为:1.13~2.60,0.83 ~2.44,1.72~2.00,可以看出,蛇床子素在最大电休克诱导的癫痫模型中抗惊厥作用与丙戊酸相似,推测蛇床子素在抑制癫痫发作方面具有潜在的应用价值。
3 展望
随着对蛇床子素化学结构、药理学作用的深入研究,目前蛇床子素已由传统应用向新领域拓展,对脑缺血性损伤、EAE、PD、AD等多种神经退行性疾病显示出良好的疗效,其作用机制主要与抗炎、抗氧化、抗凋亡、维持血脑屏障完整性等作用有关。在抗癫痫方面,虽然有研究表明:蛇床子素对电休克诱导大鼠癫痫模型具有抗惊厥作用[21-22],但是其作用靶点、作用机制尚不明确,且对其他类型癫痫模型是否亦有抗痉挛作用尚未见报道,应需进一步研究。随着蛇床子素对神经退行性疾病作用机制和有效靶点的不断深入研究,相信可以使蛇床子素在防治神经疾病领域中得到更广泛的应用。
[1] Xu XM,Zhang Y,Qu D,et al.Osthole suppresses migration and invasion of A549 human lung cancer cells through inhibition of matrix metalloproteinase-2 and matrix metallopeptidase-9 in vitro[J].Mol Med Rep,2012,6(5):1018-1022.
[2] Wei M,Mo SL,Nabar NR,et al.Modification of rat model of sciatica induced by lumber disc herniation and the anti-inflammatory effect of osthole given by epidural catheterization[J].Pharmacology,2012,90(5-6):251-263.
[3] Singhuber J,Baburin I,Ecker GF,et al.Insights into structure-activity relationship of GABAA receptor modulating coumarins and furanocoumarins[J].Eur J Pharmacol,2011,668(1-2):57-64.
[4] Ji HJ,Hu JF,Wang YH,et al.Osthole improves chronic cerebral hypoperfusion induced cognitive deficits and neuronal damage in hippocampus[J].Eur J Pharmacol,2010,636(1-3):96-101.
[5] Chao XD,Zhou J,Chen T,et al.Neuroprotective effect of osthole against acute ischemic stroke on middle cerebral ischemia occlusion in rats[J].Brain Res,2010,1363:206-211.
[6] Mao X,Yin W,Liu M,et al.Osthole,a natural coumarin,improves neurobehavioral functions and reduces infarct volume and matrix Metalloproteinase-9 activity after transient focal cerebral ischemia in rats[J].Brain Res,2011,1385:275-280.
[7] 马玉明.蛇床子素的药理进展及剂型开发[J].中国现代药物应用,2008,2(15):112-114.
[8] 孙小兵,叶吉琴.蛇床子素研究进展[J].大众科技,2009(2):132-133.
[9] Yao N,Wang DF,Song X,et al.Neuroprotective effects of combined pretreatment with edaravone and propofol on neonatal ratcerebra cortical neurons with ischemia/reperfusion injury in vitro[J].Zhongguo Wei Zhong Bing Ji Jiu Yi Xue,2012,24 (5):286-289.
[10] Chen T,Liu W,Chao X,et al.Neuroprotective of effect osthole against oxygen and glucose deprivation in rat cortical neurons:involvement of mitogen-activated protein kinase pathway[J].Neuroscience ,2011,183 : 203-211.
[11] Keynes RG,Garthwaite J.Nitric oxide and its role in ischaemic brain injury[J].Curr Mol Med,2004,4(2):179-191.
[12] Li F,Gong Q,Wang L,et al.Osthole attenuates focal inflammatory reaction following permanent middle cerebral artery occlusion in rats[J].Biol Pharm Bull,2012,35(10):1686-1690.
[13] Benakis C,Bonny C,Hirt L.JNK inhibition and inflammation after cerebral ischemia[J].Brain Behav Immun,2010,24(5):800-811.
[14] Rosell A,Lo EH.Multiphasic roles for matrix metalloproteinases after stroke[J].Curr Opin Pharmacol,2008,8(1):82-89.
[15] Villoslada P,Hauser SL,Bartke I,et al.Human nerve growth factor protects common marmosets against autoimmune encephalomyelitis by switching the balance of T helper cell type 1 and 2 cytokines within the central nervous system[J].J.Exp.Med,2000,191(10):1799-1806.
[16] Chen X,Pi R,Zou Y,et al.Attenuation of experimental autoimmune encephalomyelitis in C57 BL/6 mice by osthole,a natural coumarin[J].Eur J Pharmacol,2010,629 (1-3):40-46.
[17] Liu WB,Zhou J,Qu Y,et al.Neuroprotective effect of osthole on MPP+-induced cytotoxicity in PC12 cells via inhibition of mitochondrial dysfunction and ROS production[J].Neurochem Int,2010,57(3):206-215.
[18] Lee YJ,Han SB,Nam SY,et al.Inflammation and Alzheimer’s disease[J].Arch Pharm Res,2010,33(10):1539-1556.
[19] 龚其海,丁利静,王丽娜,等.蛇床子素减轻脂多糖诱导的大鼠学习记忆减退[J].中国新药与临床杂志,2011,30(8):609-614.
[20] 程淑意,陈云波,王奇,等.蛇床子素对Aβ25-35诱导的星形胶质细胞NF-κB活化机制的影响[J].广州中医药大学学报,2011,27(1):36-40.
[21] Luszczki JJ,Andres-Mach M,Cisowski W,et al.Osthole suppresses seizures in the mouse maximal electroshock seizure model[J].Eur J Pharmacol,2009,607(1-3):107-109.
[22] Luszczki JJ,Wojda E,Andres-Mach M,et al.Anticonvulsant and acute neurotoxic effects of imperatorin,osthole and valproate in the maximal electroshock seizure and chimney tests in mice: a comparative study[J].Epilepsy Res,2009,85(2-3):293-299.

