蛋白质的研究历程与诺贝尔科学奖
顾家山 刘丽 汪丰云 孙影 余妍霞
(安徽师范大学化学与材料科学学院 安徽芜湖 241000)
诺贝尔科学奖的成果在相当大程度上可反映出20世纪以来科学的主要成就和科学的发展情况,因此从与蛋白质相关的科研工作获取诺贝尔科学奖的情况,可了解100多年来蛋白质研究的发展历史。
1 蛋白质的基本概况
蛋白质作为生命的物质基础,参与生物体内的生命活动过程;蛋白质有其自身固有的特点,它的基本化学组成主要是碳、氢、氧、氮4种元素,有些蛋白质还含有硫、磷、铁等元素,这些元素按一定结构组成氨基酸。氨基酸是蛋白质的组成单位,自然界中的氨基酸有20多种,这20多种氨基酸以不同数目和不同顺序连接构成种类繁多、千差万别的蛋白质,发挥各自不同的生理功能。因此,要想真正揭开生命现象的奥秘,必须进行蛋白质水平的研究。科学家从早期对蛋白质组成、结构、性质的初步认识到现代对蛋白质组的深入研究,经历了艰难曲折的历程,在科学史上写下了辉煌的篇章。
2 蛋白质研究的历程
2.1 蛋白质研究方面诺贝尔科学奖的统计
有关蛋白质研究方面获得诺贝尔科学奖的详细情况见表1。
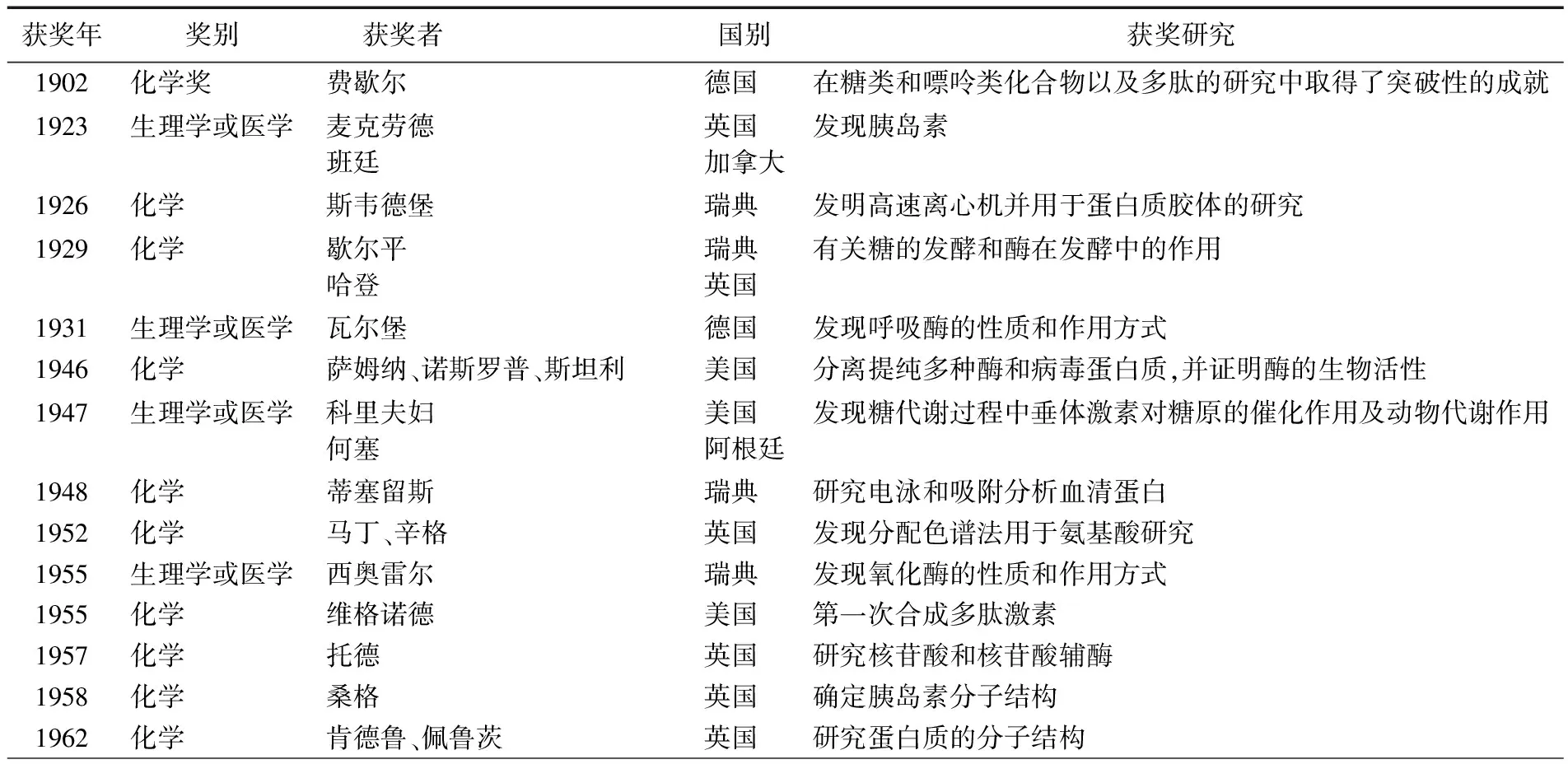
表1 蛋白质研究方面获得的诺贝尔科学家

续表
统计数据源于:顾家山,汪丰云,余妍霞.诺贝尔科学奖与科学精神.合肥:中国科技大学出版社,2009,8。
2.2 蛋白质研究的初期阶段
17世纪后出现了有机化学这门学科,并逐渐形成了有机结构理论。18世纪后期,法国化学家马凯尔(P.J.Macquer)把鸡蛋清类的物质称为“蛋白性”物质。当时人们发现鸡蛋清在加热后会从液态变为固态,并且该过程不可逆。这是人们对蛋白质的最初认识。19世纪初期,人们从动物和植物中分离出一些与禽蛋白相似的物质,把它称为Proteos(希腊文,最重要的),被认为是“植物为食草动物准备的一种首要或主要的营养成分,后者又将其传递给食肉动物”。1838年,瑞典化学家贝采利乌斯(J.J.Berzelius)提出蛋白质的概念。当时蛋白质被简单地定义为“加热易聚集”的物质[1],并认为蛋白质是生物机体组织的基本构成形式。限于当时的科学认识水平和实验技术手段,要想弄清蛋白质的组成、结构和性质,困难是很多的。后来由于科学家的努力,发现生物体中存在各种各样成分的蛋白质。化学家采用了在酸性或碱性溶液中加热到100℃水解蛋白质的研究方法,使蛋白质分解成多肽和氨基酸。用这种方法,在19世纪末已经得到了14种不同的氨基酸。这种分析的研究方法也给后来的研究工作指明了方向。
2.3 蛋白质研究的发展阶段
2.3.1 蛋白质结构的测定
蛋白质结构测定是蛋白质研究领域中的一个重要环节,只有知道蛋白质的空间结构才能了解它的功能,才能清楚地认识到蛋白质在体内所起的作用及机理。
有机化学家费歇尔(E.Fischer)从1899年开始连续10年从事蛋白质的研究,提出蛋白质的多肽结构理论,荣获了1902年诺贝尔化学奖。费歇尔借鉴了前人的分析研究方法,将蛋白质水解,得到了氨基酸混合物,再把氨基酸一一分离出来,从而确定出组成蛋白质的氨基酸的种类和数量,使人们对蛋白质组成的认识向前迈出了重要的一步。接下来,费歇尔又运用合成的方法,从各种氨基酸中选出多种组合进行连接。1907年,费歇尔成功地合成了由18个氨基酸分子连结成的链状物质,相对分子质量为1213,并测得这种十八肽具有与天然蛋白质类似的性质。说明蛋白质分子是许多氨基酸由肽键相连而成的长链高分子化合物,这就是著名的多肽结构理论[2]。
多肽结构理论为化学家研究蛋白质的结构提供了一个框架,但要真正弄清蛋白质的结构,仅仅知道肽链的结构还是不够的。二战后,多肽链中氨基酸顺序的测定成为蛋白质研究中重要的新课题。1923年,维格诺德(Vgeneaud)开始研究脑垂体后叶分泌出的激素, 其中一个是控制子宫收缩的后叶催产素, 另一个是使血压增高的后叶增压素。他成功地解决了这两个多肽激素的结构问题。在合成催产素时, 一步一步地把链加长, 然后使之形成一个环,最后完成了多肽激素的合成工作。维格诺德由于在生物化学方面所做的重要工作, 特别是第一次合成了多肽激素而获得了1955年诺贝尔化学奖。美国化学家桑格(F.Sanger)经过多年的研究,找到一种试剂(2,4-二硝基氟化苯(桑格试剂)),用以测定胰岛素的分子结构。后经10年的努力,应用逐段分解和逐步递增的方法,测定出胰岛素两条肽链分别含有的21个和30个氨基酸的排列顺序和位置,并于1955年测定了胰岛素的一级结构,从而为胰岛素的实验室合成奠定了基础,促进了蛋白质结构的研究,打开了测定蛋白质结构之门,桑格因此而获得1958年诺贝尔化学奖[3]。桑格后来又因设计出一种测定DNA内核苷酸排列顺序的方法,获1980年诺贝尔化学奖。
蛋白质研究是20世纪50年代的热点,我国科学家在1958年确立的合成胰岛素的课题, 也是建立在当时蛋白质化学发展的基础之上;并于1965年在世界上首次用人工方法成功地合成了具有生物活性的蛋白质——结晶牛胰岛素。
蛋白质的生物活性不仅决定于蛋白质分子的一级结构,而且与其特定的空间结构密切相关。1959年,英国化学家佩鲁茨(F.Perutz)和肯德鲁(C.Kendrew)利用X射线对血红蛋白和肌血蛋白等球状蛋白进行结构分析,提出肌红蛋白的三维空间结构分子模型,获1962年诺贝尔化学奖。
在一级结构和空间结构研究的基础上,科学家开始探索二者之间的关系。1961年,美国化学家安芬森(B.Anfinsen)研究了核糖核酸酶的去折叠和重折叠过程,发现在相同的环境中去折叠的蛋白质都会恢复到原来的空间结构,认为蛋白质链会以自由能最低的方式形成三维结构,由此推测蛋白质的折叠密码隐藏在氨基酸排序中,即所谓的安芬森原则:蛋白质一级排序决定三维结构。化学家穆尔(S.Moore)和斯坦(H.Stein)因共同开发蛋白质分析仪,研究核糖核酸酶分子的活性中心与化学结构,阐明核糖核酸分解酵素的氨基酸序列及其立体结构关系,并开发了利用离子交换管柱分析氨基酸组成的方法,测定出牛胰脏核糖核酸酶分子的氨基酸序列,并阐明了其化学组成与活性机制。他们共同获得1972年诺贝尔化学奖。
随着研究的深入,对蛋白质结构的研究越来越多地利用了物理的方法。如电子晶体学(二维电镜技术)、X射线衍射晶体学、核磁共振技术等。
英国化学家克鲁格(A.Klug)自1962年起在剑桥大学的分子生物实验室从事病毒、染色体等的电子显微镜研究,利用X射线照射于电子显微镜,阐明蛋白质、核酸的微结构以及核酸和蛋白质复合物的立体结构;并利用电子显微镜开发出立体结构分析法,阐明了烟草镶嵌病毒的三维结构,获得1982年诺贝尔化学奖。20世纪50年代后,豪普特曼(A.Hauptman)和卡尔勒(J.Karle)建立了以应用X射线分析的直接法测定晶体结构的纯数学理论,在晶体研究中具有划时代的意义,特别是在研究大分子物质如激素、抗生素、蛋白质及新型药物分子结构方面起了重要作用,他们因此获1985年诺贝尔化学奖。
德国化学家戴森霍费尔(J.Deisenhofer)、胡贝尔(R.Huber)和米歇尔(H.Michel)确定了光合反应中心的三维结构。将担负光合作用中心任务的一种膜蛋白质分离出来后,利用X射线分析这种膜蛋白质的晶体,既阐明了光合作用的机制,也阐明了与膜蛋白质有关的神经传导机制,由于这方面的杰出工作,获得1988年诺贝尔化学奖。
瑞士联邦技术研究所的库尔特·维特里希(K.Wuthrich)、日本化学家田中耕一(K.Tanaka)和美国的约翰·芬恩(J.Fenn)开创性地应用核磁共振光谱鉴定和分析了蛋白质等生物大分子的结构,获得2002年诺贝尔化学奖[4]。
由上述研究的获奖历程可以看出,化学家对蛋白质结构的研究,是一个不断认识的过程,研究方法由低级向高级发展,由起初的试剂法到X射线衍射晶体学、电子晶体学、核磁共振技术等方法;由蛋白质的氨基酸排列顺序测定转向空间结构的探讨。对蛋白质结构所做的详细分析,使人们对生命过程有了更深入的了解。
2.3.2 蛋白质功能的研究
蛋白质是一类能对环境做出自发响应的、复杂而神奇的大分子化学物质。我们身体内的任何功能,从催化生物化学反应到抵御外来侵略都是蛋白质作用的结果。我们能行走、运动,靠的是肌肉中肌动蛋白的工作;我们身体的骨架是由蛋白质骨胶原加强的;细胞的分裂也是通过蛋白质调节控制的。
人类对于蛋白质功能的认识是循序渐进、不断发展的。最早被赋予特定生物学功能的蛋白质是血红蛋白。1864年,利用分光光度计已经观察到了血红蛋白具有可逆结合氧气的能力。同时,人们也逐渐认识到生物能量产生的重要途径之一是氧气参与细胞中的氧化反应。这使人们逐渐认识到血红蛋白的功能是输送氧气。
在1926~1930年间,美国化学家萨姆纳(B.Sumner)、诺斯鲁普(H.Northrop)和斯坦利(M.Stanley)通过结晶和活性测定研究,揭示出具有生物催化功能的酶分子也是蛋白质,这对蛋白质功能的认识是一次飞跃性的发展。在之后的研究工作中,蛋白质功能的研究可分为两种模式:一是先分离鉴定某种蛋白质,然后再试图揭示其生理功能。美国诺斯鲁普精制酵素与病毒蛋白质,发明了丙酮发酵法,成功地将胃液酵素、胰蛋白酶、胃蛋白酶、胰凝乳蛋白酶、胰蛋白酶原结晶化,并阐明了这些蛋白质的性质,获得了1946年诺贝尔化学奖。瑞典的蒂塞留斯(K.Tiselius)是1948年诺贝尔化学奖得主,他主要研究电泳及吸附分析,发现了血清蛋白质的复合性。利用蒂塞留斯电泳装置,将血清蛋白质分成白蛋白及α、β、γ球蛋白,开发出滤纸电泳法、隔间法等,可用于分析氨基酸、蛋白质。
1992年,费希尔(E.Fischer)、克雷布斯(E.Krebs)因发现了蛋白质的可逆磷酸化调节机制;1994年,吉尔曼(G.Gilman)和罗德贝尔(M.Rodbell)因发现G蛋白及其在细胞中传导信息的作用;1999年,布洛贝尔(G.Blobel)因发现蛋白质由内部信号决定蛋白质在细胞内的转移和定位;2000年,卡尔森(A.Carlsson)、格林加德(P.Gireengard)、坎德尔(E.Kandel)因研究其他蛋白质相互作用而产生自身调节机制等分别获得诺贝尔生理或医学奖[5]。
2004年,诺贝尔化学奖授予了在揭示蛋白质标记与降解的过程中做出卓越贡献的以色列化学家切哈诺夫(A.Cichanove)、赫尔什科(A.Hershko)和美国化学家罗斯(I.Rose);表彰他们找出了蛋白质分解的秘密——泛素调节的蛋白质降解过程。泛素是由76个氨基酸组成的多肽,在蛋白质降解过程中起类似标签的作用。这项开创性的研究在进一步揭示生命的奥秘以及在医学研究中具有重要意义[6]。
蛋白质功能研究的另外一种模式是从已知的特定生理功能(如免疫防御、视觉等)开始,揭示参与的蛋白质种类。如2008年度诺贝尔化学奖获得者下村修(O.Shimomura)、查尔菲(M.Chalfie)以及钱永健,他们因发现和研究绿色荧光蛋白(简称GFP)而获奖。他们根据水母可以发光的生理现象,经实验研究发现了绿色荧光蛋白后又进一步研究其功能。通过把GFP连接到一个蛋白质上,可以跟踪其运动并看到它与其他蛋白质的相互作用。正是得益于GFP的绿光,现在科学家已经能够在显微镜下对单个蛋白质进行追踪[7]。
从本质上讲,蛋白质功能是蛋白质间相互作用的一种关系,因此这对解决蛋白质相互作用问题具有举足轻重的意义。目前,这方面的研究大致可分为两个方向:一是从微观层次建立模型,模拟蛋白质结构间的相互作用。二是宏观地从系统科学的角度研究蛋白质相互作用网络,从而探索生化途径中的代谢和调控功能[8]。
2.3.3 蛋白质组学的发展
20世纪90年代以来,随着人类及一些物种基因组测序的顺利完成,分子遗传学已形成了较为完备的研究技术和理论体系,生命科学已进入后基因组时代。1995年,Wasinger等人提出了蛋白质组学(proteomies)的科学概念[9]。蛋白质组学就是从整体的角度出发来研究细胞内蛋白质的组成及其活动规律的一门科学。基因虽能提供蛋白质一级结构的信息,但翻译后的多肽又需经历翻译后的加工修饰才能形成具有一定生物学功能的蛋白质。这些加工修饰的类型有200来种,其中最重要的是苏氨酸、丝氨酸残基的磷酸化反应;其次是糖基化、乙酰化、脱氨基及多种酸化反应以及蛋白质水解等。换句话说,一个基所对应的蛋白质不是一种而可能是几种甚至是数十种。再者,包容了数千甚至数万种蛋白质的细胞是如何运转的? 或者说这些蛋白质在细胞内是怎样工作,如何相互作用、相互协调的? 所有这些工作必须由蛋白质组学研究来完成。
蛋白质组学不同于传统蛋白质学科之处在于它所研究的内容涵盖了某个机体或某个细胞全部的蛋白质的结构和功能,其研究的目的是阐明生物体全部蛋白质的表达模式与功能模式,内容十分广泛,包括蛋白质的表达、存在方式(化学修饰)、结构与功能的相互依赖关系以及从某个生物体或某个细胞全部蛋白质整体活动角度揭示与阐明生命活动的基本规律。从技术上讲,蛋白质组学可划分为3种类型: 第一类是蛋白表达蛋白质组学(proteinexpression proteomics ),它是定量研究蛋白质表达的技术;第二类是结构蛋白质组学(structural proteomics ), 主要任务是阐明蛋白质复合体或一个细胞器内的蛋白质的结构;第三类是功能蛋白质组学(functional pro-teomics),主要任务是从分子水平分析亚细胞结构中蛋白质在功能上的组织构成及蛋白质表达谱。
蛋白质的种类与数量在同一机体内的不同细胞中各不相同,即使同一细胞在不同的细胞周期、不同条件下,蛋白质组也是不断变化的,而且在病理条件下或药物治疗过程中,细胞蛋白质组成与正常生理情况下也不尽相同。其次,蛋白质的翻译后修饰使一个mRNA所能产生的蛋白质数量远远多于基因数量,况且蛋白质不能像DNA那样能被扩增,低水平蛋白质难于被检测出来。因此,蛋白质组学研究包括用现代分析技术和手段对蛋白质进行分离、鉴定及图谱制作等。
3 蛋白质研究的启示
从百年诺贝尔科学奖来看,蛋白质化学的研究不等同于传统意义上的化学,它是一个交叉学科,涉及到化学、生物学以及物理学的方法等,因此它可以授予化学奖,也可以授予生理或医学奖。
蛋白质化学研究历程预示着在“后基因组时代”的生物化学中,蛋白质结构研究具有战略性的关键地位。以蛋白质为主的生物大分子的功能主要决定于它们的三维结构及其运动。因此,对有机体重要生命活动规律的研究,不仅需要基因的信息,还必须全面了解相关蛋白质的精细三维结构及其功能的关系。例如,80多年前菲比格(G.Fibiger)发现了癌基因,并因此获得了1926年的诺贝尔生理或医学奖(后来认为是错误的理论)。自那时以来,关于这些基因及其相关蛋白质序列已被作为研究的热点,但其致癌的分子机理始终不清楚。直到1997年,随着对朊病毒的精细三维结构的测定,才精确揭示了其致病机理,并因此获得了诺贝尔奖。美国人普鲁西纳(S.Prusiner)发现的朊病毒揭示了某些疑难病症是与特定蛋白质的错误折叠和有害结构相关。了解了这些疑难病症的分子机理,对于推动新药设计和研发,有重要的现实意义。这些实例充分说明了基因与蛋白质、蛋白质的结构与功能以及蛋白质与生命活动等方面的关系。
蛋白质的研究历程还表明,研究方法和研究手段上的重大突破,是取得一系列科学成就并导致重大科学发现的关键因素。费歇尔所运用的分析合成方法,桑格所运用的一系列物理化学方法,切哈诺夫等人所运用的泛素调节方法,这些方法给他们带来的成功,有力地证明了这一科学发展规律。
从蛋白质的研究历程中,我们还可以清晰地看到科学认识是无止境的,不存在永恒不变的科学真理。科学在本质上是相对的、可变的、处在不断的修正和发展过程中。从费歇尔创立多肽结构理论到桑格揭秘胰岛素的结构,再到维特里希描绘蛋白质的三级结构,充分说明了相对性和动态性是科学的本质,也为我们渗透科学价值观教育提供了良好素材。
参 考 文 献
[1] 马静,葛熙,昌增益.生命科学,2007,19(3):294
[2] 王秋,张潇文,高锋.化学教学,2007(1):41
[3] 吴祺.中学化学教学参考,2007(5):38
[4] 张守林,马宏佳,陶亚奇.化学教育,2003(1):4
[5] 倪菊华,周爱儒.中国生物化学与分子生物学报,2009,25(5):393
[6] 朱永侃.化学教学,2004(12):32
[7] 杨梅,刘艳梅,刘克文.化学教育,2009(1):6
[8] 唐泽耀,戴淑芳,陈华,等.医学与哲学,2005,26(1):53
[9] 李文凯,李子博.长沙医学院学报,2007,12(25):31

