关于质子条件式的书写*
赵冉 李荣华 杨正亮
(1西北农林科技大学资源环境学院 陕西杨凌 712100;2西北农林科技大学理学院 陕西杨凌 712100)
酸碱水溶液是复杂的多重平衡体系,各物种平衡浓度之间的关系复杂;质子条件式是处理酸碱平衡体系最简单、最直接的方法,能反映各物种平衡浓度和起始浓度之间的关系。然而目前很多教材对质子条件式的书写步骤讨论得不够清楚或者很简单[1-4],导致在写质子条件式时出现各种问题。例如在文献[2]和文献[4]的缓冲容量一节中,质子条件式的书写都出现了问题,详见后文;而文献[3]没有在这一节写出质子条件式。本文旨在给出一个书写质子条件式的完整而且清楚的步骤,以解决酸碱质子理论体系中任意类型酸碱体系质子条件式的正确书写问题。
1 酸碱质子理论基本概念
在酸碱质子理论中:能给出质子(H+)的物质是酸,能接受质子的是碱,既能给出质子又能接受质子的是两性物质。能给出一个质子的是一元酸,可表示为HA,能给出n个质子的是n元酸,可表示为HnA;同理,能接受n个质子的是n元碱。当某酸失去一个质子,剩余的部分称为该酸的共轭碱,该酸与其共轭碱合称为共轭酸碱对;同理,当某碱接受一个质子,得到的物质称为该碱的共轭酸,该碱与其共轭酸也合称为共轭酸碱对。即共轭酸碱对在组成上只相差一个质子。

2 质子条件式的书写步骤
酸碱反应的实质是两对或两对以上的共轭酸碱对之间的质子转移。在质子转移过程中酸失去的质子正是碱得到的质子,故在变化过程中,酸失质子总数等于碱得质子总数,即质子平衡。根据质子平衡和相关型体的量列出的等式即质子条件式或质子平衡方程(proton balance equation),简称PBE。
书写质子条件式时应遵循以下步骤:
① 确定参加酸碱反应(即质子转移)的相关型体的组数。
② 选取质子得失的参考水准或零水准,选取原则是一组相关型体中必须选且只能选一种型体,理论上可以选该组相关型体内的任意一种型体。通常情况下,应选择起始的酸碱组分或者溶液中大量存在的型体。
③ 确定相对于参考水准的得质子产物,确定每一种得质子产物相对于参考水准在组成上相差的质子数目称为系数,确定每种得质子产物反应前的量和反应后的量,用每种得质子产物的反应后的量减去反应前的量再乘以各自的系数来表示与每种得质子产物相关的得质子的数目。同理可确定每种失质子产物,确定每种失质子产物的系数,确定每种失质子产物反应前的量和反应后的量,用每种失质子产物的反应后的量减去反应前的量再乘以各自的系数来表示与每种失质子产物相关的失质子的数目。一般酸碱反应为均相溶液反应,在同一体系中,每种组分的反应前后的量可以用浓度表示。
④ 确定得质子总数和失质子总数,并划上等号。
例如假设某体系中只有二元弱酸H2A和一元弱碱D,H2A和D自身都不发生质子自递反应,该体系中的反应只有以下两个,H2A+D=HA-+HD+和H2A+2D=A2-+2HD+,质子条件式的书写步骤如下:
① 有两组相关型体,分别为H2A和HD+。
② 选H2A和D作为参考水准。
③ D得质子产物为HD+,系数为1,D得的质子数为c(HD+)末-c(HD+)始,H2A不得质子;H2A失质子产物为HA-和A2-,系数分别为1和2,H2A失的质子数为c(HA-)末-c(HA-)始+2(c(A2-)末-c(A2-)始),D不失质子。
④c(HD+)末-c(HD+)始=c(HA-)末-c(HA-)始+2(c(A2-)末-c(A2-)始)
(1)
式(1)即为质子条件式。
也可以选择HA-和D作为参考水准。得质子产物HD+,系数为1,c(HD+)末-c(HD+)始;得质子产物H2A,系数为1,c(H2A)末-c(H2A)始;失质子产物为A2-,系数为1,c(A2-)末-c(A2-)始。
相应的质子条件式为:
c(HD+)末-c(HD+)始+c(H2A)末-c(H2A)始=c(A2-)末-c(A2-)始
(2)
式(1)和式(2)是等价的,因为式(1)-式(2)整理得到的公式
c(H2A)始+c(HA-)始+c(A2-)始=c(H2A)末+c(HA-)末+c(A2-)末
是始终成立的。
同理,选择A2-和D作参考水准,质子条件式为:
c(HD+)末-c(HD+)始+2(c(H2A)末-c(H2A)始)+c(HA-)末-c(HA-)始=0
(3)
选择A2-和HD+作为参考水准,质子条件式为:
2(c(H2A)末-c(H2A)始)+c(HA-)末-c(HA-)始=c(D)末-c(D)始
(4)
选择HA-和HD+作参考水准,质子条件式为:
c(H2A)末-c(H2A)始=c(A2-)末-c(A2-)始+c(D)末-c(D)始
(5)
选择H2A和HD+作参考水准,质子条件式为:
0=c(HA-)末-c(HA-)始+2(c(A2-)末-c(A2-)始)+c(D)末-c(D)始
(6)
式(1)~式(6)都是H2A和D反应体系的质子条件式,并且都是等价的。
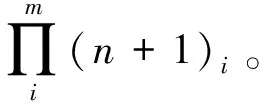
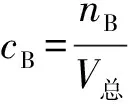
3 应用举例
① H2O,参考水准选为H2O,质子条件式为[H3O+]=[OH-]。
② 强酸如盐酸HCl(c0),参考水准选为H2O,可看作H3O+的起始浓度为c0,质子条件式为[H3O+]-c0=[OH-]。
③ 强碱如NaOH(c0),参考水准选为H2O,可看作OH-的起始浓度为c0,质子条件式为[H3O+]=[OH-]-c0。
④ 一元弱酸HAc(c0)溶液,参考水准选为HAc和H2O,质子条件式为[H3O+] =[OH-]+[Ac-]。
⑤ 盐酸HCl(c1)、NaOH(c2)和弱酸HA(c3)混合溶液,参考水准选为HA和H2O,质子条件式为[H3O+]-c1=[OH-]-c2+[Ac-]。

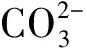
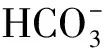

⑩ 共轭酸碱对体系,HB(ca)和NaB(cb)混合溶液,(i) 参考水准选为HB和H2O,质子条件式为[H3O+]=([B-]-cb)+[OH-];(ii) 参考水准选为B-和H2O,质子条件式为[H3O+]+([HB]-ca)=[OH-]。
4 详例
混合后的共轭酸碱对HD-NaD溶液中,起始浓度分别为c(HD),c(D-),请写出平衡后该体系的质子条件式。因为体系无法写成仅由平衡浓度构成的质子条件式,所以很多学生都不会写该体系的质子条件式。在化学教材中,通常都是先利用物料平衡再利用电荷守恒,步骤如下:物料守恒:[Na+]=c(D-),[HD]+[D-]=c(HD)+c(D-);电荷守恒:[Na+]+[H+]=[D-]+[OH-],得出[D-]=c(D-)+[H+]-[OH-],[HD]=c(HD)-[H+]+[OH-],这样虽然能得到正确的表达式,但并没有遵循书写质子条件式的规律。
用本文给出的书写步骤为:
① 确定有两组相关型体HD,H3O+。
② 参考水准对H3O+选H2O。
对H2O,得质子产物为H3O+,起始浓度为0,末浓度为平衡浓度为[H3O+],系数为1,得质子数为[H3O+]-0;失质子产物为OH-,起始浓度为0,末浓度为平衡浓度为[OH-],系数为1,失质子数为[OH-]-0。
选HD参考水准,失质子产物D-,起始浓度不为0,为c(D-),末浓度为平衡浓度为[D-],系数为1,失质子数为[D-]-c(D-)。
③ 故质子条件式为[H3O+]-0=[OH-]-0+[D-]-c(D-),整理得[D-]=c(D-)+[H3O+]-[OH-]。
④ 还可选D-参考水准,同理有[H3O+]-0+[HD]-c(HD)=[OH-]-0,整理得[HD]=c(HD)-[H3O+]+[OH-]。
如果在这个体系中加入少量NaOH,体系总体积不变,使得NaOH的起始浓度为bmol/L,质子条件式的写法是,只需将共轭体系中OH-起始浓度用b代替,即可得到质子条件式为[H3O+]-0=[OH-]-b+[D-]-c(D-),整理得b=[OH-]-[H3O+]+[D-]-c(D-)。
同理,如果在这个体系中加入少量HCl,使HCl的起始浓度为amol/L,则质子条件式为[H3O+]-a=[OH-]-0+[D-]-c(D-),整理得a=[H3O+]-[OH-]-[D-]+c(D-)。
如果在这个共轭体系中先加入了NaOH固体使NaOH的起始浓度为bmol/L,又加入了HCl,使HCl的起始浓度为amol/L,则质子条件式可根据上文一步写出为[H3O+]-a=[OH-]-b+[D-]-c(D-),不必像以往先比较是加入的酸多还是碱多,然后再处理成是共轭体系中只加入酸或只加入碱的情况。即只需知道参与质子转移的每个物种的起始浓度,再根据本文给出的书写步骤,即可写出准确的质子条件式。
参 考 文 献
[1] 呼世斌,黄蔷薇.无机及分析化学.第3版.北京:高等教育出版社,2010
[2] 武汉大学.分析化学.第3 版.北京:高等教育出版社,1997
[3] 武汉大学.分析化学.第4版.北京:高等教育出版社,2000
[4] 武汉大学.分析化学(上册).第5版.北京:高等教育出版社,2006

