肉桂提取物对α-葡萄糖苷酶的抑制作用
许 芹 永, 宋 青 楠, 朱 靖 博, 萧 伟
( 1.大连工业大学 植物资源化学与应用研究所, 辽宁 大连 116034; 2.江苏康缘药业股份有限公司, 江苏 连云港 222001 )
0 引 言
α-葡萄糖苷酶抑制剂可竞争性抑制小肠内α-葡萄糖苷酶的活性,延缓或抑制葡萄糖在肠道的吸收。由于其独特的作用特点,已第3次被亚太地区糖尿病治疗药物指南推荐为降餐后血糖水平的一线药物[1]。人工合成的α-葡萄糖苷酶抑制剂除价格昂贵之外,在临床上也会伴随强烈的副作用,因此天然α-葡萄糖苷酶抑制剂的发现,特别是从药食两用中药中寻找新的α-葡萄糖苷酶抑制剂成分,成为医学界和食品界研究的热点。
药食两用中药肉桂为樟科植物肉桂CinnamomumcassiaPresl的干燥树皮,其性味辛、甘、大热,具有补火助阳、引火归源、散寒止痛、活血通经的功能。目前对于肉桂降血糖的研究已有相关报道[2-3],但都只是针对某一极性部位的研究。本实验系统地对肉桂提取物的α-葡萄糖苷酶抑制活性进行评价,并对活性最高的正丁醇部位进行酶抑制动力学研究,为寻找新的α-葡萄糖苷酶抑制剂提供理论依据。
1 实 验
1.1 材料与仪器
肉桂购自河北安国中药材市场;α-葡萄糖苷酶(EC 3.2.1.20,面包酵母,纯度≥10 U/mg),Sigma公司;对-硝基苯基-α-D-吡喃葡萄糖苷,PNPG,纯度99%,Sigma公司;对-硝基酚,PNP,分析纯;牛血清白蛋白,BSA,纯度≥95%,Sigma公司;阿卡波糖片,Acarbose,50 mg/片,拜耳医药保健有限公司。
UltiMate 3000高效液相色谱分析仪;微型植物粉碎机;SK250H超声波清洗器;PNS-3C型pH酸度计;SK-1型快速混匀器; DZF-6050真空冷冻干燥机。
1.2 实验方法
1.2.1 肉桂提取物的制备
将干燥肉桂皮粉碎,用95%甲醇加热回流提取3次,过滤后合并3次滤液并减压回收甲醇至小体积,将浓缩的提取物分散在水中,依次用等体积石油醚、二氯甲烷、乙酸乙酯和饱和正丁醇萃取3次,回收溶剂至干,分别得石油醚部位(PE)、二氯甲烷部位(MC)、乙酸乙酯部位(EA)、正丁醇部位(BU)和水部位(AQ)提取物。
1.2.2 α-葡萄糖苷酶抑制活性的筛选方法
1.2.2.1 α-葡萄糖苷酶抑制活性的测定
本实验所采用的反应体系是参照朱文佳[4]的方法,并在其基础上稍加改进,具体如下:将0.067 mol/L pH 6.8的磷酸盐缓冲溶液25 μL、待测样品5 μL、0.1 U/mL α-葡萄糖苷酶30 μL,振荡混匀,37 ℃恒温孵育20 min,加入4.0 mmol/L PNPG 20 μL,振荡混匀,37 ℃恒温反应30 min后,加入0.2 mol/L Na2CO380 μL终止反应。超纯水稀释至500 μL,振荡混匀,经0.45 μm膜过滤后,用HPLC检测,求得α-葡萄糖苷酶的抑制活性。
1.2.2.2 检测方法
本实验利用高效液相色谱法(HPLC)对酶解生成PNP进行检测,按照下式计算抑制率,并用Origin软件求出相应的IC50值。
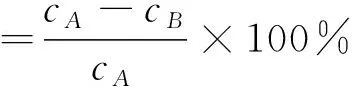
式中:cA为不加肉桂提取物时PNP的浓度(扣除相应空白),mmol/L;cB为加入肉桂提取物后PNP的浓度(扣除相应空白),mmol/L。同时设有空白对照组和阳性对照组(Acarbose)。
色谱条件:Sino Chrom ODS-BP色谱柱(5 μm,4.6 mm×250 mm,大连依利特分析仪器有限公司);流动相:A为乙腈,B为含0.1%甲酸的水溶液。梯度洗脱条件为:0~8 min,20%~30% A;8~13 min,30%~80% A;13~18 min,80%~20% A;18~28 min,20% A。体积流量,1.0 mL/min;进样量,20 μL;柱温,常温;检测波长,315 nm。
1.2.2.3 标准曲线
根据采用的反应体系,精确称取0.109 8 g PNP标准品,用PBS(磷酸盐缓冲溶液,0.067 mmol/L,pH=6.8)超声溶解,定容于25 mL 容量瓶中,配制成31.25 mmol/L的PNP母液,将其稀释成1 250、625、312.500、62.500、31.250、15.625 μmol/L。分别各取80 μL,加入80 μL 0.2 mol/L Na2CO3溶液,用超纯水稀释至500 μL,混匀,过0.45 μm滤膜用液相色谱分析。以PNP峰面积为纵坐标, PNP浓度为横坐标,绘制标准曲线。
1.2.2.4 抑制作用类型的确定
在抑制剂量一定的条件下,加入不同浓度(0.5、1.0、2.0、4.0、8.0 mmol/L)的底物PNPG,测定酶活力。而后改变抑制剂的量,得出一系列不同底物浓度下的酶活力,按Lineweave-Burk作图法,绘制1/[S]~1/V双倒数曲线,确定其动力学特征及其Km、Ki值。
2 结果与讨论
2.1 PNP标准曲线
按照“1.2.2.2”的方法绘制标准曲线,求得回归方程为y=1 971x-5.134 8,R2=0.999 9,说明PNP在0~1.25 mmol/L线性关系良好。
2.2 不同提取部位的α-葡萄糖苷酶抑制活性
肉桂不同部位提取物对α-葡萄糖苷酶的抑制活性见表1。表1显示,同一浓度下,肉桂各部位提取物均有一定的α-葡萄糖苷酶抑制活性,且活性都高于对照组Acarbose。当样品浓度为625 μg/mL 时,乙酸乙酯部位和正丁醇部位的抑制率均能达到100%。通过对各部位的半数抑制浓度IC50的测定,可得正丁醇部位的IC50(IC50=83.10 μg/mL)小于乙酸乙酯部位的IC50(IC50=123.59 μg/mL),所以正丁醇部位的抑制活性高于乙酸乙酯部位。另外各部位的IC50都小于Acarbose的IC50,尤其是肉桂正丁醇提取物最低,显示非常强的α-葡萄糖苷酶抑制活性,因此对该部位进行了酶的抑制动力学研究。
表1 不同提取物的α-葡萄糖苷酶抑制活性
Tab.1 α-Glucosidase inhibitory activity of extracts ofCinnamomicassia

样品ρ/(μg·mL-1)抑制率/%IC50/(μg·mL-1)Acarbose62548.021 028.99PE62582.77350.37MC62569.33408.77EA625100.00123.59BU625100.0083.10AQ62585.95235.26
2.3 提取物质量浓度对α-葡萄糖苷酶抑制活性影响
由图1可见,在一定质量浓度范围内,肉桂5个部位提取物的α-葡萄糖苷酶抑制活性与其浓度均呈剂量依赖关系,即随着提取物质量浓度的升高,抑制率增大,而且当抑制率增大到一定水平时,不再随着提取物质量浓度的升高而明显提高。

图1 提取物质量浓度对α-葡萄糖苷酶抑制活性的影响
Fig.1 Effect of concentration of extracts on inhibitory activity of α-glucosidase
由图1可见,正丁醇部位在五者中抑制率最高,抑制率随质量浓度升高迅速升高,最大抑制率达到100%。乙酸乙酯部位和正丁醇部位提取物的活性相差不大,两种提取物分别在250.00和375.00 μg/mL时能达到最高抑制率100%。而肉桂石油醚部位、二氯甲烷部位及水部位在质量浓度为500.00 μg/mL时,抑制率随着质量浓度的增加而增大,但当增大到625.00 μg/mL时,抑制率分别达到82.77%、69.33%和85.95%。再增加提取物质量浓度,抑制率增加缓慢,达到一个“平台期”。由此可见,这3个部位提取物的抑制率不能达到100%,这可能是由于它们含有的有效成分不同,从而导致作用机制不同。
2.4 肉桂正丁醇部位的抑制动力学研究
肉桂的正丁醇部位分别取合适的2个不同质量浓度,PNPG取合适的5个不同摩尔浓度,分别测定反应速度。按Lineweaver-Burk作图法,以1/V为纵坐标,1/[S]为横坐标,绘制出酶抑制作用动力学曲线,得到α-葡萄糖苷酶的米氏常数Km为1.37 mmol/L,最大反应速度Vmax为0.039 mmol/L。

图2 正丁醇提取物Lineweaver-Burk双倒数曲线
由图2可以看出,随着抑制剂浓度的增大,酶的最大反应速度Vmax和米氏常数Km均减小,判断其对α-葡萄糖苷酶抑制活性作用属反竞争性抑制作用[5]。根据反竞争性抑制动力学方程:
3 结 论
肉桂各部位提取物对α-葡萄糖苷酶均具有一定的抑制活性,且与质量浓度呈正相关性。其中,正丁醇部位的活性最高,张忠[6]的研究曾指出,肉桂的乙醇索氏提取物中的α-葡萄糖苷酶抑制活性成分为鞣质类。抑制动力学研究表明,其抑制类型为反竞争性抑制,为肉桂开发为降糖药物提供了理论参考数据。
[1] LEVETTAN C. Oral antidiabetic agents in type 2 diabetes[J]. Current Medical Research and Opinion, 2007, 23(4):945-952.
[2] 胥新元,彭艳梅,彭源贵,等. 肉桂挥发油降血糖的实验研究[J]. 中国中医药信息杂志, 2001, 8(2):26.
[3] KIM S H, HYUN S H, CHOUNG S Y. Anti-diabetic effect ofCinnamonextract on blood glucose in db/db mice[J]. Journal of Ethnopharmacology, 2006, 104(1/2):119-123.
[4] 朱文佳. 中药中抑制α-葡萄糖苷酶活性组分的研究[D]. 大连:大连工业大学, 2010:4.
[5] 陈静坤,姚江武. 红茶和绿茶与人唾液α-淀粉酶相互作用的酶促反应动力学研究[J]. 口腔医学, 2010, 26(4):471-474.
[6] 张忠. 中药肉桂提取物对α-葡萄糖苷酶的抑制作用研究[D]. 上海:上海大学, 2006:66.

