厄贝沙坦联合格列齐特对2型糖尿病大鼠肾功能的保护作用与机制
兰海涛,刘红,买文丽,刘行海,刘华,郑倩
(川北医学院生理学教研室,南充 637000)
随着肥胖人群的快速增长,2型糖尿病(type 2 diabetes mellitus,T2DM)患者数量也不断增加。据全国糖尿病研究协作组报告[1],我国糖尿病患病人数已经超过9 000万,潜在患者超过6 000万,成为世界第一糖尿病大国。在所有糖尿病患者中,90%以上都是T2DM[2]。糖尿病肾病对患者生存质量具有显著影响,也是糖尿病患者主要死亡原因之一[3],探索糖尿病肾脏功能保护的治疗方案,具有重大的临床和社会价值。近年来研究[4,5]表明,肾素-血管紧张素系统(renin-angiotensin system,RAS)不仅存在于循环系统中,也存在于局部组织中,肾组织长期RAS活跃,可以引起肾脏微循环血管的损害,肾脏系膜细胞纤维化,最终导致肾脏组织结构重塑,造成肾脏功能严重受损。所以,本实验探索在传统降血糖药物格列齐特基础上,联合厄贝沙坦治疗糖尿病大鼠,观察其对模型大鼠肾脏功能的影响。
1 材料与方法
1.1 主要试剂及仪器
格列齐特片Ⅱ(天津华津制药厂)、厄贝沙坦(广州海瑞药业有限公司)、链脲佐菌素(STZ,Sigma公司),总胆固醇(TC)、甘油三酯(TG)、血肌酐(Cr)、血尿素氮(BUN),钠泵检测试剂盒(南京建成生物公司)、血清胰岛素(FINS)检测试剂盒(上海市生物制药研究所),快速血糖测定仪及芯片(三诺SXT-1型,长沙)、无创尾动脉血压测量分析系统(北京众实迪创科技公司)。每100mL蒸馏水中溶入1.0g格列齐特Ⅱ和0.5g厄贝沙坦。
1.2 实验动物及饲料
雌性Wistar大鼠,2月龄,清洁级,体质量130~160g。普通饲料:6%脂肪、22%蛋白质、57%碳水化合物、7%纤维素和8%其他成分。高能饲料(62%常规饲料、20%蔗糖和18%猪油)。
1.3 动物模型建立与分组
参照实验室传统方法[6]建立糖尿病大鼠模型:80只实验大鼠,16只用于正常对照,64只用于复制T2DM模型。全部实验大鼠普通饲料适应性饲养1 w,造模大鼠高能饲料饲养4w后一次性腹腔注射STZ 25mg/kg(注射前30min用0.1mol/L枸橼酸液配成0.25%的终浓度)。高能饲料继续饲养4 w后采尾静脉血测定空腹血糖(FBG)、TC、TG、FINS,计算胰岛素敏感指数(insulin sensitivity index,ISI)=-ln(FBG*FINS)[7]。最后选取 FBG>7.8mmol/L,同时伴有ISI降低的48只大鼠作为T2DM模型[8],其余淘汰。将实验大鼠分成正常对照组(A1、A2)、模型对照组(B1、B2)、格列齐特治疗组(C1、C2)、厄贝沙坦联合格列齐特治疗组(D1、D2),每小组n=8,分别用于8w和16w治疗及相应对照实验。治疗组每日给予格列齐特100mg/kg或者厄贝沙坦50mg/kg+格列齐特100mg/kg[9,10],一次性灌胃治疗。正常对照组与模型对照组每日给予等量的溶剂灌胃。在治疗期间,全部大鼠都用普通饲料喂养,自由饮水。实验动物分别于治疗后8w末和16w末(期间死亡2只动物)禁食不禁水12h,测尾动脉收缩压(SBP),30mg/kg戊巴比妥钠麻醉后从心脏采血提取血清用于生化检查、FINS检测,摘取双侧肾脏,去包膜后用滤纸吸干水分后称重,将双肾质量(g)与体质量(kg)之比(KW/BW)作为肾脏肥大指数。左侧肾脏-70℃冻存备用,用于肾皮质的分离和钠泵活性测定。
1.4 指标检测
严格按照试剂盒说明书,血糖仪测定血糖,751分光光度计测定TG、TC、Cr和BUN,放射免疫分析法测定FINS。提取肾皮质,按照钠泵活性检测试剂盒要求,测定钠泵活性。尾动脉测压法:把实验鼠放入40℃控温盒5min后,再放入37℃恒温大鼠固定器中,暴露出实验鼠的尾巴测量SBP,每个实验鼠加温的时间相同。每次测血压时连续记录5个血压读数,舍去最高和最低值,其他3个值的平均值作为此次的血压值。
1.5 统计学方法
所有数据均采用SPSS 13.0软件进行统计分析,计量结果均以均数±标准差(±s)表示,采用方差分析和t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 厄贝沙坦联合格列齐特对T2DM大鼠一般情况的影响
造模结束时,模型大鼠出现明显的糖尿病“三多一少”症状,毛发紊乱,弓背蜷体,精神萎靡,反应迟钝,并且症状随病程逐渐加重。经格列齐特或厄贝沙坦联合格列齐特治疗8w后,上述症状体征明显好转,治疗16w后,情况更进一步好转。
2.2 厄贝沙坦联合格列齐特对T2DM大鼠血脂、血糖和SBP的影响
与同期正常对照组比较,糖尿病模型对照组大鼠8w和16w时,TC、TG、FBG和SBP均显著升高(P<0.01);格列齐特治疗组8w和16w时,TC、TG和SBP均显著升高(P<0.01),FBG差异无统计学意义(P>0.05);厄贝沙坦联合格列齐特治疗8w和16w后,大鼠TC和TG仍显著升高(P<0.01),但FBG和SBP差异无统计学意义(P>0.05)。与模型对照组比较,格列齐特治疗组8w和16w时,大鼠TC、TG和FBG水平显著降低(P<0.01),SBP差异无统计学意义(P>0.05);厄贝沙坦联合格列齐特治疗8w和16w后,大鼠TC、TG、FBG和SBP水平显著降低(P<0.01)。与格列齐特治疗组比较,联合治疗组SBP显著下降(P<0.01),TC、TG和FBG差异无统计学意义(P>0.05)。联合治疗组8w与16w大鼠比较,TC、TG、FBG和SBP差异无统计学意义(P>0.05)(见表1)。
表1 厄贝沙坦联合格列齐特对T2DM大鼠血脂、血糖和SBP的影响(±s)
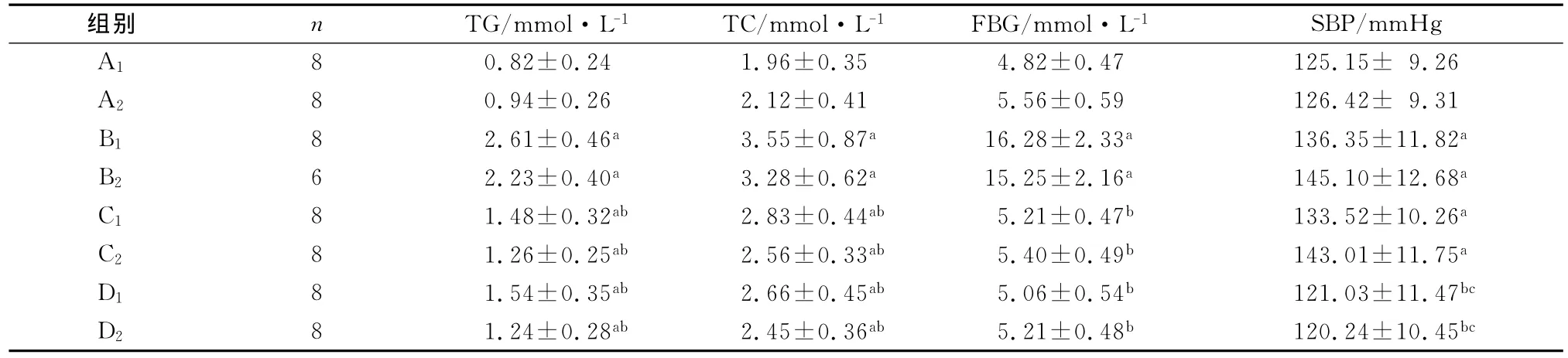
表1 厄贝沙坦联合格列齐特对T2DM大鼠血脂、血糖和SBP的影响(±s)
aP<0.01,与同期A组比较;b P<0.01,与同期B组比较;c P<0.01,与同期C组比较
组别 n TG/mmol·L-1 TC/mmol·L-1 FBG/mmol·L-1 SBP/mmHg A18 0.82±0.24 1.96±0.35 4.82±0.47 125.15± 9.26 A2 8 0.94±0.26 2.12±0.41 5.56±0.59 126.42± 9.31 B1 8 2.61±0.46a 3.55±0.87a 16.28±2.33a 136.35±11.82a B2 6 2.23±0.40a 3.28±0.62a 15.25±2.16a 145.10±12.68a C1 8 1.48±0.32ab 2.83±0.44ab 5.21±0.47b 133.52±10.26a C2 8 1.26±0.25ab 2.56±0.33ab 5.40±0.49b 143.01±11.75a D1 8 1.54±0.35ab 2.66±0.45ab 5.06±0.54b 121.03±11.47bc D2 8 1.24±0.28ab 2.45±0.36ab 5.21±0.48b 120.24±10.45bc
2.3 厄贝沙坦联合格列齐特对T2DM大鼠FINS、ISI、Cr、BUN和KW/BW和肾皮质钠泵活性的影响
与同期正常对照组比较,模型对照组大鼠8w和16w时,FINS、Cr、BUN显著升高,肾皮质钠泵活性和ISI显著降低;模型对照组大鼠16w时,KW/BW也显著升高(P<0.01)。与模型对照组比较,格列齐特治疗组8w和16w时,大鼠FINS、Cr和BUN显著降低,ISI和肾皮质钠泵活性显著降低升高(P<0.01),16w时KW/BW也显著升高(P<0.01);厄贝沙坦联合格列齐特治疗8w和16w时,大鼠FINS、Cr和BUN显著降低,ISI和肾皮质钠泵活性显著升高(P<0.01),16w时KW/BW也显著升高(P<0.01)。与格列齐特治疗组比较,联合治疗组Cr和BUN显著降低,ISI和肾皮质钠泵活性显著升高(P<0.01),16w时KW/BW也显著升高(P<0.01)。联合治疗组8w与16w大鼠比较,16 w时BUN显著降低(P<0.01),其余指标差异无统计学意义(P>0.05)(见表2)。
表2 厄贝沙坦联合格列齐特治疗对T2DM大鼠FINS、ISI、Cr、BUN、KW/BW和肾皮质钠泵活性的影响(±s)
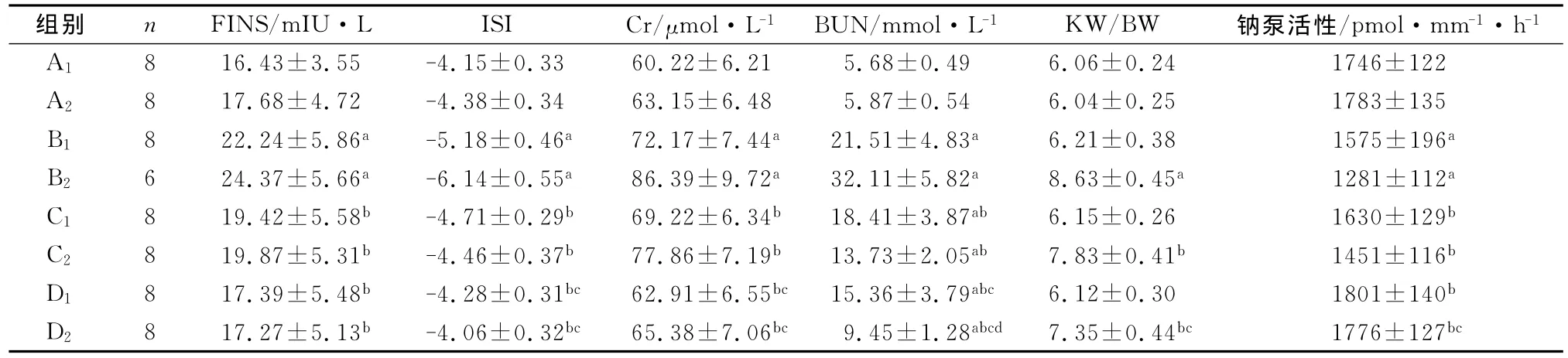
表2 厄贝沙坦联合格列齐特治疗对T2DM大鼠FINS、ISI、Cr、BUN、KW/BW和肾皮质钠泵活性的影响(±s)
aP<0.01,与同期A组比较;b P<0.01,与同期B组比较;c P<0.01,与同期C组比较;d P<0.01,与D1组比较
组别 n FINS/mIU·L ISI Cr/μmol·L-1 BUN/mmol·L-1 KW/BW 钠泵活性/pmol·mm-1·h-1 A1 8 16.43±3.55 -4.15±0.33 60.22±6.21 5.68±0.49 6.06±0.24 1746±122 A2 8 17.68±4.72 -4.38±0.34 63.15±6.48 5.87±0.54 6.04±0.25 1783±135 B1 8 22.24±5.86a -5.18±0.46a 72.17±7.44a21.51±4.83a 6.21±0.38 1575±196a B2 6 24.37±5.66a -6.14±0.55a 86.39±9.72a32.11±5.82a 8.63±0.45a 1281±112a C1 8 19.42±5.58b -4.71±0.29b 69.22±6.34b 18.41±3.87ab 6.15±0.26 1630±129b C2 8 19.87±5.31b -4.46±0.37b 77.86±7.19b 13.73±2.05ab 7.83±0.41b 1451±116b D1 8 17.39±5.48b -4.28±0.31bc 62.91±6.55bc 15.36±3.79abc 6.12±0.30 1801±140b D2 8 17.27±5.13b -4.06±0.32bc 65.38±7.06bc 9.45±1.28abcd 7.35±0.44bc 1776±127bc
3 讨论
实验复制的T2DM大鼠具有中度高血糖、高血脂,FINS不低但ISI显著下降的特点,同时还具有多饮、多食、多尿和精神活动下降的症状,这与人类T2DM的症状和体征十分类似。T2DM模型大鼠经过厄贝沙坦联合格列齐特治疗8w和16w后,血糖血脂、Cr、BUN和FINS显著降低,ISI和肾皮质钠泵活性显著升高,糖尿病“三多一少”的症状也得到不同程度改善,表明厄贝沙坦联合格列齐特对T2DM模型大鼠具有显著的治疗作用。
格列齐特主要作用于胰岛B细胞,可恢复胰岛素生理性分泌模式,提高血中胰岛素水平,同时抑制肝糖原分解,并促进肌肉组织利用葡萄糖,从而降低血糖[11]。
有研究[12]证实,格列齐特可升高血清脂联素,降低白介素-6、肿瘤坏死因子,从而减轻血管的炎症破坏,改善内皮细胞和微循环功能。
研究[13]表明,在高糖状态下,肾脏局部RAS异常活跃。厄贝沙坦为血管紧张素Ⅱ(AngiotensinⅡ,AngⅡ)受体抑制剂,通过选择性地阻断AngⅡ与AT1受体的结合,抑制血管收缩和醛固酮的释放,产生降压作用。近年来研究[14]发现,RAS不仅存在于循环系统中,也存在于局部组织中,机体几乎所有组织器官,如心脏、血管、脑、肾脏、肺脏、肝脏、肾上腺、卵巢、睾丸和脂肪等组织都已证实存在RAS,其在局部组织中的作用甚至超过循环系统中的RAS。长期血管紧张素生成增高,不仅会导致血压升高,还能引起组织结构重塑,造成心、脑、肾、眼等器官的损害。对循环系统中RAS正常的高血压患者,抑制血管紧张素作用的药物也能显著降低患者的血压。如果肾脏组织局部RAS过高,可以引起肾脏微循环血管的损害,肾脏系膜细胞纤维化,最终导致肾脏组织结构重塑,造成肾脏功能严重受损[15]。厄贝沙坦可以选择性阻断AngⅡ与AT1受体结合,降低皮质转化生长因子β1及其Ⅱ型受体mRNA的表达,抑制细胞外基质积聚,减轻肾脏肥大,延缓糖尿病肾病的发展[16,17]。
糖尿病患者肾皮质钠泵活性的变化早于肾脏形态和结构的改变,这种改变可能加重小管与间质细胞的功能和病理损害[18]。研究[19]表明,长期的高血糖,能够激活肾皮质细胞内的蛋白激酶C(protein kinase C,PKC),而PKC能使钠泵磷酸化而降低活性。实验第8周末,肾皮质钠泵活性显著降低,同时Cr和BUN升高,表明肾小管和集合管物质转运功能已经受损,但此时还未发生器质性改变,肾脏未见肥大。16w时,肾皮质钠泵活性进一步降低,Cr和BUN进一步升高,肾脏已经显著肥大,表明肾脏已经由功能损害转为形态改变。不管是格列齐特单独治疗还是厄贝沙坦联合格列齐特治疗8w和16w后,肾皮质钠泵活性降低的效应被显著抑制,Cr和BUN也明显下降,但是实验结果提示联合用药组效果明显优于格列齐特单独治疗组,其原因可能与厄贝沙坦联合格列齐特治疗后,糖尿病大鼠血糖血脂水平下降,对肾皮质细胞膜上钠泵的磷酸化作用减弱导致钠泵活性升高,同时厄贝沙坦抑制了肾脏局部和血液中RAS的活性相关。
综上所述,厄贝沙坦联合格列齐特对T2DM大鼠肾脏功能具有一定的保护作用,而且其作用优于格列齐特单独治疗,其机制可能与联合用药可降低糖尿病大鼠血糖水平,减弱PKC对钠泵的磷酸化,从而稳定肾皮质钠泵活性的同时,厄贝沙坦抑制肾脏局部和血液中RAS的活性有关。
[1]Yang W,Lu J,Weng J,etal.Prevalence of diabetes among men and women in China[J].New England Journal of Medicine,2010,362(12):1090-1101.
[2]薛少华.2型糖尿病患者肾功能损害与缺血性脑卒中关系的研究[J].实用临床医药杂志,2010,14(5):92-94.
[3]丁小强,王一梅.老年人肾脏生理学特点与肾功能衰竭[J].老年医学与保健,2006,12(2):67-69.
[4]李志辉,易著文.洛沙坦对阿霉素致大鼠慢性肾脏损害的长期保护作用[J].湖南医科大学学报,2002,27(4):305-308.
[5]Mezzano SA,Ruiz-Ortega M,Egido J.Angiotensin II and renal fibrosis[J].Hypertension,2001,38(3):635-638.
[6]刘红,罗蕾,高原,等.2型糖尿病大鼠近球小管Na+,K+-ATPase活性变化[J].第三军医大学学报,2006,28(20):2062-2064.
[7]袁国跃,周丽斌,唐金凤,等.糖耐量受损和2型糖尿病患者血清C反应蛋白与胰岛素敏感指数、脂联素的关系[J].中华内分泌代谢杂志,2005,21(6):507-510.
[8]郭啸华,刘志红,李恒,等.实验性2型糖尿病大鼠模型的建立[J].肾脏病与透析肾移植杂志,2000,9(4):351-355.
[9]吴国亭,徐倍,李文君,等.格列齐特对糖尿病大鼠心肌ATP敏感性钾通道mRNA表达的影响[J].第四军医大学学报,2006,27(1):3-5.
[10]陈玲,贾汝汉,丁国华,等.厄贝沙坦对2型糖尿病大鼠肾脏氧化应激和蛋白激酶C活性的影响[J].武汉大学学报:医学版,2004,25(2):150-153.
[11]陈宏.格列齐特对2型糖尿病的作用[J].临床军医杂志,2009,37(4):716-719.
[12]Drzewoski J,Zurawska-Klis M.Effect of gliclazide modified release on adiponectin,interleukin-6,and tumor necrosis factor-αplasma levels in individuals with type 2diabetes mellitus[J].Current Medical Research and Opinion,2006,22(10):1921-1926.
[13]高俊杰,尹智炜,边东,等.肾脏局部RAS与糖尿病肾病关系的研究进展[J].河北医药,2009,31(3):336-338.
[14]张岩,邓红文.肾素-血管紧张素系统在骨生物学活性中的研究进展[J].中国骨质疏松杂志,2010,16(1):64-66.
[15]张露,刘必成.血管紧张素Ⅱ与肾脏血管结构重塑[J].国外医学:泌尿系统分册,2004,24(6):841-844.
[16]黄俊彦.厄贝沙坦对糖尿病大鼠肾脏GLUT-1及TGFβ1表达的影响及意义[D].青岛大学,2007.
[17]张勇军,孙永苹,刘冬.雷公藤多苷和厄贝沙坦治疗2型糖尿病的效果观察[J].中国医药导报,2012,9(34):73-74.
[18]罗蕾,刘红.灯盏花素对2型糖尿病大鼠肾脏肥大的抑制作用与机制研究[J].时珍国医国药,2009,20(1):86-87.
[19]李宏亮,余叶蓉.蛋白激酶C激活与糖尿病血管并发症研究的新进展[J].医学研究生学报,2003,16(9):708-709,713.

