抗核抗体检测策略研究
谭太昌,吴雅娟,腾飞鹏
(1.四川省医学科学院·四川省人民医院,成都 610072;2.山西医科大学,太原 030001)
血清抗核抗体(ANA)是临床中应用最多的自身免疫标志物,它的检测对自身免疫性疾病(AID)的诊断和鉴别诊断具有重要意义。目前,除了用“金标准”间接免疫荧光法(IIF)检测 ANA 外[1],国内外的许多实验室还采用了一些检测特异性自身抗体的方法,如酶联免疫吸附试验(ELISA)、免疫印迹法、自身抗原微点阵法[2]等。但是由于各个医院实验室的规模和患者流量不同,许多实验室常先进行ANA检测,只有ANA结果阳性时再进行特异性抗核抗体谱(ANAs)的检测[3,4],也有实验室由于设备和技术原因只开展了ANAs检测而没有进行IIFANA检测。在实际工作中,如果将患者标本同时进行ANA和ANAs检测,常发现二者结果并不完全相符。本研究将724例临床住院患者血清标本同时采用IIF检测ANA和LIA检测15种ANAs的结果进行比较分析,同时结合临床诊断探讨两种方法的优缺点,以期能找到一种在临床上检测ANA的最佳方案。
1 材料与方法
1.1 研究对象
2012年10月~2013年3月就诊于四川省人民医院申请自身抗体谱检测的临床住院患者标本共计724例,其中男236例,年龄12~86岁;女488例,年龄14~88岁。所有标本同时采用IIF检测ANA和LIA检测15种ANAs。AID患者的诊断均符合国际相关学会的诊疗指南。送检标本均为待测患者清晨空腹静脉血,离心10min(3 000r/min)后分离血清在24h内检测。
1.2 研究方法
1.2.1 IIF检测ANA 采用德国欧蒙公司提供的ANA(Hep-2/猴肝马赛克)IIF试剂盒,以人喉癌上皮细胞(Hep-2)和猴肝生物载片按标准程序检测患者血清ANA。将血清1∶101稀释后与生物载片反应30min,在PBS缓冲液中浸泡洗涤5min,加入FITC标记的二抗(抗人免疫球蛋白IgG)避光室温温育30min,后在PBS缓冲液中浸泡洗涤5min,加甘油封片,由专业人员在荧光显微镜下观察荧光模型,判读结果,以抗体滴度≥1∶100为阳性。如有混合核型则以主要核型为分析核型。
1.2.2 LIA检测ANAs 采用德国欧蒙公司提供的LIA检测试剂盒,检测15种ANAs:抗nRNP、抗Sm、抗SS-A、抗 Ro-52、抗SS-B、抗Scl-70、抗 PMScl、抗Jo-1、抗CENP-B、抗PCNA、抗dsDNA、抗核小体、抗组蛋白、抗核糖体P蛋白和抗线粒体抗体-M2亚型。第1次血清温育是将1∶100稀释后的患者血清1.5mL加入放有膜条的温育槽中,在摇床上室温温育30min,用1.5mL清洗缓冲液洗3次(5min/次);第2次酶结合物温育是在槽中加入1.5mL已稀释的酶结合物(碱性磷酸酶标记的抗人IgG)于摇床上室温温育30min,用1.5mL清洗缓冲液洗3次(5min/次);第3次底物温育则是加入1.5mL底物液后室温温育10min,用蒸馏水洗3次(1min/次)终止反应。最后用台式扫描仪(CANON)扫描膜条,用EUROLineScan软件判读结果:着色强度灰度值≤5为阴性;6~10为可疑;≥11为阳性。如检测结果出现多个靶抗原阳性,则以最强阳性结果纳入分析。
1.3 统计学方法
采用SPSS19.0统计软件进行统计学分析。率的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 AID组及非AID组中IIF、LIA检测结果分析
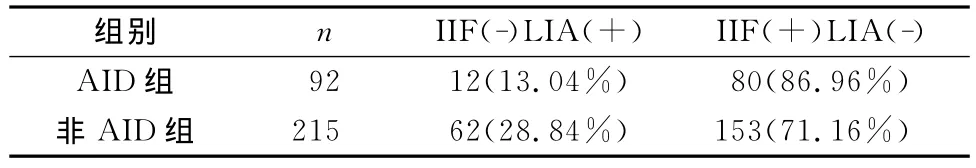
表1 IIF与LIA结果不一致分析

表2 IIF与LIA结果一致分析
由表1可看出AID组中IIF阳性占到86.96%,非AID组中IIF阳性也占有很大比例(71.16%),差异有统计学意义。但临床实践中要通过IIF来区分AID及非AID是不可能的。表2可看出同时用IIF与LIA检测ANA,结果均是阳性时诊断为AID的占到79.41%,同是阴性诊断为非AID的有94.33%。IIF与LIA相结合就可以区分AID及非AID。
2.2 IIF、LIA检测结果与临床诊断相结合分析

表3 AID组

表4 非AID组
从表3中可以看出,IIF与LIA检测结果不一致时诊断为RA的比率较高,其中IIF(+)LIA(-)的诊断中RA占76.25%。而IIF与LIA结果一致时,诊断最多的是SLE。从表4中可看出之所以非AID患者也可检测出ANA可能与自身条件有关,以患有2型糖尿病和(或)高血压的患者居多。
3 讨论
ANA是一组将自身真核细胞的各种细胞核成分作为靶抗原的自身抗体的总称,主要存在于血清中[5],是临床诊断AID重要的自身抗体。目前常用IIF作为总的ANA筛选试验。荧光显微镜下标本的检测不仅可使临床医生了解血清中是否存在ANA,并可获知不同抗体所呈现的荧光模型。阳性荧光模型可提示参与反应的细胞核抗原定位,并有助于鉴别诊断。但要明确自身抗体的靶抗原就必须作进一步的ANAs检测,免疫印迹法[6]可能是目前对ANAs检测最可靠的实验室研究方法。它操作易于标准化、简单快捷,结果判读方便,一次可检测AID相关的多种特异性自身抗体,且有较高的敏感性和特异性。但在临床检测过程中,我们发现IIF检测ANA与LIA检测ANAs的结果不完全相符。本研究对724例检测结果结合临床诊断进行分析探讨。
表1、表2的研究结果表明262例AID患者组中,IIF(+)有215例(82.06%),LIA(+)有147例(56.11%);462例非 AID患者组中,IIF(+)有167例(36.15%),LIA(+)有76例(16.45%)。说明IIF作为临床诊断AID最常用的筛选方法,敏感性较高;而LIA检测ANAs有较好的特异性。但二者各有其局限性:1)IIF由于采用的Hep-2细胞抗原底物存在分布不均[7]、含量过低以及不同固定方法对特定抗原的破坏等;其荧光染色不稳定、滴度判断需系列稀释、荧光类型有赖于肉眼判断、少见的特殊类型需专业技术人员鉴定[8],均可导致采用IIF出现漏检或误检,且IIF对诊断没有特异性,健康人群中发现用IIF法ANA阳性检出率可达5%。2)LIA因为检测膜条上包被的抗原有限,我们使用的试剂膜条上只有15种特异性靶抗原,而已知的与疾病相关的自身抗体已有几十种甚至上百种(比如抗核仁型的抗体有抗原纤维蛋白、U3-RNP、NOR90、B23、RNAPⅠ~Ⅲ、Th/To、PM-Scl等,而膜条上只包被了PM-Scl和ScL-70),且膜条上一般也没有针对胞浆纤维的靶抗原,可见LIA只能检测有限的抗体,漏检率也很高。
由表3可看出IIF与LIA结果不一致的92例AID患者中有65例是RA患者,占到70.65%,其中51例荧光模型为核颗粒型,3例是核颗粒、核均质型。从RA患者的ANA荧光模式分布可以推测:RA患者血清中总的抗核抗体针对细胞核成分的比例比针对细胞质成分的比例高;3例RA中检出抗SS-A、抗SS-B等特异性自身抗体;与RA相关的特异性自身抗体也是作为其诊断标志物的有类风湿因子(RF)、抗角蛋白抗体(AKA)、抗环瓜氨酸肽抗体(CCP)等[9]。但RF多采用免疫比浊法检测,AKA、CCP也没有被包被于膜条上,所以印迹法检测RA漏检率较高。在IIF与LIA检测结果同为阳性的135例AID患者中54例为SLE,SLE具有自身抗体多样性[10],在疾病初期通常为抗一种或少量自身抗原的自身抗体,之后可发展为对很多其他自身抗原或其抗原位点的自身抗体。所以在研究统计过程中会发现,诊断为SLE的荧光模型和ANAs都是多种多样的,ANAs至少会有一种。
从表4中可看出非AID患者中有很多都可检测出ANA,也有研究表明,每20个健康人中就可检出1例ANA阳性[6]。当然这并不是因为IIF和LIA检测出现假阳性,很多AID是以临床症状出现前数月或数年即呈现自身抗体为特征的慢性疾病,也就是说自身抗体也可以预示疾病的发生、进展和严重程度。例如,SLE中抗APL、Ro和La抗体的出现可比临床诊断提前约3.4年。这些抗体相对抗dsDNA抗体(早于诊断约2.2年出现)和抗Sm及抗核糖核蛋白抗体(早于诊断约1.2年出现)在病程中更早出现[11],这个概念的重要意义在于预测疾病的可能性。研究发现有很多危险因素形成了“自身免疫易感”人群谱,包括性别、基因、血清学等,这些危险因素与外部环境(如感染、化学因素等)相互作用可能使“潜在自身免疫”变为真正的AID[12]。了解这种潜在性与临床疾病之间存在时间差异可有助于进行生活方式和药物治疗干预,以预防出现临床症状。为了更有效、经济地进行AID筛查,有作者建议联合检测HLA表型和自身抗体[13]。
综上所述,因为绝大多数自身抗体针对的靶抗原为自身靶细胞的核成分或细胞膜、细胞浆内物质,所以以 Hep-2细胞作为抗原基质的IIF是筛选ANA的最理想实验。而LIA具有疾病特异性和较高的敏感性,临床应用时(尤其是与临床表现结合高度怀疑AID时)需同时进行IIF筛查ANA和LIA检测ANAs。但各个实验室应根据本地区不同的自身免疫性疾病谱选择ANA IIF加上不同种类的特异性靶抗原组合来进行自身抗体检测。
[1]Peterson LK,Wells D,Shaw L,etal.Novel method for quantitative ANA measurement using near-infrared imaging[J].Journal of Immunological Methods,2009,349(1):1-8.
[2]Fathman CG,Soares L,Chan SM,etal.An array of possibilities for the study of autoimmunity[J].Nature,2005,435(7042):605-611.
[3]Hoffman IE,Peene I,Veys EM,etal.Detection of specific antinuclear reactivities in patients with negative anti-nuclear antibody immunofluorescence screening tests[J].Clinical Chemistry,2002,48(12):2171-2176.
[4]Hahm D,Anderer U.Establishment of HEp-2cell preparation for automated analysis of ANA fluorescence pattern[J].Cytometry Part A,2006,69(3):178-181.
[5]王兰兰,吴健民.临床免疫学与检验.第4版[M].北京:人民卫生出版社,2010:330-332.
[6]Yehuda Shoenfeld MD,M.Eric Gershwin MD,Pier Luigi Meroni MD,etal.Autoantibodies.Second Edition[J].Netherlands,2007:29-32.
[7]Bossuyt X,Luyckx A.Antibodies to extractable nuclear antigens in antinuclear antibody negative samples[J].Clinical Chemistry,2005,51(12):2426-2427.
[8]Muro Y.Antinuclear antibodies[J].Autoimmunity,2005,38(1):3-9.
[9]van Boekel MA,Vossenaar ER,Van den Hoogen FH,etal.Autoantibody systems in rheumatoid arthritis:specificity,sensitivity and diagnostic value[J].Arthritis Res,2002,4(2):87-93.
[10]Graham KL,Robinson WH,Steinman L,etal.Highthroughput methods formeasuring antoantibodies in systemic lupus erythematosus and other autoimmune diseases[J].Autoimmunity,2004,37(4):269-272.
[11]Arbuckle MR,McClain MT,Rubertone MV,etal.Development of autoantibodies before the clinical onset of systemic lupus erythematosus[J].New England Journal of Medicine,2003,349(16):1526-1533.
[12]Harel M, Shoenfeld Y.Predicting and preventing autoimmunity,myth or reality?[J].Annals of the New York Academy of Sciences,2006,1069(1):322-345.
[13]Shepshelovich D,Shoenfeld Y.Prediction and prevention of autoimmune diseases:additional aspects of the mosaic of autoimmunity[J].Lupus,2006,15(3):183-190.

