高盐诱导幽门螺杆菌致蒙古沙土鼠胃部病变的研究
柳云恩,施琳,张玉彪,徐婷婷,张继存,侯明晓
(沈阳军区总医院全军重症战创伤实验室·辽宁省重症创伤器官保护研究重点实验室,沈阳 110840)
幽门螺杆菌(H.pylori)在全球人群中的感染率高达50%,它与慢性胃炎、消化性溃疡及胃癌的发生密切相关[1]。H.pylori感染的大部分宿主人无任何症状,少数发展为胃炎及胃癌。蒙古沙土鼠(MGs)腺胃结构和功能与人类极其相似,极少患自发性胃炎。H.pylori不仅能长期在MGs胃黏膜定植,且胃黏膜发生的病理变化与人类相似。溃疡分离株TN2GF4感染MGs,可出现活动性胃炎、溃疡和高分化腺癌[2]。溃疡分离株7.13感染MGs 14w后,33%MGs发生高分化腺癌,18w后,50%MGs发生高分化腺癌[3],其子代菌株B128仅能导致MGs发生轻度溃疡和胰腺炎[4]。
高盐饮食及遗传因素是胃癌发生的危险因素,长期高盐饮食的MGs易发生萎缩性胃炎及肠化生[5],高盐造成胃黏膜短暂性损伤,破坏黏膜表面黏液屏障,利于H.pylori在胃内定植[6]。用含不同盐浓度培养基培养的H.pylori26695,cagA蛋白表达随盐浓度升高而增加[7],而经高盐诱导后G27H.pylori菌株逐渐停止繁殖,最终死亡[8]。结果提示H.pylori对高盐环境的耐受能力存在菌株的异质性,某些来源的H.pylori菌株对高盐环境更敏感。目前关于高盐诱导H.pylori菌株致病能力的研究仍停留在体外实验阶段,高盐环境诱导不同来源H.pylori在体内的致病能力尚未见报道。本研究探讨高盐环境培养的H.pylori菌株对MGs胃黏膜的损伤,旨在阐明在体内环境下高盐对H.pylori致病变作用的影响。
1 材料和方法
1.1 实验动物
90只雄性SPF级MGs,6周龄,购自浙江省医学科学院实验动物中心。动物饲养环境:室温23±2℃,相对湿度40%~60%,12h明暗循环,噪音<60dB,自由摄食饮水。试验过程完全接受本中心动物管理委员会(IACUC)监督。
1.2 H.pylori菌株培养及鉴定
胃癌分离H.pylori株和高盐诱导胃癌H.pylori株。将细菌复苏,接种于含7%脱纤维羊血,0.4%IsoVitaleXEnric-hment(USA,Becton Dickinson),0.08%两性霉素 B(USA,sigma),0.2%万古霉素(USA,lilly)和0.5%磺胺增效剂(USA,sigma)的脑心浸液琼脂培养基(USA,B-ecton Dickinson),在37℃,含5%O2、10%CO2、85%N2,相对湿度95%的三气培养箱中培养。幽门螺杆菌鉴定采用典型形态学观察,尿素酶实验,Giemsa染色及PCR技术。
1.3 H.pylori接种
MGs观察及适应环境7d后,将90只MGs随机分成对照组(n=30只)、H.pylori组(n=30只)和高盐诱导H.pylori组(n=30只)。所有MGs在接种前16h禁食、禁水,实验组分别经灌胃针注入H.pylori或高盐诱导H.pylori(1×108CFU/mL)1mL,对照组仅灌喂生理盐水,均1次/d,连续3d,连续观察73w。
1.4 病理学检查
接种H.pylori后第13周及26周,每组分别处死5只MGs,第73周处死所有存活MGs。处死前MGs禁食禁水12h,乙醚吸入麻醉,对MGs胃黏膜进行仔细的大体观察。从前胃、腺胃至十二指肠纵向切成3~5mm宽条块,石蜡包埋制作病理组织切片。
1.5 统计学分析
采用SPSS 18.0统计学软件进行χ2检测,比较细菌定植密度及病变发生率等计数资料的组间差异,所有统计检验均为双侧概率检验,P<0.05为差异有统计学意义。
2 实验结果
2.1 H.pylori在MGs胃黏膜定植能力
从13~73w,对照组所有MGs胃黏膜均未发现H.pylori感染;H.pylori组及高盐诱导H.pylori组MGs胃黏膜均发现细菌定植,而高盐诱导H.pylori组细菌定植密度明显降低(P<0.05)(见图1)。
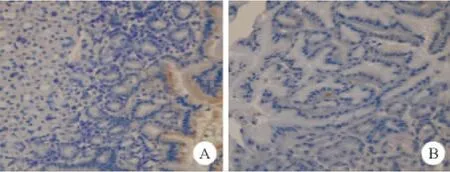
图1 免疫组化染色结果
2.2 H.pylori致MGs胃黏膜大体改变
从13~73w,对照组MGs胃黏膜未发现病变。13~26w,高盐诱导H.pylori组胃黏膜糜烂/溃疡发生率显著高于H.pylori组(P<0.05),且黏膜糜烂/溃疡程度较H.pylori组重(见图2)。
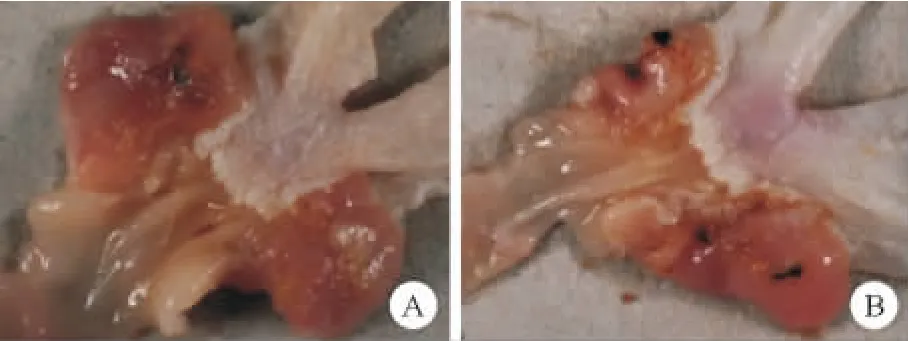
图2 MGs胃黏膜糜烂/溃疡改变
2.3 H.pylori致MGs胃黏膜病变差异
对照组MGs胃黏膜未见明显异常。高盐诱导H.pylori组MGs胃黏膜发生慢性炎症、变性、腺体萎缩及肠化生的发病率均明显低于H.pylori组(P<0.05);糜烂/溃疡及小凹上皮增生发生率明显高于H.pylori组(P<0.05)。
3 讨论
H.pylori通常聚集在表面黏液层内或黏附在表面上皮上,极少寄居在腺体黏液内,当胃黏膜发生慢性炎症或弥漫性糜烂/溃疡时,易导致黏膜上H.pylori定植密度明显下降[9]。高盐环境是否影响H.pylori的定植能力尚不明确。本研究发现,经高盐诱导H.pylori在MGs胃黏膜的定植密度明显降低,体外采用高盐诱导H.pylori与GES-1细胞共培养,发现高盐诱导H.pylori黏附细胞的能力明显下降[10]。有研究发现高盐饮食能导致小鼠胃黏膜损伤,从而有利于H.pylori在胃黏膜定植[11]。而Loh等[7]则发现高盐环境易造成H.pylori活力降低及形状改变,不利于在胃黏膜定植,与本实验结果类似。
高盐诱导H.pylori组导致MGs胃黏膜病变与H.pylori组明显不同,高盐诱导H.pylori组更容易导致黏膜小凹上皮增生和糜烂/溃疡等病变,而H.pylori组易诱发黏膜炎症及萎缩性病变。Fox等[6]发现0.25%盐导致动物胃体及胃窦黏膜小凹上皮伸长,壁细胞多灶性减少,黏膜或黏膜下层炎症反应不明显。高盐饮食和H.pylori感染以协同作用的方式加重MGs黏膜损伤,黏膜损伤势必启动自身的修复程序,导致胃黏膜反应性增生。然而,有研究[12]认为胃黏膜增殖程度与慢性炎症刺激相关,而与H.pylori感染无关。有研究认为H.pylori生长的最适盐浓度是0.5%~1%,2%盐浓度抑制其生长[13]。前期体外实验研究发现高盐诱导胃癌来源的H.pylori,CagA及UreB毒性蛋白仍保持较高水平。本研究发现高盐诱导H.pylori的致病性与常规培养的H.pylori存在显著差异,可能与高盐环境导致H.pylori某些特异性毒性蛋白表达改变有关。
总之,高盐诱导H.pylori在体内的致病能力发生改变,高盐诱导后易诱发胃黏膜增殖、糜烂溃疡和肥大细胞瘤发生,高盐诱导H.pylori菌株致病能力改变的具体机制,有待进一步深入研究。
[1]Correa P,Piazuelo MB.Evolutionary history of the Helicobacter pylori genome:implications for gastric carcinogenesis[J].Gut and Liver,2012,6(1):21-28.
[2]Elfvin A,Edebo A,Bölin I,etal.Quantitative measurement of nitric oxide and hydrogen peroxide in Helicobacter pyloriinfected Mongolian gerbils in vivo[J].Scandinavian Journal of Gastroenterology,2007,42(10):1175-1181.
[3]Romero-Gallo J,Harris EJ,Krishna U,etal.Effect of Helicobacter pylori eradication on gastric carcinogenesis[J].Laboratory Investigation,2008,88(3):328-336.
[4]Farnbacher M,Jahns T,Willrodt D,etal.Sequencing,annotation,and comparative genome analysis of the gerbiladapted Helicobacter pylori strain B8[J].BMC Genomics,2010,11(335):1-23.
[5]Cover T,Peek RM.Diet,microbial virulence,and Helicobacter pylori-induced gastric cancer[J].Gut Microbes,2013,4(6):30-29.
[6]Fox JG,Dangler CA,Taylor NS,etal.High-salt diet induces gastric epithelial hyperplasia and parietal cell loss,and enhances Helicobacter pylori colonization in C57BL/6mice[J].Cancer Research,1999,59(19):4823-4828.
[7]Loh JT,Torres VJ,Cover TL.Regulation of Helicobacter pylori cagA expression in response to salt[J].Cancer Research,2007,67(10):4709-4715.
[8]Gancz H,Jones KR,Merrell DS.Sodium chloride affects Helicobacter pylori growth and gene expression[J].Journal of Bacteriology,2008,190(11):4100-4105.
[9]Xu Y,Jing JJ,Gong YH,etal.Changes in Biological and Virulent Characteristics of Helicobacter pylori Exposed to High Salt[J].Asian Pacific Journal of Cancer Prevention,2011,12:2637-2641.
[10]Toyoda T,Tsukamoto T,Yamamoto M,etal.Gene expression analysis of a Helicobacter pylori-infected and highsalt diet-treated mouse gastric tumor model:identification of CD177as a novel prognostic factor in patients with gastric cancer[J].BMC Gastroenterology,2013,13(1):122.
[11]Tsukamoto T,Toyoda T,Mizoshita T,etal.Helicobacter pylori infection and gastric carcinogenesis in rodent models[C].Seminars in immunopathology.Springer-Verlag,2013,35(2):177-190.
[12]Rogers AB,Taylor NS,Whary MT,etal.Helicobacter pylori but not high salt induces gastric intraepithelial neoplasia in B6129mice [J].Cancer Research,2005,65 (23):10709-10715.
[13]Gancz H,Merrell DS.The Helicobacter pylori Ferric Uptake Regulator(Fur)is essential for growth under sodium chloride stress[J].The Journal of Microbiology,2011,49(2):294-298.

