丙戊酸钠对K562细胞的增殖抑制作用
薛 倩,张志华,赵 蕾,郝长来△
(1.承德医学院,河北承德 067000;2.承德医学院附属医院)
近年来,国内外大量文献证明丙戊酸钠(VPA)具有抑制组蛋白去乙酰化酶(HDAC)的作用,能调节细胞周期,诱导多种实体瘤和急性白血病细胞分化和凋亡[1-3]。肿瘤的发生被认为是细胞凋亡与细胞增殖平衡失调的结果,目前发现多种肿瘤与细胞凋亡规律异常有关,癌基因和抑癌基因的突变、失活、失调包含于发病机制之中。本研究以t(9;22)携带有特征性融合基因BCR/ABL慢性髓系白血病(CML)细胞株K562细胞为靶细胞,探讨VPA对慢性髓系白血病细胞的增殖抑制作用。
1 材料与方法
1.1 材料 K562细胞株,中国医学科学院血液学研究所王建祥教授惠赠。VPA、RPMI 1640、噻唑蓝(MTT),美国Sigma公司;胎牛血清,上海生工公司;Bcl-2、Bax、β-actin一抗和二抗,美国Santa公司。
1.2 方法
1.2.1 细胞培养:K562细胞置于含有10%胎牛血清的RPMI 1640培养液中,加入青霉素(100U/m1)和链霉素(100U/ml),在37℃、5% CO2饱和湿度培养箱中培养。
1.2.2 细胞增殖的MTT法检测:取对数生长期K562细胞,接种于96孔板内,调整密度为2×105/ml,每孔90μl,实验组细胞分别加入不同浓度的VPA(0.5、1、2、3、4mmol/L),10μl/孔,对照组细胞不加药物,另设空白组(只加培养基,不加细胞和药物),每组均设3个复孔。96孔板置于37℃、5% CO2培养箱培养72h后,加入5mg/ml的MTT溶液20μl/孔,继续培养4h,然后加入三联裂解液[10% SDS+5% 异丁醇+1% HCL(10mol/L),100μl/ 孔],37℃放置过夜后,用酶标仪于波长570nm处读取吸光度(OD)值,根据OD值计算细胞增殖抑制率:细胞增殖抑制率(%)=[对照孔OD值-实验孔OD值]/[对照孔OD值-空白孔OD值]×100%。并计算细胞增殖抑制率为50%时的药物浓度(IC50)。
1.2.3 Western Blot法检测K562细胞Bax和Bcl-2蛋白的表达:取对数生长期的K562细胞,调整细胞密度为5×105/ml,分为对照组和VPA 3mmol/L处理组。培养72h后收集细胞,RIRA裂解液(50mmol/L Tris-Cl pH8.0,1% NP-40,150mmol/L NaCl,0.5% 去 氧 胆 酸钠,0.1% SDS,100mmol/L PMSF)裂解细胞,提取总蛋白质,BCA法定量蛋白浓度。SDS-PAGE电泳分离,蛋白样品上样量每孔50μg,然后转至PVDF膜上,5%脱脂奶粉室温封闭2h,鼠抗人Bax、鼠抗人Bcl-2抗体(1:200稀释)4℃过夜,洗膜后加入辣根过氧化物酶(HRP)偶联兔抗鼠二抗,ECL显影,曝光。采用Quantity Qne-v 4.6.2软件对显影条带进行分析,以目的条带的灰度值与β-actin(1:1000)条带的比值作为目的蛋白的表达水平。
1.3 统计分析 采用SPSS 17.0统计软件行方差分析和两样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 VPA对K562细胞增殖的抑制作用 不同浓度VPA处理K562 细胞后,细胞增殖明显受抑,VPA 0.5、l、2、3、4mmol/L处理组的细胞增殖抑制率明显高于对照组(P<0.01);并且,VPA对K562细胞的增殖抑制作用具有浓度依赖性,VPA各浓度K562细胞增殖抑制率比较差异具有统计学意义(P<0.01)。见表1。VPA处理K562细胞72h的IC50=(2.34±0.14)mmol/L。
表1 MTT法检测K562细胞的增殖抑制率(±s)

表1 MTT法检测K562细胞的增殖抑制率(±s)
与对照组比较:*P<0.01;VPA不同浓度间比较:P<0.01
组别 OD570 抑制率(%)空白组 0.314±0.012 ---对照组 1.112±0.027 0 VPA 0.5mmol/L 0.959±0.013 19.19±3.39*VPA 1.0mmol/L 0.873±0.010 29.98±2.44*VPA 2.0mmol/L 0.765±0.008 44.78±2.75*VPA 3.0mmol/L 0.614±0.008 62.35±1.77*VPA 4.0mmol/L 0.565±0.012 68.63±2.26*
2.2 VPA处理K562细胞后Bax和Bcl-2蛋白表达的变化 与对照组比较,3mmol/L VPA处理K562细胞后,Bax蛋白的表达明显升高,Bcl-2蛋白的表达明显降低(P<0.01)。见表2。
表2 K562细胞Bax和Bcl-2蛋白的表达(±s)
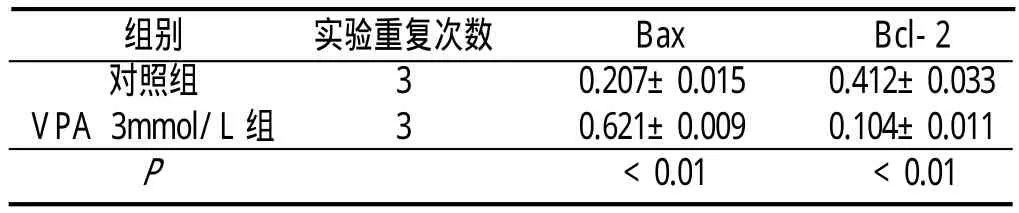
表2 K562细胞Bax和Bcl-2蛋白的表达(±s)
组别 实验重复次数 Bax Bcl-2对照组 3 0.207±0.015 0.412±0.033 VPA 3mmol/L组 3 0.621±0.009 0.104±0.011 P <0.01 <0.01
3 讨论
研究证实,保守位点的乙酰化修饰可以影响DNA与转录调节复合物的结合,调控DNA的复制和修复、基因表达、染色质组装和细胞有丝分裂[4]。组蛋白乙酰化酶(HATs)和组蛋白去乙酰化酶(HDACs)可调控这种修饰作用,因此HATs/HDACs的失衡可使基因表达紊乱,从而导致肿瘤的发生。HDAC抑制剂VPA及类似物可以抑制Ⅰ类和Ⅱ类HDAC(不包括HDAC6和HDAC10)中多种HDAC的活性,使组蛋白H3和H4氨基末端超乙酰化,明显调节细胞增殖和凋亡相关基因的表达,从而起到抗白血病的作用[5-6]。
K562细胞株是研究慢性髓系白血病的理想细胞株,来自慢粒急变患者,携带有t(9;22)易位产生的特征性融合基因BCR/ABL,编码的P210融合蛋白具有很强的酪氨酸激酶活性,可影响细胞内的信号传导和黏附分子的功能,干扰细胞凋亡,在慢性髓系白血病的发病机制中发挥关键性的作用。虽然临床新药伊马替尼针对BCR/ABL基因产物P210蛋白取得了很好的药效,但在加速期和急变期患者仍然观察到了原发性和继发性耐药现象,因此临床上需要开发新一代作用于P210融合蛋白的靶向药物或其它不同机制的抗肿瘤药物[7]。细胞凋亡的信号通路包括线粒体参与的内源性路径、死亡受体介导的外源性路径或内质网信号路径,最终汇集到caspase激活的路径。细胞凋亡的调控涉及许多基因,包括一些与细胞增殖有关的原癌基因和抑癌基因,其中研究较多的有ICE、Apaf-1、Bcl-2、Fas/APO-1、c-myc、p53、ATM 等。Bcl-2蛋白家族是凋亡的主要调节者,可分为两类,一类是抗凋亡基因,如:Bcl-2、Bcl-xl、Bcl-w、Mcl-1,另一类是促凋亡基因,如:Bax、Bak、Bad、Bid、Bim 等。Perkins等的实验研究证实,半胱氨酸蛋白酶(caspases)原通过与凋亡诱导蛋白Apaf-1的NH2-末端区域结合而激活,抗凋亡蛋白可直接与Apaf-1结合,抑制它同caspases原的交联,从而抑制caspases-9的激活[8]。Bax可把Apaf-1从抗凋亡的结合中释放出来,引起线粒体膜电位下降,释放细胞色素C,激活caspases发生自身催化的化学反应,从而导致细胞凋亡。本研究应用VPA作用于慢性髓系白血病细胞株K562细胞,MTT法检测发现K562细胞的增殖明显受到抑制,同时发现促凋亡蛋白Bax的表达升高、抗凋亡蛋白Bcl-2的表达降低。表明VPA可通过上调Bax的表达、下调Bcl-2的表达,诱导K562细胞凋亡,关于VPA诱导K562细胞凋亡是否通过caspase非依赖的其它凋亡信号途径,尚待进一步的研究。
[1]Gotflicher M, Minucci S, Zhu P, et a1. Valproic acid defines a novel class of HDAC inhibitors inducing differentiation of transformed cells[J]. EMBO J, 2001, 20(24): 6969-6978.
[2]Takai N, Desmond JC, Kumagai T, et a1. Histone deacetylase inhibitors have a profound antigrowth activity in endometrial cancer cells[J].Clin Cancer Res,2004,10(3):1141-1149.
[3]Deubzer H, Busche B, Ronndahl G, et a1. Novel valproic acid derivatives with potent differentiation-inducing activity in myeloid leukemia cells[J].Leuk Res,2006,30(9):1167- 1175.
[4]Huang C, Sloan EA, Boerkoel CF. Chromatin remodeling and human disease[J].Curr Opin Genet Dev, 2003, 13(3): 246-252.
[5]Gurvich N,Tsygankova OM,Meinkoth JI,et al.Histone deacetylase is a target of valproic acid-mediated cellular differentiation[J].Cancer Res,2004, 64(3):1079-1086.
[6]Thelen P, Schweyr S, Hemmerlein B, et al. Expressional changes after histone deacetylase inhibition by valproic acid in LNCaP human prostate cancer cells[J].Int J Oncol,2004, 24(1):25-31.
[7]Hunter T. Treatment for chronic myelogenous leukemia:the long road to imatinib[J].J Clin Invest, 2007,117(8):2036-2043.
[8]Perkins C,Kim CN,Fang G, et al.Arsenic induces apoptosis of multidrug-resistant human myeloid leukemia cells that express Bcr-Abl or over express MDR,MRP,Bcl-2,or Bcl-xL[J].Blood,2000,95(3):1014-1022.
[9]Adams JM,Cory S.The Bcl-2 protein family:arbiters of cell survival[J].Science,1998,281 (5381):1322-1326
[10]Joensuu H, Pylkkanen L, Toikkanen S. Bcl-2 protein expression and long-term survival in breast cancer[J]. Am J Pathol, 1994,145(5): 1191-1198.

