320排CT灌注成像在肝癌诊断中的临床应用
邱国钦,刘昌华,陈玉强,吴贵华
(本文编辑:张仲书; 英文编辑:王建东)
320 排 CT灌注成像(CT perfusion imaging,CTPI)是评价原发性肝癌(primary liver cancer,PLC)血流动力学的最佳影像学检查[1],既能提供肿瘤的形态学信息,又能准确检测血流灌注特点及血管特性,可为PLC的临床诊断、评估预后及指导介入治疗等方面提供可靠的依据,已得到临床的广泛应用并成为研究热点,但目前多以螺旋CT研究为主[2-3]。为此本文应用具有快速、清晰及低辐射优势的非螺旋单次扫描320排CT[4]对PLC患者行全肝CTPI,旨在探讨其对PLC的诊断及评估价值。
1 资料与方法
1.1 一般资料 2010年8月-2012年8月我院收治的103例行介入治疗的中晚期PLC初诊患者,均经临床、CT、AFP或病理检查等确诊。其中男64例、女39例;年龄19~78岁,平均年龄52.6岁;肝功能分级,Child-Pugh A级75例、B级28例。所有患者均在介入治疗前1~3天行320排CT肝脏CTPI。
1.2 检查方法 采用东芝Aquilion One 320排CT机,以动态容积模式,320 mm×0.5 mm探测器准直Range160 mm、转速 0.5 s/rot、管电流 75 ~100 mA、管电压100 kV、FOV-L进行扫描。先行上腹部平扫,确定肝脏范围后再行全肝灌注扫描。高压注射器经静脉团注优维显(370 mgI/ml)50~60 ml,速率5.0 ml/s,延迟8 s采集数据,同时包含目标肿瘤,肝实质、脾脏、主动脉及门静脉的层面,以肿瘤面积尽量大的层面作为扫描中心层面,同层动态扫描,扫描时间共60 s。
1.3 数据处理 扫描数据同步传至随机的Displaying Monitor进行后处理。确定阈值为-120~300 Hu,标识腹主动脉为输入动脉、门静脉为输入静脉。分别在主动脉、门静脉、肝脏及脾脏选择圆形感兴趣区(region of interest,ROI),由肝脏灌注软件包自动生成时间-密度曲线(time-density curve,TDC)。ROI的选取范围应尽量大,正常肝组织取远离肿瘤边缘2 cm以上的组织,瘤旁肝组织取肿瘤外<1 cm的组织,肿瘤组织取肿瘤最大层面且强化最明显的部位,避开大血管、坏死区及胆管,获得系统生成各ROI的四维灌注彩图及其参数。主要灌注参数为肝血流量(blood flow,BF)、肝血容量(blood volume,BV)、平均通过时间(mean transit time,MTT)、毛细血管表面通透性(probability of surface area product,PS)、肝动脉灌注指数(hepatic perfusion index,HPI)、肝动脉灌流量(hepatic arterial persusion,HAP)、门静脉灌流量(portal vein perfusion,PVP)。
1.4 统计学处理 应用SPSS 16.0软件包,计量资料以均数±标准差(±s)表示,组间比较采用配对t检验,P<0.05为差异有统计学意义。
2 结果
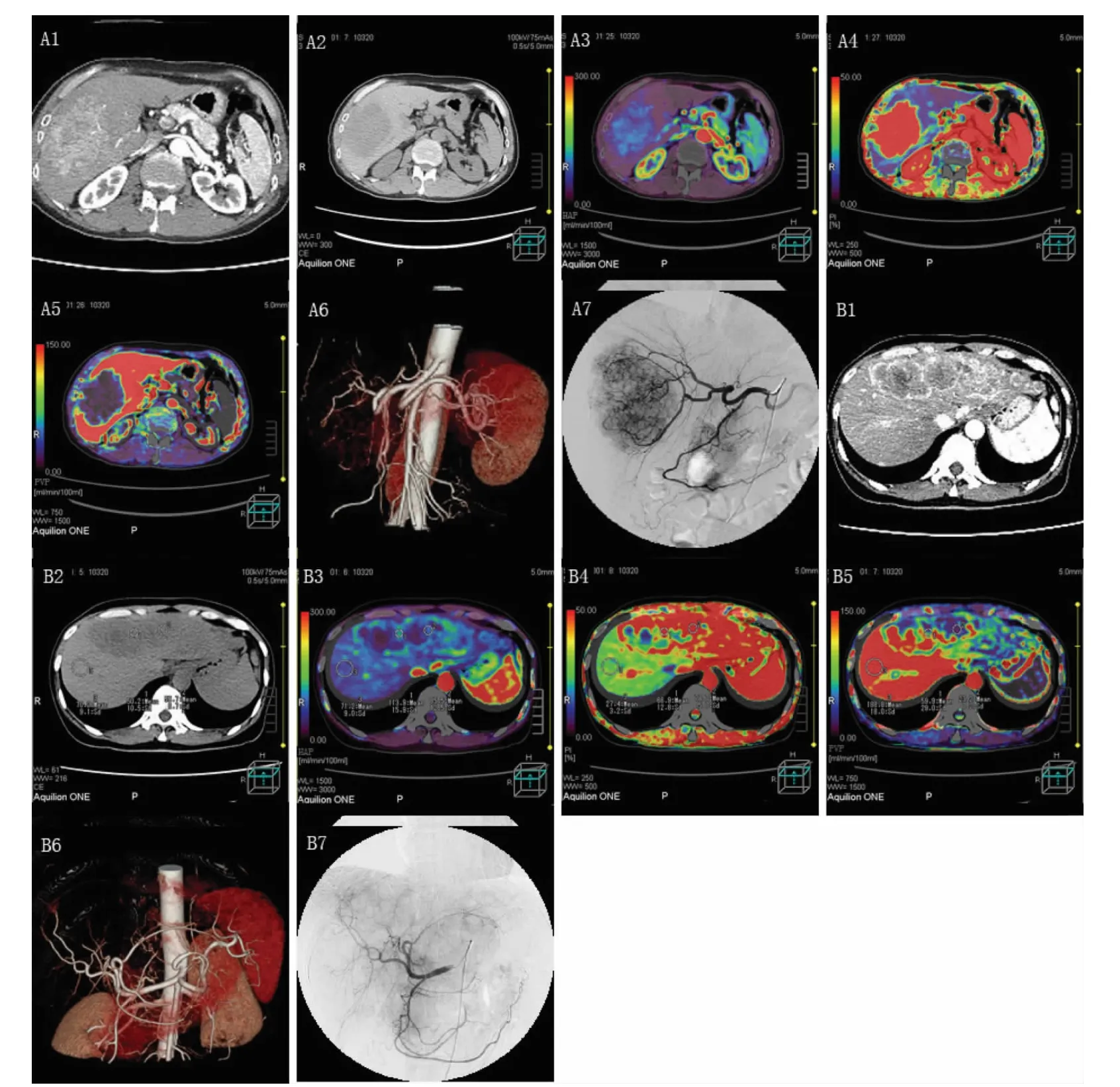
图1 PLC的CTPI与DSA表现
2.1 常规CT的表现 103例中,PLC单发灶36例、多发灶67例;其中巨块型29例、结节型68例、弥漫型6例;肿瘤最大径3.2~19.0 cm,平均8.2 cm;肿瘤均匀强化者34例,不均匀强化者69例,其中强化明显者97例,无明显强化者6例;肿瘤强化最明显处CT值为69~341(153.46±79.82)Hu。
2.2 灌注图像的表现 见图1。以DSA结果为标准,全肝CTPI对103例肝内瘤灶的诊断符合率为100%。在HAP彩图上,肿瘤组织均表现为程度不同的高血流灌注,且明显高于周围正常肝组织,其中34例呈均匀高灌注,69例不均匀高灌注;有5例肿瘤中心坏死区呈明显的低灌注,但仍低于边缘部的灌注程度,其余液化坏死区无血流灌注。在HPI彩图上,周围肝组织、肿瘤及其邻近区域的表现与HAP基本一致,但中心坏死区在HPI上明显减低,肿瘤轮廓更清晰。在PVP彩图上,肿瘤组织均呈程度不同的低血流灌注,且明显低于正常肝组织;少数肿瘤边界清晰,但多数与周围肝组织无明确的界限,边缘部分通常较中心灌注程度高。而对于边缘模糊的瘤灶,CTPI所示的肿瘤面积较常规增强图像略大
2.3 灌注参数的比较 与正常肝组织比较,肿瘤组织的 BF、BV、PS、HAP、HPI参数值均明显升高,而MTT、PVP值则明显降低,差异均有统计学意义(P<0.05,表1)。
3 讨论
理论上肿瘤的CT强化程度与其血管数目和进入组织间隙对比剂数量成正比,结合肿瘤大体形态学特点,可对其作出可能的定性诊断和血供程度的大概评价。但病变表现不典型或期相时间不准确时常规CT常难以定性。而CTPI通过静脉团注对比剂后对选定层面快速扫描和采集,获得该层面内每一像素的TDC及各种灌注参数值,在良好显示解剖细节的同时可更进一步通过宏观灌注参数的变化来反映肿瘤内部新生血管微观功能状态,有助于了解PLC血管血供特性和定性诊断,因此在PLC中的应用优于常规CT及其他影像检查[5]。
肝脏为门静脉和肝动脉双重供血,肝结节随着恶性程度的提高,动脉供血不断增加而门静脉供血不断减少[6]。CTPI就是居于这种血供的变化,根据扫描层面内不同区域各参数值不同赋予彩阶及其颜色的差异来评价组织的血流灌注状态,从而作出病变程度的判断。高血流灌注在CTPI彩图上呈现红色或黄色的区域,而无灌注则呈现黑色的区域。本研究显示,在HAP彩图上,103例患者的肿瘤组织均表现为程度不同的高血流灌注,其中34例呈均匀高灌注,69例不均匀高灌注。有5例肿瘤中心坏死区呈明显的低灌注,低于边缘部的灌注程度,其余液化坏死区无血流灌注。HPI图的表现与HAP基本一致,但显示的肿瘤轮廓更清晰。在PVP图上,肿瘤均呈程度不同的低灌注,且明显低于肝组织;少数肿瘤边界清晰,但多数与肝组织无明确界限,边缘部分通常较中心灌注程度高,且中心坏死区亦呈低灌注,表明PLC基本属于富血型且主要由肝动脉供血,而门静脉几乎不提供血运,坏死区通常少或无血流灌注。
肿瘤新生血管是肿瘤形成的前提和基础,以往认为血管内皮生长因子(vascular endothelial growth factor,VEGF)和微血管密度计数(microvessel density,MVD)是血管生成量化的标准,但其为仅采集极小区域肿瘤标本行免疫组化的繁琐方法,难以反映肿瘤整体的血管生成状态和血管活性。而CTPI虽不能直接观察到微血管,但作为一种无创简单的功能成像,其参数与MVD和VEGF密切相关[7],不仅能反映肝脏及肿瘤动脉、门静脉供血情况,而且能在毛细血管水平上反映肿瘤内部微循环血流特点,从而间接评价肿瘤血管生成情况和组织代谢功能。
肿瘤的灌注不同于正常组织,因肿瘤内大量的VEGF促进血管生成[8],肿瘤无序生长,致使肿瘤的BF和BV较正常肝组织显著增加并显高灌注状态。肝结节癌变逐渐形成的动脉高灌注和门静脉低灌注,理论上是肝动脉供血比例HPI逐渐增加的过程。本研究显示,肿瘤的HAP、HPI均较肝组织明显升高,PVP明显降低,与肝组织相比呈明显倒置倾向,该结果与CTPI彩图的表现一致,充分证实了PLC以肝动脉供血为主,BF动脉血成分的增加,打破了原有的血供平衡改变了正常肝组织的血供组成比例,使肿瘤的HAP和HPI明显上升,特别是HPI最能评价肿瘤的血流状态和供血比例,对肿瘤良恶性的鉴别更具意义,也为PLC的介入治疗提供了一定的理论依据。MTT和PS理论上均可反映肿瘤新生血管特性。本研究显示,肿瘤的MTT较肝组织明显缩短,因肿瘤组织无正常肝窦水平的缓慢血循环,血流可迅速通过微血管及瘤内动静脉瘘使得MTT明显缩短。PS显著升高间接说明了肿瘤微血管内皮发育不良,血管通透性高的特点。因此,CTPI可通过参数图像及数据直接地反映肿瘤的血流动力学改变情况,提高了PLC的正确诊断率。
本研究通过常规CT与CTPI图像的对比发现,常规CT难以直观显示瘤旁浸润情况,对于边缘模糊的瘤灶,参数彩图显示的肿瘤面积较常规增强图像略大,肿瘤边缘区和瘤旁肝组织的BV、BF、PS、HAP及 HPI均增高,这与国内外文献报告[9-10]相符,说明了瘤细胞已向瘤周侵犯,该区域存在大量新生血管,血流灌注量大。而CTPI可早期发现形态上无改变而仅有血流动力学改变的病变;对一些无明显假包膜的肿瘤,CTPI则可更好地显示肿瘤实际范围,这为临床确定肿瘤大小提供了很好的参考,也有利于PLC的早期检出率。

表1 肿瘤组织与正常肝组织灌注参数的比较(x ± s,n=103)
传统CTPI基本能满足临床对PLC诊断的需要,但其扫描范围窄,不利于显示器官的全貌,易漏诊;加上扫描时间长,呼吸引起的层面漂移总是难免,不利于参数分析;辐射剂量始终是限制CTPI发展的一大问题,并随着全肝CTPI的应用将进一步增加辐射量[3]。而320排CTPI在很大程度上缓解了以上问题,首先是扫描速度为传统CT的4倍,辐射剂量可减少约35% ~65%,机架只需旋转1圈即可获得全肝扫描数据,真正实现全肝四维功能成像[11-13],更利于高质量、即时及动态显示整个肝脏的灌注情况和血管立体结构,即使远离肝门区的病灶也能很好的显示;其次是320排CT后处理功能使时间和空间分辨率的显著提高,无需屏气配合,无螺旋和漂移伪影,提高了微小病灶和血管的显示能力;再则是将灌注和血管重建及增强检查融为一体,实现了1次检查完成多重任务,避免了传统CT同时检查需分步骤、分次造影,明显减少检查时间、辐射量、造影剂用量和费用,提高了患者的舒适感和安全性[12,14]。本研究103例患者 DSA 所显示的瘤灶均在CTPI得以检出,较好地显示了局部灌注信息。利用320排CTPI检查的参数测量和诊断更为可靠,对PLC的早期诊断、生物学特征评价及指导介入治疗等有着较高的应用价值,也为目前因不同CT设备差异较大的正常肝脏灌注参数研究提供了一个新的研究途径和领域。
[1]王守安,白人驹,孙浩然,等.肝细胞癌的CT灌注成像及其在灌注参数图像上的表现[J].实用放射学杂志,2007,23(12):1630-1635.
[2]黄渊全,冯耀良,贾中芝.原发性肝癌的双源 CT灌注成像[J]. 江苏医药,2010,36(12):1373-1376.
[3]李金平,姜慧杰.多层螺旋CT灌注参数对肝癌血流变化的诊断价值[J].中国医学计算机成像杂志,2011,17(4):377-380.
[4]郭轶虹,谭理连,熊龙根,等.320排CT研究冠脉粥样硬化非钙化斑块与管腔狭窄(与SCA比较)[J].中国CT和MRI杂志,2011,9(5):45-47.
[5]朱石柱,黄丽雪,吴俊峰,等.CT灌注成像在原发性肝癌中的临床应用[J]. 疑难病杂志,2012,11(2):112-114.
[6]周 悦,高剑波,杨学华,等.多排螺旋CT灌注成像对兔VX2肝癌血供的评价[J].郑州大学学报:医学版,2011,46(2):182-185.
[7]Ma SH,Ix HB,Jia BH,etal.Peripheral pulmonary nodules;relationship between multislice spiral CT perfusion imaging and tumor anbiogenesis and VEGF expression [J].BMC Cancer,2008,8(1):186.
[8]周建平,周伟平.大肝癌TACE后肿瘤组织VEGF、av整合素表达及MVD变化[J].东南国防医药,2010,12(3):206-208.
[9]王恩峰,陈文军,苏保民,等.多排螺旋CT灌注成像对小肝癌诊断价值[J].哈尔滨医科大学学报,2012,46(2):166-169.
[10]Ippolito D,Sironi S,PozziM,etal.Perfusion CT in cirrhotic patients with early stage hepatocellular carcinoma:assessmentof tumorrelated vascularization[J].Eur JRadiol,2010,73(1):148-152.
[11]王文晶,钟 喨,华小兰,等.正常肝脏低剂量CT灌注研究[J]. 放射学实践,2010,25(3):316-319.
[12]刘凌云,覃 杰,周小香,等.320排CT在肝脏灌注检查中注射速率及对比剂浓度的研究[J].中华现代护理杂志,2010,16(32):3874-3876.
[13]Spira D,Schulze M,Sauter A,et,al.Volume perfusion-CT of the liver:Insights and applications[J].Eur JRadiol,2012,81(7):1471-1478.
[14]张玉平,李 屏,梁金峰,等.320排动态容积CT冠状动脉成像与冠脉造影对冠心病诊断的对比分析[J].第三军医大学学报,2012,34(6):570-572.

