单双核金属配合物选择性催化氧化对甲氧基苦杏仁酸
于卫峰 孟祥光 刘 莹 李小红
(四川大学化学学院,绿色化学与技术教育部重点实验室,成都610064)
1 引言
木质纤维素广泛存在于木本和草本植物中,是地球上最丰富的可再生资源.木质素是含有大量芳香二级醇结构单元的天然高分子化合物.1,2木质素主要含有香豆醇、松柏醇、芥子醇三种组成结构单元.3,4将木质素催化降解成有价值的化学品,对解决当前的资源和能源问题以及降低造纸工业对环境污染问题都有重要意义.5目前在生物质开发和利用中有效降解木质素仍是一个具有挑战性的难题.6,7在自然界中木质素降解酶(包括木质素过氧化物酶、8锰过氧化物酶9和漆酶10)被发现能够有效降解木质素,这三类酶都是金属酶,其活性中心分别含有铁、锰和铜离子.天然酶具有反应条件温和、高选择性和转化率、对环境无污染等优点,11但天然酶也存在容易失活、成本高和操控不方便等问题.因此在温和条件下利用金属配合物来模拟金属酶的活性中心,对了解天然酶的作用机理以及设计理想的模拟酶体系都具有重要意义.
木质素组成中含有大量芳香二级醇结构单元,通过断裂侧链二级醇结构单元中的Cα―Cβ键来降解木质素是一种重要的有效途径.12对甲氧基苦杏仁酸(4-MMA)是木质素降解酶的典型作用底物.近年来许多研究者通过研究H2O2氧化4-MMA的反应来检测分析天然木质素降解酶的活性及其影响因素.13−16Favier和Dunach17报道了高温条件下Bi(0)/O2体系对4-MMA的氧化反应表现出高的转化率,结果显示主要生成对甲氧基苯甲醛(AAD)和对甲氧基苯甲酸(4-MBA)两种产物,他们还讨论了其催化反应机理.
最近我们提出了一种选择性氧化芳香二级醇和芳香酮来达到降解木质素的方法,18,19在本文中我们选取了4-MMA作为木质素模拟底物,合成了一系列铜、钴、锰金属配合物,研究它们在温和条件下对4-MMA选择性氧化脱羧生成芳香醛的催化活性、选择性及其他影响因素.
2 实验部分
2.1 实验试剂
对甲氧基苦杏仁酸(99%)、过氧化氢(30%(w))、对甲氧基苯甲醛(AAD)(99%)、对甲氧基苯甲酸(4-MBA)(98%)、丙二酸二乙酯(99%)、乙醇胺(99%)、N(2-羟乙基)乙二胺(99%)、无水硫酸铜(99%)、硝酸钴(99%)、硫 酸 锰 (99%)、氢 氧 化 钠 (99%)、酒 石 酸(99.5%)、磷酸(85%)、醋酸(99.5%)均为市售分析纯试剂,所有其他化学药品及溶剂都是分析纯级,在使用前都做了一定纯化处理.
2.2 金属配合物的制备
配体N,N'-(2-羟乙基)丙二酰胺(L1)的合成及其铜、钴、锰单核金属配合物L1Cu、L1Co、L1Mn的制备参考文献方法,20,21并用元素分析及电感耦合等离子体发射光谱法(ICP-AES)进行了表征,其结构如图1所示.
元素分析计算值(%),C7H12N2O4Cu:C,33.40;H,4.80;N,11.13;实测值(%):C,33.49;H,4.76;N,11.17;ICP-AES,Cu:25.26%(质量分数).
元素分析计算值(%),C7H12N2O4Co:C,34.02;H,4.89;N,11.34;实测值(%):C,34.09;H,4.94;N,11.27;ICP-AES,Co:23.92%(质量分数).
元素分析计算值(%),C7H12N2O4Mn:C,34.58;H,4.98;N,11.52;实测值(%):C,34.59;H,4.93;N,11.47;ICP-AES,Mn:22.65%(质量分数).
配体N,N'-{2-(2-羟乙基氨基)乙基}丙二酰胺(L2)的合成及其铜、钴、锰双核金属配合物L2Cu、L2Co、L2Mn的制备参考文献方法,20,22并用元素分析及电感耦合等离子体发射光谱法进行了表征,其结构如图1所示.
元素分析计算值(%),C11H20N4O4Cu2:C,33.08;H,5.05;N,14.03;实测值(%):C,33.10;H,5.08;N,14.09;ICP-AES,Cu:31.88%(质量分数).
元素分析计算值(%),C11H20N4O4Co2:C,33.86;H,5.17;N,14.36;实测值(%):C,33.92;H,5.18;N,14.32;ICP-AES,Co:30.28%(质量分数).
元素分析计算值(%),C11H20N4O4Mn2:C,34.57;H,5.27;N,14.66;实测值(%):C,34.60;H,5.32;N,14.59;ICP-AES,Mn:28.80%(质量分数).
2.3 仪器与测量方法
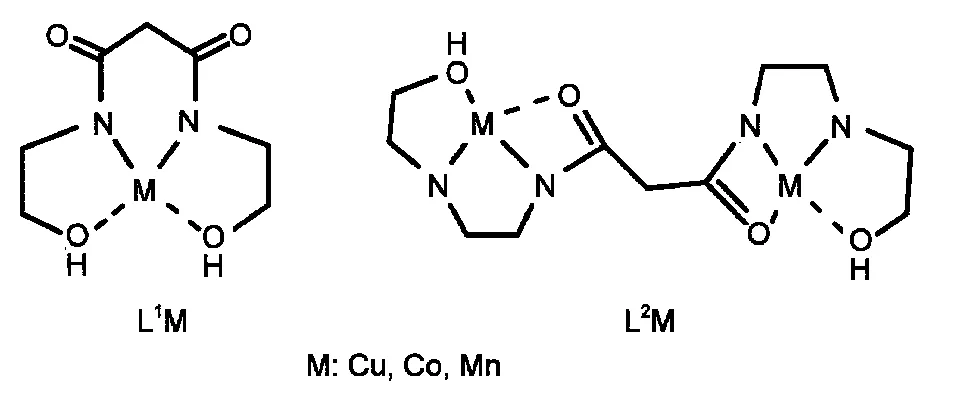
图1 单、双核金属配合物的化学结构Fig.1 Chemical structures of mononuclear and binuclear metal complexes
Hitachi U-2910紫外-可见光光度计(Tokyo,Ja-pan);GC-MS(Agilent 5973 Network 6890N,USA);HPLC(Waters 1525,USA);元素分析仪(Carlo Erba 1106,USA);1H NMR(Bruker,Switzerland)CDCl3作标准;傅里叶变换红外光谱仪(FT-IR,Nexus 6700,USA).
典型反应和检测方法:盛有15 mL 0.05 mol·L−1缓冲溶液的反应瓶中依次加入催化剂LM(M=Cu,Co,Mn)、H2O2、反应底物 4-MMA,各物质的初始浓度分别为:[LM]0=5×10−5mol·L−1,[H2O2]0=0.03 mol·L−1,[4-MMA]0=1×10−3mol·L−1,控制反应温度为35 °C,每隔一定时间间隔从反应瓶中取出0.5 mL反应溶液并稀释10倍.对甲氧基苯甲醛(AAD)(ε300=9500 L·mol−1·cm−1)在300 nm处有很强光谱吸收,而4-MMA和4-MBA在300 nm处没有光谱吸收,因此可以用Hitachi U-2910紫外-可见光光度计通过检测300 nm处的吸光度定量分析测得AAD的浓度.用GC-MS(Agilent 5973 Network 6890N,USA)定性和用HPLC(Waters 1525,USA)定量检测最终的反应溶液.GCMS测试条件:DB-5毛细管柱;载气,N2(速率60 cm3·min−1),He(速率2.0 cm3·min−1);气化室温度,300 °C;柱温程序升温模式,40°C保持4 min,40−260°C(升温速率15 °C·min−1);进样体积,0.1 μL.HPLC测试条件:C18柱;流动相,甲醇/水(V/V=1:1),0.5 mL·min−1;柱温,30 °C;进样体积,20 μL;UV-Vis检测波长,280 nm.
3 结果和讨论
3.1 金属配合物催化H2O2选择性氧化4-MMA反应
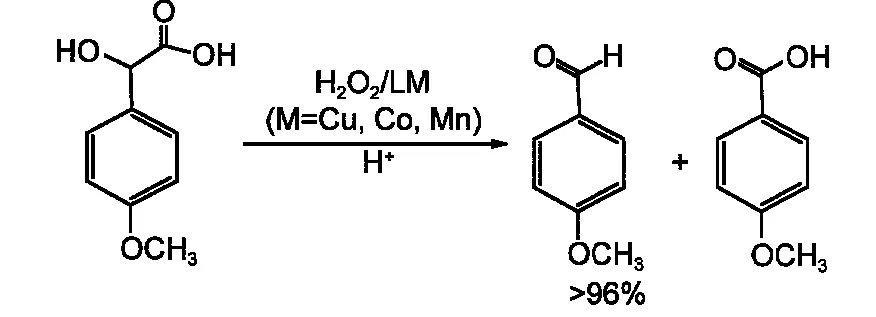
图2 4-MMA选择性催化氧化生成AAD和4-MBAFig.2 Selective catalytic oxidation of 4-MMA toAAD and 4-MBA
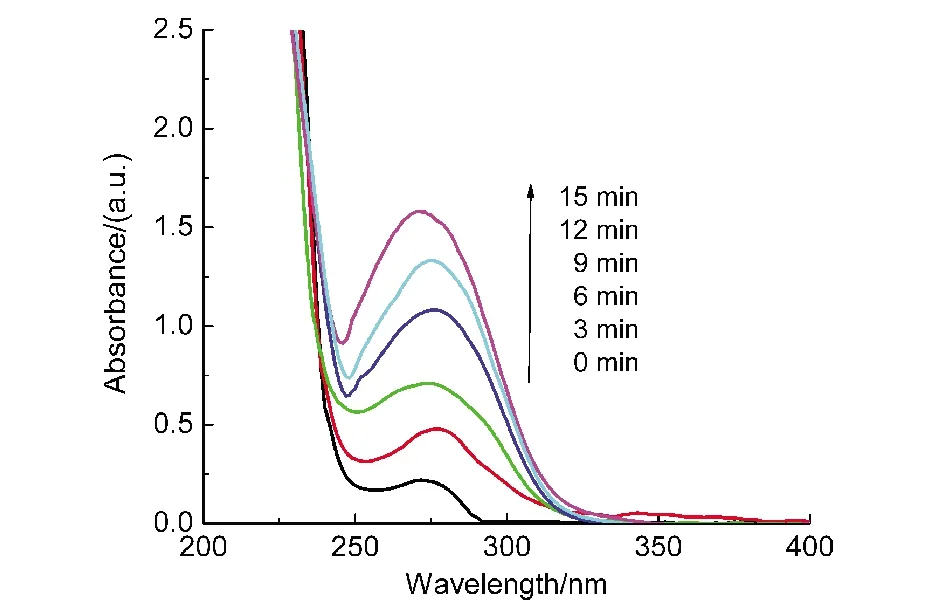
图3 反应溶液的UV-Vis光谱图随时间的变化Fig.3 UV-Vis spectral changes of reaction solution with time
本文选取芳香二级醇4-MMA作为木质素的模型底物,金属配合物选择性催化H2O2氧化4-MMA的反应如图2所示.在pH=3.0,35°C时L1Cu催化H2O2氧化4-MMA随时间的UV-Vis光谱变化如图3所示,从图3中可以发现在300 nm波长处AAD的光谱吸收强度随反应时间而增大,并且L1Cu的催化反应速率快,AAD能够快速生成.为了进一步分析反应的最终产物,对反应溶液进行了HPLC色谱检测,图4是L1Cu催化H2O2氧化4-MMA反应1 h后反应溶液的HPLC图,从图4中可以清楚地看到反应的主要产物为AAD以及少量的AAD继续被进一步氧化产物4-MBA,根据HPLC图谱数据以及与标准物质作对照可以进行定量分析.

图4 反应1 h后溶液的HPLC图Fig.4 HPLC profile of the reaction solution after reaction for 1 h
为了调查催化体系对反应的影响,在pH=3.0,35°C的酒石酸缓冲溶液中研究了六种单双核金属配合物催化H2O2氧化4-MMA的反应.研究表明六种金属配合物对该反应表现出明显不同的催化活性,但对AAD的选择性却较为相似,计算和分析结果如表1所示.从表1中可以看到铜、钴、锰金属配合物对4-MMA氧化成AAD都有高的选择性,选择性大于96%.铜金属配合物的催化效率最高,4-MMA在1 h内转化率可以达到80%以上,而对同一种金属配合物而言,双核配合物显示了比单核配合物更高的催化活性.这可能是由于双核金属配合物能更好地活化H2O2以及与底物良好的结合和协同作用所致.
为了进一步调查缓冲溶液对反应的影响,选择了酒石酸、磷酸、醋酸三种缓冲液作为研究体系,研究结果列于表2.出人意料的是,缓冲溶液的种类对反应速率以及产物选择性都有很大影响.从表2中可以看到酒石酸体系下的4-MMA的转化率、AAD的生成量、AAD的选择性及催化反应效率都最优.这可能是由于在酒石酸环境下金属配合物的配位环境有利于H2O2对金属配合物中的金属离子或配体进行活化,使得电子在金属离子与配体间更容易转移,有利于活性物种的形成和氧化还原反应的进行.
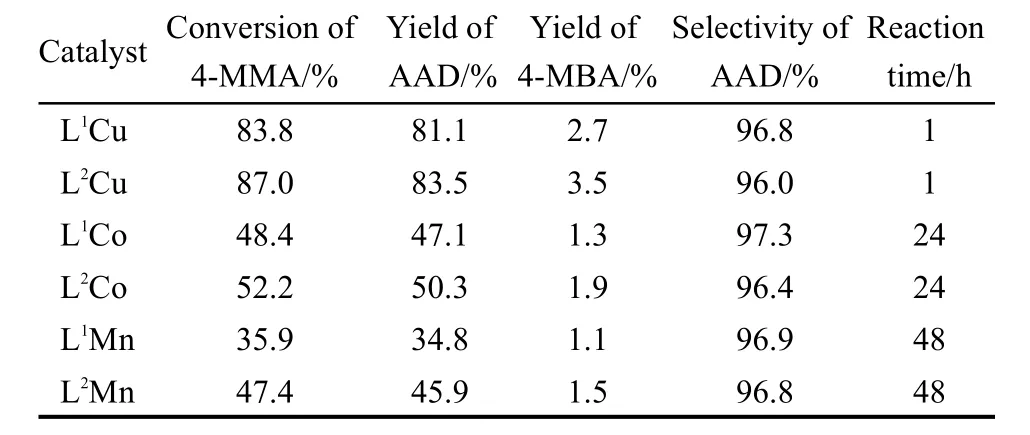
表1 pH=3.0,35°C时在酒石酸缓冲溶液中金属配合物催化反应的产物产率以及选择性Table 1 Yields and selectivity of products of reaction catalyzed by metal complexes in tartaric acid buffer solution at pH=3.0 and 35°C
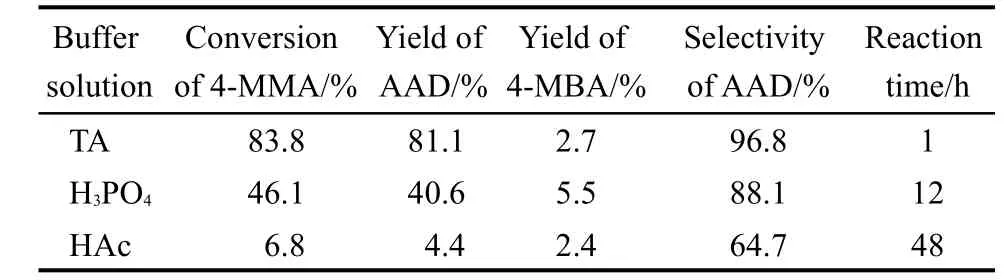
表2 pH=3.0,35°C时不同缓冲溶液对选择性氧化4-MMA的影响Table 2 Effect of different buffer solutions on the selective oxidation of 4-MMAat pH=3.0 and 35°C
3.2 pH效应和动力学分析
根据实验数据可以发现,在H2O2大大过量情况下,ln[(A∞−A0)/(A∞−At)]−t为很好的直线关系(相关系数大于0.995),如图5所示,其中A0、At、A∞分别为在反应时刻t=0,t,∞时反应溶液在300 nm处的吸光度,说明反应对底物4-MMA是表观拟一级的.这样可以根据实验数据获得反应的表观一级速率常数kobs.表观反应速率常数kobs由下列公式求得:kobst=ln[(A∞−A0)/(A∞−At)].为了避免产物干扰以及H2O2分解产生的影响,采用初始反应速率法来计算表观反应速率常数,表3为计算得到的AAD生成的表观一级反应速率常数.从表3中可以看到AAD生成的表观反应速率常数随pH值的降低而增大,这可能是由于在酒石酸弱酸性环境下4-MMA上的羰基容易被质子化以及金属配合物与过氧化氢作用容易形成“可控过氧自由基”(LM-·OOH)活性氧物种,23,24有利于选择性氧化反应的进行.在此基础上我们也调查了碱性条件下的催化氧化反应,结果发现在碱性条件下更易生成活泼的羟基自由基、超氧自由基等活性氧物种,由于这些活性氧物种更活泼,25,26既可以进行亲核反应又可以进行亲电反应,因此使得氧化反应产物没有选择性,最终被氧化为小分子酸和二氧化碳等物质.
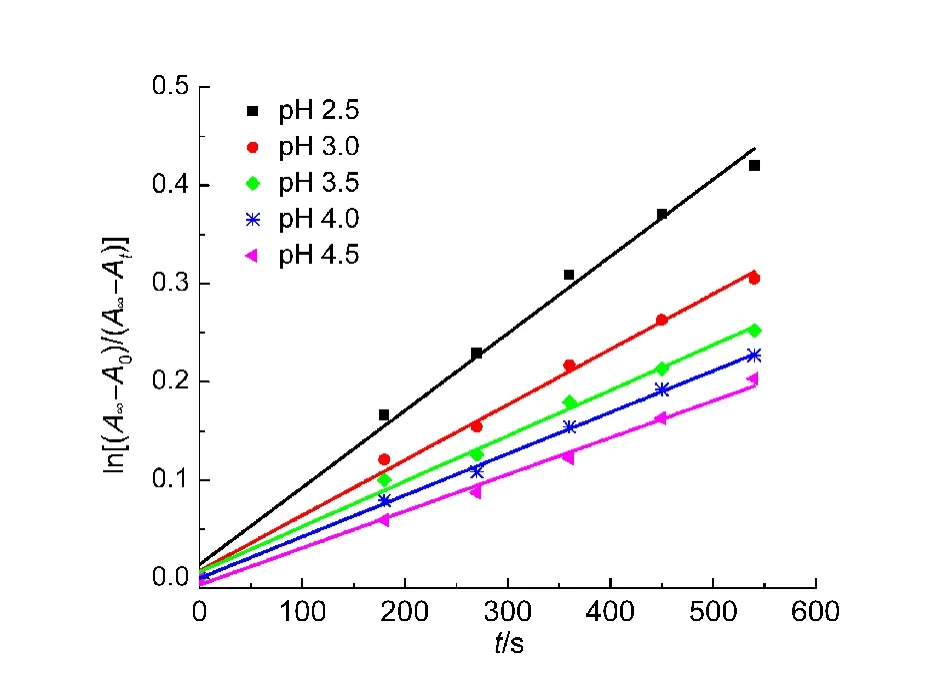
图5 35°C时酒石酸缓冲溶液体系下L1Cu催化H2O2氧化4-MMA的ln[(A∞−A0)/(A∞−At)]−t线性关系图Fig.5 Plots of ln[(A∞−A0)/(A∞−At)]vs reaction time t for the oxidations of 4-MMAby H2O2using L1Cu as catalyst in tartaric acid solution at 35°C

表3 35°C时酒石酸缓冲溶液下金属配合物催化AAD生成反应的表观一级反应速率常数(kobs)Table 3 Apparent first-order rate constants(kobs)of AAD formation catalyzed by metal complexes in tartaric acid buffer solution at 35°C
为了了解H2O2在催化反应中的作用,进一步研究了H2O2浓度对催化反应速率常数的影响,在以L1Cu作为催化剂,pH=2.5的酒石酸缓冲溶液中,H2O2浓度(在 0.01−0.05 mol·L−1范围内)对表观反应速率常数kobs的影响如图6所示.实验测得lgkobs−lg[H2O2]为直线关系(相关系数大于0.99),由公式kobs=k[H2O2]α,其中α为H2O2浓度的幂级数,经计算得到α=0.03,k=8.64×10−4s−1,计算结果表明α值相对较小,说明H2O2浓度对此氧化反应影响较小.这可能是由于H2O2先与金属配合物作用生成“可控的过氧自由基”(LM-·OOH)活性氧物种,然后此活性氧物种再与底物4-MMA反应生成AAD,这也进一步暗示了H2O2与金属配合物作用速率很快,不是反应的限速步骤,而“可控的过氧自由基”活性氧物种与4-MMA的反应才是整个反应的限速步骤.
3.3 六种金属配合物催化活性的比较
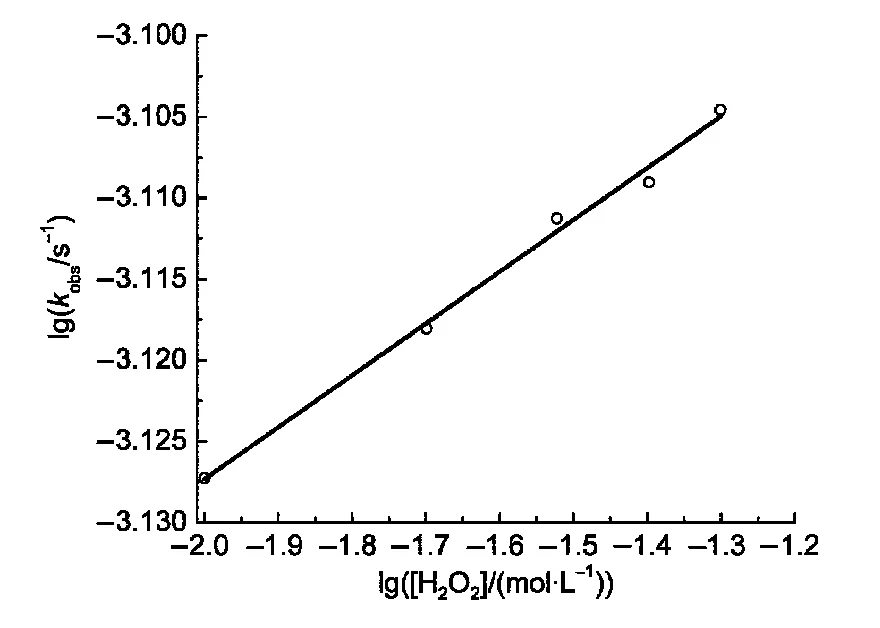
图6 H2O2浓度对表观一级反应速率常数的影响Fig.6 Effect of the concentration of H2O2on the apparent first-order rate constants
从表1中发现六种单双核金属配合物作为催化剂对4-MMA的催化效率为L1Cu>L1Co>L1Mn,L2Cu>L2Co>L2Mn,双核>单核.从表2中发现六种金属配合物在酒石酸体系下的催化效率和选择性最高.这可能是由于金属配合物的活性中心与H2O2作用形成活性物种以及它们电子转移的能力不同而引起的.在酒石酸缓冲溶液体系下金属配合物的配位环境更有利于H2O2对金属配合物的中心离子或配体进行活化,更易形成稳定的“可控的过氧自由基”物种,使得电子在金属离子与配体间更容易发生转移,从而加快反应活性氧物种的形成和氧化还原反应的进行;双核金属配合物具有两个金属离子,更易与H2O2作用而被活化使之形成更多的“可控的过氧自由基”活性物种,从而加快了反应速率.
4 结论
以4-MMA作为木质素的模型底物,系统地研究了六种制备的单双核金属配合物催化H2O2氧化4-MMA的反应.研究表明:六种金属配合物对4-MMA的氧化有很好的选择性,4-MMA氧化为AAD的选择性大于96%;然而金属种类以及单双核配合物的类型对反应速率影响很大;缓冲溶液的种类对反应速率和选择性影响都很大;在本文条件下,生成的“可控的过氧自由基”(LM-·OOH)活性氧物种可能是产生良好选择性的主要原因.
(1) Chen,C.L.;Capanema,E.A.;Gracz,H.S.J.Agric.Food Chem.2003,51,6223.doi:10.1021/jf034507f
(2) Cotrim,A.R.;Ferraz,A.;Gonqalves,A.R.;Silva,F.T.;Bruns,R.E.Bioresource Technol.1999,68,29.doi:10.1016/S0960-8524(98)00082-0
(3) Santos,R.B.;Capanema,E.A.;Balakshin,M.Y.;Chang,H.;Jameel,H.J.Agric.Food Chem.2012,60,4923.doi:10.1021/jf301276a
(4) Sarkanen,K.V.;Hergert,H.L.Lignins:Occurrence,Formation,Structure and Reactions;Sarkanen,K.V.,Ludwig,C.H.Eds.;Wiley-Interscience:New York,1971;p 43.
(5) Kobayashi,H.;Ohta,H.;Fukuoka,A.Catal.Sci.Technol.2012,2,869.doi:10.1039/c2cy00500j
(6) Sathitsuksanoh,N.;George,A.;Zhang,Y.H.P.J.Chem.Technol.Biotechnol.2013,88,169.doi:10.1002/jctb.2013.88.issue-2
(7) Yuan,T.Q.;Xu,F.;Sun,R.C.J.Chem.Technol.Biotechnol.2013,88,346.doi:10.1002/jctb.2013.88.issue-3
(8) Have,R.T.;Teunissen,P.J.M.Chem.Rev.2001,101,3397.doi:10.1021/cr000115l
(9) Renganathan,V.;Gold,M.H.Biochemistry 1986,25,1626.doi:10.1021/bi00355a027
(10) Collins,P.J.;Kotterman,M.J.J.;Field,J.A.;Dobson,A.D.W.Appl.Environ.Microbiol.1996,62,4563.
(11) Tien,M.;Kirk,T.K.Science 1983,221,661.
(12) Barsberg,S.;Elder,T.;Felby,C.Chem.Mater.2003,15,649.doi:10.1021/cm021162s
(13) Tien,M.;Ma,D.J.Biol.Chem.1997,272,8912.doi:10.1074/jbc.272.14.8912
(14) Baciocchi,E.;Gerini,M.F.;Lanzalunga,O.;Mancinelli,S.Tetrahedron 2002,58,8087.doi:10.1016/S0040-4020(02)00997-3
(15) Brown,M.E.;Barros,T.;Chang,M.C.Y.ACS Chem.Biol.2012,7,2074.doi:10.1021/cb300383y
(16) Ferapontova,E.E.;Castillo,J.;Gorton,L.BBA.-Gen.Subjects 2006,1760,1343.doi:10.1016/j.bbagen.2006.04.003
(17) Favier,I.;Dunach,E.Tetrahedron 2003,59,1823.doi:10.1016/S0040-4020(03)00083-8
(18) Zeng,W.P.;Li,X.H.;Du,J.;Li,J.M.;Zhang,P.;Hu,C.W.;Meng,X.G.Acta Chim.Sin.2010,68,27.[曾伟鹏,李小红,杜 娟,李建梅,张 平,胡常伟,孟祥光.化学学报,2010,68,27.]
(19)Liu,B.;Meng,X.G.;Li,W.Y.;Zhou,L.C.;Hu,C.W.J.Phys.Chem.A 2012,116,2920.doi:10.1021/jp212489k
(20)Toki,T.;Mikuriya,M.;Okawa,H.;Murase,I.;Kida,S.Bull.Chem.Soc.Jpn.1984,57,2098.
(21) Hill,H.A.O.;Raspin,K.A.J.Chem.Soc.A 1968,3036.
(22) Feng,M.F.;Hu,W.;Jiang,W.D.;Xie,J.Q.Journal of Sichuan University of Science&Engineering 2004,17,140. [冯发美,胡 伟,蒋维东,谢家庆.四川理工学院学报,2004,17,140.]
(23) Li,J.M.;Meng,X.G.;Hu,C.W.;Du,J.;Zeng,X.C.J.Mol.Catal.A:Chem.2009,299,102.doi:10.1016/j.molcata.2008.10.026
(24) Lin,T.Y.;Wu,C.H.J.Catal.2005,232,117.doi:10.1016/j.jcat.2005.01.038
(25) Kadiiska,M.B.;Maples,K.R.;Mason,R.P.Arch.Biochem.Biophys.1989,275,98.doi:10.1016/0003-9861(89)90354-8
(26) Frelon,S.;Douki,T.;Favier,A.;Cadet,J.Chem.Res.Toxicol.2003,16,191.doi:10.1021/tx025650q

