ERCC1与RRM1在胰腺癌组织中的表达及临床意义
柴文刚 王广义 谢淑丽 王 蒙 (吉林大学第一医院,吉林 长春 130021)
胰腺癌半数以上位于胰头,约90%是起源于腺管上皮的管腺癌(PDA)。核酸剪切修复偶联因子1(ERCC1)定位于19q 13.2,是核苷酸外切修复酶家族中的重要成员之一,是细胞存活必需的DNA修复基因,具有损伤的识别和切除功能,其表达的高低能反映整个DNA切除修复(NER,核酸切除修复)活性的水平〔1〕。RRM1基因主要定位在人类染色体的11q15.5区域。这恰好也是一个多种恶性肿瘤疾病可能出现杂合子丢失现象的区域,其作用主要是为DNA修复提供原料〔2〕。研究显示ERCC1与RRM1与肿瘤的发生、发展及化疗耐受有关〔3〕。目前对两种基因的研究主要集中在非小细胞肺癌中,胰腺研究罕有报道。本实验通过免疫组化方法检测ERCC1及RRM1在PDA中的表达,明确其在PDA中的临床意义。
1 材料与方法
1.1 病例收集及分组 收集吉林大学第一医院2009年1月至2012年6月胰腺癌手术切除标本34例,男性24例(70.6%),女性10例(29.4%),年龄22~72岁,平均(55.2±12.8)岁。病理类型均为PDA,其中高分化(中高、高分化)12例(35.3%),低分化(中、中低、低分化)22例(64.7%);肿瘤直径<3 cm 18例(52.9%),≥3 cm 16例(47.1%);发生区域淋巴结转移18例(52.9%)。选取34例患者的癌旁组织(距癌组织≥3 cm),另收集正常胰腺组织20例。以上标本均经4%甲醛溶液固定后常规石蜡包埋、切片。
1.2 主要试剂 一抗为兔抗人ERCC1、RRM1多克隆抗体,购自北京博奥森生物技术有限公司。稀释液以0.01 mol/L PBS与10 mg/ml BSA与0.1%叠氮Na组成,稀释1∶400。免疫组化染色试剂盒购自福州迈新生物技术开发有限公司。试剂盒组成:A液,内源性过氧化物酶阻断剂;B液,动物非免疫血清(羊);C液,生物素标记的羊抗鼠/兔IgG;D液,链霉素抗生物素蛋白-过氧化酶。DAB工作液配制:A、B、C液各50 μl按顺序加入到0.85 ml的蒸馏水中,混匀后备用。
1.3 方法 ERCC1和RRM1染色方法均为SABC免疫组化法。细胞质和(或)细胞核内含棕黄色颗粒者为阳性细胞。根据切片中阳性细胞着色程度评分(无着色0分,弱着色1分,中度着色2分,强度着色3分)。ERCC1阳性细胞率评分(<1%,0分;1% ~9%,1分;10% ~24%,2分;25% ~50%,3分;>50%,4分),两评分之积为该病理切片评分值,且将评分值<3分定为低表达病例,≥3分定为高表达病例。RRM1阳性细胞率评分(<1%,0分;1% ~9%,1分;10% ~50%,2分;≥50%,3分),同样以两评分之积为样本评分,≥6分为高表达,<6分为低表达。阴性对照以0.01 mol/L PBS液(pH7.4)替代一抗作为阴性对照。免疫组化染色结果经两位有经验的病理医生进行双盲观察计数,根据以上评分标准统计最终样本得分。
1.4 统计学处理 采用SPSS13.0统计软件进行χ2检验及Fisher精确概率法检验。
2 结果
ERCC1在肿瘤组34例中高表达者14例(41.2%),其中高分化组高表达6例(50.0%)低分化组高表达83例(36.4%);发生淋巴结转移组高表达6例(33.3%),无淋巴结转移组高表达8例(50.0%);肿瘤直径≥3 cm组高表达者6例(37.5%),肿瘤<30 m组高表达8例(44.4%);癌旁组(n=34)23例(67.6%)高表达;正常胰腺组(n=20)高表达者 14例(70.0%)。RRM1在肿瘤组34例中高表达者10例(29.4%),其中高分化组高表达4例(33.3%),低分化组高表达6例(27.3%);发生淋巴结转移组高表达6例(33.3%),无淋巴结转移组高表达4例(25.0%);肿瘤直径≥3 cm组高表达者4例(25.0%),肿瘤直径<3 cm组高表达6例(33.3%)。癌旁组(n=34)18例(52.9%)高表达;正常胰腺组(n=20)高表达者16例(80.0%),肿瘤组与癌旁组及正常胰腺组比较ERCC1、RRML阳性率有显著性差异(P<0.05)。肿瘤组肿瘤大小、有无淋巴结转移、高、低分化与ERCC1、RRML阳性率无关(均P>0.05)。见图1,图2。
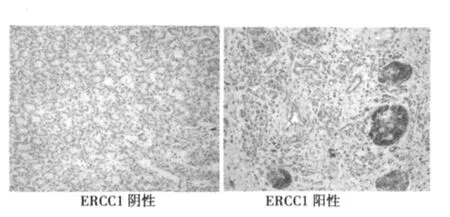
图1 免疫组化染色检测ERCC1表达(×200)

图2 免疫组化染色检测RRM1表达(×200)
3 讨论
ERCC1在人类DNA损伤修复中扮演着重要角色,尤其是修复紫外线所致的嘧啶二聚体与铂-DNA加合物中。ERCC1缺乏的细胞会产生修复缺陷。到目前为止,ERCC1与肿瘤的研究发现,在人群中ERCC1低表达者患肿瘤的风险高,如肺癌、胃癌、乳腺癌、卵巢癌等〔4,5〕,但在胰腺中的作用尚未阐明。国内研究显示,在诱导产生胰腺癌的SD大鼠中,胰腺癌组织的ERCC1表达率显著低于非癌胰腺组织〔6〕。国外众多研究结果不一,有人认为ERCC1的高表达是临床预后不良的独立危险因素〔7〕。ERCC1的低表达可能促使该人群易暴露于致癌物质中,导致胰腺癌的发生。当ERCC1与XPD、XPG、XPA等修复基因将DNA链中受损的部分切除后,DNA链上留下的空缺就由RRM1提供的核苷酸来填补。它是RNA合成的前体,参与核糖核苷酸还原成脱氧核糖核酸的过程,为DNA修复的限速酶。RRM1的研究主要集中于非小细胞肺癌中〔5〕,与之相反,在胰腺癌中RRM1的表达低于癌旁组织及正常胰腺组织,进一步证明,胰腺癌的发生可能与自身DNA损伤修复受到抑制或表达缺失有关。
ERCC1与RRM1是化疗药物铂类与吉西他滨耐药的关键基因〔8,9〕。而目前用于临床的一线化疗方案正是基于吉西他滨,如何减少化疗耐受、延长患者的生存时间及复发时间成为目前胰腺癌治疗的热点。根据基因表达的高低,化疗方案个体化,避免耐受药物的使用,可提高敏感性,降低毒副作用。
1 王慧敏,韩宝惠.核苷酸切除修复基因ERCC1在肺癌中表达的意义〔J〕.中国肿瘤,2009;18(8):653-6.
2 陈 芹,周彩存,张 颉.ERCC1、RRM1和BRCA1在非小细胞肺癌中的表达及预后意义〔J〕.肿瘤,2007;27(9):719-22.
3 Valsecchi ME,Holdbrook T,Leiby BE,et al.Is there a role for the quantification of RRM1 and ERCC1 expression in pancreatic ductal adenocarcinoma〔J〕?BMC Cancer,2012;12(3):104.
4 刘美荣,王潍博.胃癌组织与癌旁组织中ERCC1 AKT1的表达及临床意义〔J〕.山东大学学报 (医学版),2010;48(3):86-101.
5 傅建民,周 颉,谢建生,等.乳腺癌新辅助化疗对ERCC1基因表达的影响〔J〕.南方医科大学学报,2008;28(4):603-5.
6 杨竹林,李清龙,邓星辉,等.大鼠胰腺癌和非癌胰腺组织DNA损伤修复蛋白表达及意义〔J〕.医学研究杂志,2009;38(2):60-4.
7 Maithel SK,Coban I,Kneuertz PJ,et al.Differential expression of ERCC1 in pancreas adenocarcinoma:high tumor expression is associated with earlier recurrence and shortened survival after resection〔J〕.Ann Surg Oncol,2011;18(19):2699-705.
8 Jae Jin Lee,Chi Hoon Maeng,Seon Kyung Baekb,et al.The immunohistochemical overexpression of ribonucleotide reductase regulatory subunit M1(RRM1)protein is a predictor of shorter survival to gemcitabinebased chemotherapy in advanced non-small cell lung cancer(NSCLC)〔J〕.Lung Cancer,2010;70(2):205-10.
9 Lee S,Park YH,Kim KH,et al.Thymidine synthase,thymidine phosphorylase,and excision repair cross-complementation group 1 expression as predictive markers of capecitabine plus cisplatin chemotherapy as firstline treatment for patients with advanced oesophageal squamous cell carcinoma〔J〕.Br J Cancer,2010;103:845-51.

