趋化因子CXCL12/CXCR4轴与lgr5基因在结直肠癌组织中的表达
孙 艳 荣 容 张伟杰 曲荣锋 金仙梅 夏大文 李玉林 迟宝荣(吉林大学第二医院肿瘤血液内科,吉林 长春 00)
随着我国饮食习惯和结构的改变以及人口老龄化,结直肠癌发病率及死亡率呈上升趋势〔1〕,侵袭和转移是结直肠癌死亡的主要原因。近年研究表明CXC族趋化因子CXCL12,又称基质细胞衍生因子(SDF-1),及其受体CXCR4在肿瘤细胞的迁移、侵袭和转移中发挥着重要作用〔2〕。富含亮氨酸重复单位的G蛋白偶联受体5(lgr5)在小肠和结肠隐窝基底柱状上皮细胞特异性表达,经研究证实其为小肠和结直肠干细胞标记物〔3,4〕。目前认为肿瘤干细胞(CSC)是肿瘤中具有自我更新能力并能产生异质性肿瘤细胞的细胞,为肿瘤生长、转移和复发的根源〔5〕。因此本研究旨在探讨人结直肠癌组织中趋化因子CXCL12/CXCR4生物轴及干细胞标志物lgr5基因的表达变化及其与临床病理特征间的关系,从而探寻新的抗肿瘤治疗靶点。
1 材料与方法
1.1 标本来源 收集2011年1月至2011年12月在吉林大学第二医院基本外科行手术切除的结直肠癌组织及远端切缘部位正常组织标本各27例,术前均未行化疗、放疗等辅助治疗;取离体30 min内的恶性肿瘤组织、远端切缘部位正常组织,分别切取成直径为0.2~0.5 cm的组织块3块,迅速浸入预先放置RNAsafeguard保存试剂的灭菌冻存管中,再转入-80℃超低温冰箱保存。术后组织病理学确诊,根据第7版《AJCC肿瘤分期手册》,27例结直肠癌患者中Ⅰ期4例,ⅡA期6例,ⅢA期1例,ⅢB期8例,ⅢC期3例,ⅣA期3例,ⅣB期2例。
1.2 主要试剂和仪器 Trizol总RNA抽提试剂盒购自(德国QIGEN 公司),PrimeScript®RT reagent Kit with gDNA Eraser、SYBR®Premix Ex TaqTM均购自(日本TAKARA公司),人淋巴细胞分离液购自(天津TBD公司),RNAsafeguard保存试剂购自(杭州博日公司),ABI7500 Fast Real-Time荧光定量PCR仪购自(美国Applied Biosystems公司)。
1.3 总RNA提取和cDNA合成 取冷冻保存的组织标本100~200 mg,参照试剂盒说明书步骤,采用Trizol法提取总RNA,对获得的RNA采用紫外分光光度计测OD260和OD280值,按公式计算出RNA的浓度和纯度。
取 1 μg总 RNA,加入5 × gDNA Eraser Buffer 2 μl,gDNA E-raser 1 μl,RNase Free dH2O 使总反应体系为 10 μl,42℃ 2 min行基因组DNA的除去反应。之后冰上配制反应液,5×Prime-Script®Buffer 4 μl,PrimeScript®RT Enzyme Mix I 1 μl,RT Prim-er Mix 1 μl,基因组 DNA 除去后的反应液 10 μl,加入 RNase Free dH2O 使总反应体系为 20 μl,37℃ 15 min,85℃ 5 s,合成的cDNA -20℃保存待用。
1.4 SYBR Green实时定量PCR检测CXCL12、CXCR4及lgr5 mRNA表达 参照PrimerBank数据,由博仕生物公司合成CXCL12、CXCR4、lgr5及内参基因GAPDH引物,具体序列、产物大小及退火温度如下,CXCL12基因:上游引物 5'-ACTGGGTTTGTGATTGCCTCTGAA-3',下游引物 5'-GGAACCTGAACCCCTGCT GTG-3',产物126 bp;CXCR4基因:上游引物:5'-CCTATGCAAGGCAGTCCATGT-3',下游引物:5'-GGTAGCGGTCCAGACTGATGA-3',产物86 bp;lgr5基因:上游引物5'-CACCTCCTACCTAGACCTCAGT-3',下游引物:5'-CGCAAGACGTAACTCCTCCAG-3',产物94 bp。内参基因GAPDH:上游引物:5'-TGCACCACCAACTGCTTAGC-3',下游引物:5'-GGCATGGACTGTGGTCATGAG-3',产物87 bp。退火温度均为60℃。
取待测各样品cDNA 2 μl,分别加入SYBR Premix Ex TaqTM(Tli RNaseH Plus)(2 ×)12.5 μl,扩增基因上、下游引物(10 μmol/L)各 0.5 μl,ROX Reference Dye(50 × )0.5 μl,dH2O 9 μl,总反应体系25 μl。除样品管外,同时设置不加模板阴性对照管。将加样管置于ABI7500FAST荧光定量PCR检测槽内,打开软件,设定检测程序为:Relative Quantification(ddCt)Plate,检测荧光为SYBR。实时荧光定量PCR反应条件:95℃预变性2 min,95℃变性15 s,60℃退火30 s,共进行40个循环,设置溶解曲线。每个cDNA样本均重复检测3次,无明显差异的情况下取平均值。应用Relative Quantification(ddCt)Study定量分析软件采用 2-△△Ct法对 CXCL12、CXCR4及 lgr5 mRNA表达行相对定量分析〔6〕。
1.5 统计学处理 采用SPSS13.0统计软件进行统计学分析,计量资料采用中位数(最小值,最大值)表示,CXCL12、CXCR4及lgr5 mRNA在不同组织间、临床病理参数之间表达差异的统计学处理采用Wilcoxon、Kruskal-Wallis秩和检验。
2 结果
2.1 RNA抽提结果 提取的RNA经琼脂糖电泳,紫外投射仪下观察,18 s和28 s条带完整、明亮,28 s宽度约为18 s的2倍,OD260/OD280平均为1.8~2.0,表示抽提的RNA纯度较高。
2.2 CXCL12、CXCR4及lgr5 mRNA实时定量PCR表达结果
CXCL12、CXCR4、lgr5及内参基因 GAPDH的 SYBR Green实时定量PCR产物显示,荧光扩增曲线呈平滑的S型曲线,溶解曲线分析呈单一峰无非特异性荧光,表明PCR产物无非特异性扩增及DNA污染。
27例结直肠癌组织及27例匹配的远端切缘部位正常组织中均检测到CXCL12、CXCR4、lgr5 mRNA表达,癌组织中CXCR4、lgr5 mRNA表达均明显高于正常组织,但CXCL12 mRNA在癌组织中表达下调,癌组织中表达明显低于匹配正常组织,两组间差异均有统计学意义(P<0.01)。见表1。
2.3 结肠癌组织中CXCL12、CXCR4、lgr5 mRNA表达与临床病理特征的关系 27例结直肠癌患者中男性12例,女性15例。年龄≤60岁13例,>60岁14例,平均年龄62岁。结肠癌11例,直肠癌16例。有淋巴结转移12例,无淋巴结转移15例。CXCL12、CXCR4、lgr5 mRNA在不同性别、年龄、肿瘤原发部位、大小、组织学类型组间表达差异均无统计学意义(P>0.05)。但有淋巴结转移组CXCR4、lgr5 mRNA表达高于无淋巴结转移组,且有淋巴结转移组CXCL12 mRNA表达下降更显著,差异具有统计学意义(P<0.05)。见表2。

表1 CXCL12、CXCR4、lgr5 mRNA在结直肠癌组织及匹配正常组织中的表达〔中位数(最小值,最大值)〕
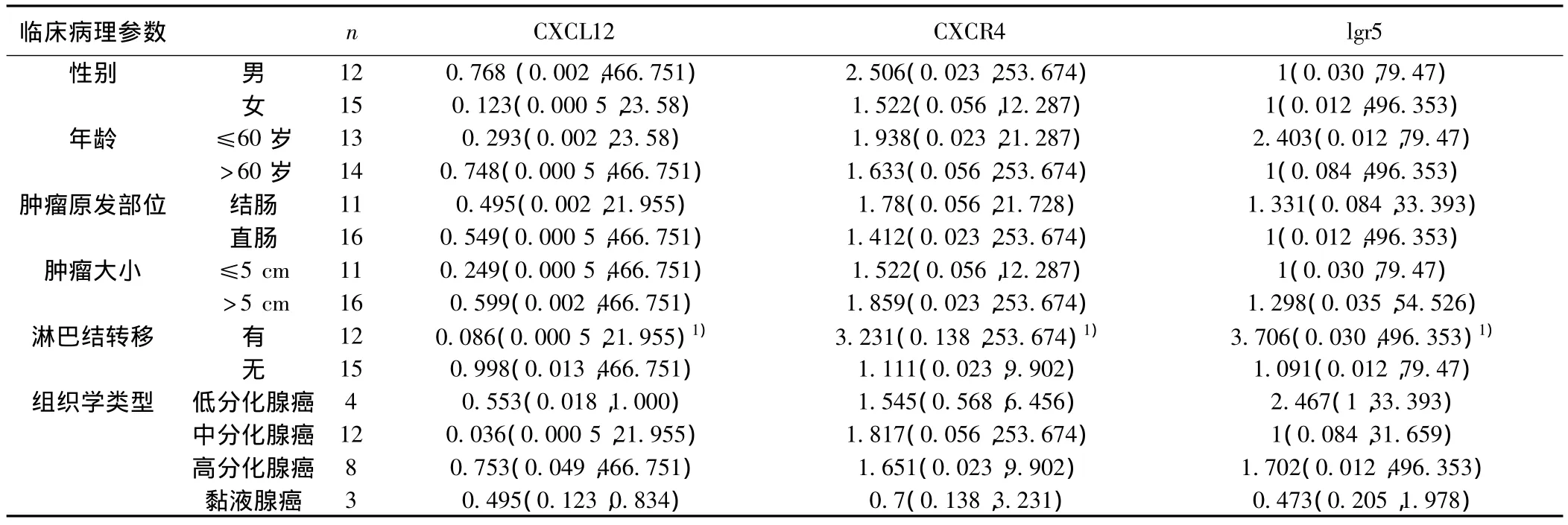
表2 结直肠癌组织中CXCL12、CXCR4、lgr5 mRNA的表达与临床病理特征的关系〔中位数(最小值,最大值)〕
3 讨论
新近《自然》和《科学》杂志同期发表的3项涉及脑、皮肤及肠道肿瘤的研究,首次在原生环境中确定CSC的存在〔7~9〕。其中Schepers等〔7〕在小鼠肠道腺瘤模型中,通过谱系追踪技术证实,可标记正常肠道腺窝干细胞的标志物lgr5,也同时出现在腺瘤细胞的一个亚群中。研究表明此类细胞约占5% ~10%,位于腺瘤基底部,于潘氏细胞间杂分布,是驱动腺瘤增长的关键。此项被称之为“看见肿瘤干细胞”的研究为CSC作为治疗靶点提供了确凿的证据。
人类lgr5基因定位于染色体12q22~q23,在大脑、脊髓、乳腺、毛囊、生殖器官及胃肠道等均有表达。Wnt信号通路广泛作用于机体生长发育过程,参与人体的胚胎发育、干细胞的增殖分化以及肿瘤的形成。lgr5作为Wnt信号通路中靶基因,当信号通路异常激活时,引起lgr5的表达显著升高,可能对肠上皮细胞的恶性转化起到重要作用。而研究也表明lgr5是小肠和结直肠干细胞标记物,推测如干细胞的Wnt信号通路异常激活后,引起靶基因lgr5的表达升高,可促进干细胞的增殖分化和恶性转化。
根据肿瘤细胞基于趋化因子实现器官特异性转移的理论〔10〕,不同的肿瘤高表达特异的趋化因子受体,而有些器官高表达其相应的趋化因子配体,肿瘤细胞利用趋化因子与其受体的特异性结合力,最终达成向这些器官的特异性转移。趋化因子CXCL12与其特异性受体CXCR4所构成的CXCL12/CXCR4生物学轴在多种肿瘤的播散和器官特异性转移中发挥着重要作用〔2〕。高表达CXCR4的肿瘤细胞,可能在CXCL12趋化、牵引下,转移至作为配体产生源的某些器官,从而形成器官特异性转移。
基于CSC是肿瘤复发及转移的种子细胞,以及CXCL12/CXCR4生物学轴在肿瘤的播散和器官特异性转移中的重要作用。笔者推测结直肠癌发生、发展进程中,如Wnt信号通路靶基因lgr5的表达升高,可促进结直肠干细胞的增殖分化和恶性转化,此后在趋化因子CXCL12与其特异性受体CXCR4所构成的CXCL12/CXCR4生物学轴作用下,实现结直肠癌的侵袭和转移。
因此在本研究中,笔者采用SYBR Green实时定量PCR检测54例结直肠癌组织、匹配的远端切缘正常组织中CXCL12、CXCR4及lgr5 mRNA表达。结果显示癌组织中lgr5、CXCR4在mRNA转录水平表达明显升高,且与淋巴结转移相关。而CXCL12 mRNA在癌组织中表达低于匹配正常组织。癌组织中CXCR4 mRNA表达上调及CXCL12 mRNA表达下调,可促使细胞定向迁移至趋化因子浓度较高的组织器官。进一步统计学分析显示有淋巴结转移组CXCL12 mRNA表达下降更显著,也佐证了CXCL12/CXCR4生物学轴在结直肠癌转移中的作用。
肿瘤干细胞具有的自我更新能力和分化潜能、高致瘤性、耐药性等生物学特点,决定CSC是手术、放化疗等传统治疗失败的主要因素。常规的肿瘤治疗方法对处于相对静止状态的CSC起效甚微,反而药物筛选、富集及残存的CSC得以增殖,从而成为肿瘤复发及转移的种子细胞。通过揭示CSC表面标记物,CSC中突变基因或异常信号传导途径等潜在治疗靶点,方能更有效地靶向CSC〔11〕。本实验结果显示癌组织中 lgr5在mRNA转录水平表达明显升高,且与淋巴结转移相关,提示结直肠癌肿瘤干细胞参与肿瘤的发生及转移。趋化因子CXCL12与其特异性受体CXCR4所构成的CXCL12/CXCR4生物学轴在多种肿瘤的局部侵袭和器官特异性转移中的作用也得以证实。因此通过CSC生物学性状的揭示,CXCL12/CXCR4生物轴在肿瘤侵袭及转移调控机制的进一步研究,预测CXCL12/CXCR4、lgr5有望成为抗肿瘤治疗的新靶点。
1 万德森.结直肠癌流行趋势及其对策〔J〕.癌症,2009;28(9):897-902.
2 Teicher BA,Fricker SP.CXCL12(SDF-1)/CXCR4 pathway in cancer〔J〕.Clin Cancer Res,2010;16(11):2927-31.
3 Barker N,van Es JH,Kuipers J,et al.Identification of stem cells in small intestine and colon by marker gene Lgr5〔J〕.Nature,2007;449(7165):1003-7.
4 Haegebarth A,Clevers H.Wnt signaling,lgr5,and stem cells in the intestine and skin〔J〕.Am J Pathol,2009;174(3):715-21.
5 Eros F,Simonadi M,Federica P,et al.Therapeutic implications of colon cancer stem cells〔J〕.World J Gastroenterol,2010;16(31):3871-7.
6 Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method〔J〕.Methods,2001;25(4):402-8.
7 Schepers AG,Snippert HJ,Stange DE,et al.Lineage tracing reveals Lgr5+stem cell activity in mouse intestinal adenomas〔J〕.Science,2012;337(6095):730-5.
8 Chen J,Li Y,Yu TS,et al.A restricted cell population propagates glioblastoma growth after chemotherapy〔J〕.Nature,2012;488(7412):522-6.
9 Driessens G,Beck B,Caauwe A,et al.Defining the mode of tumour growth by clonal analysis〔J〕.Nature,2012;488(7412):527-30.
10 Luo C,Pan H,Mines M,et al.CXCL12 induces tyrosine phosphorylation of cortactin,which plays a role in CXC chemokine receptor 4-mediated extracellular signal-regulated kinase activation and chemotaxis〔J〕.J Biol Chem,2006;281(40):30081-93.
11 Takebe N,Harris PJ,Warren RQ,et al.Targeting cancer stem cells by inhibiting Wnt,Notch,and Hedgehog pathways〔J〕.Nat Rev Clin Oncol,2011;8(2):97-106.

