相对湿度和氨气应激对肉仔鸡血氨水平及细胞因子含量的影响
魏凤仙 胡骁飞 张敏红 李绍钰 徐 彬蔺 萍 孙全友 李 浩
(1.河南省农业科学院畜牧兽医研究所,郑州 450002;2.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193;3.河南农业科学院,河南省动物免疫学重点实验室,郑州 450002;4.河南省森林航空消防站,郑州 450003)
应激能影响动物和人体的免疫机能[1-2]。慢性应激触发机体产生的生物学效应包括急性自主神经功能不全、神经内分泌激活、血流动力学改变和引发炎症反应过程等。细胞因子不仅是调节免疫功能的蛋白质,也是神经内分泌系统与免疫系统之间信息交流的重要介质。了解相对湿度(relative humidity,RH)和氨气(NH3)应激条件下肉仔鸡血清相关细胞因子的动态变化,可为改善动物福利、增强机体免疫机能和提高动物的生产成绩提供理论依据。舍内环境应激因素中以有害气体NH3浓度经常超标、RH被普遍认识而不被重视最为常见。NH3被认为是肉鸡舍里最有害的气体[3],腹水症、胃肠炎、呼吸道疾病都与高浓度的NH3相关。通常认为RH对肉仔鸡的影响是与温度共同起作用的,但Yahav[4]认为,即使在适宜的环境温度(28和32℃)条件下,60% ~65%RH条件下的肉仔鸡仍能获得较多的饲料采食量和增重。Steptoe等[5]对众多研究人心理应激后细胞因子变化的结果进行统计学分析,结果表明血清中白细胞介素1β(IL-1β)和白细胞介素6(IL-6)是应激时炎症反应最具代表性的指示物。但也有研究发现应激不一定引起细胞因子的升高[6]。疫病多发、新病、混合性疾病增多及传播快、死亡率高等是当前畜禽养殖场疫病发生的特点。由于动物抗病性差,轻微的细菌或病毒感染即可能会引起死亡,其主要原因在于动物机体的免疫功能下降,对疾病的敏感性增加[7]。随着现代肉仔鸡早期生长速度的不断提高,源于环境与生理等内、外应激因素对肉仔鸡健康状况和生长性能的影响日渐显著,鸡舍内有害气体(NH3、硫化氢和二氧化碳)浓度及其与RH组合是影响鸡舍内环境的主要因素。就目前的有关研究现状而言,多数为评估鸡舍单一环境因素对肉仔鸡的影响,多因素组合效应研究鲜见报道。在实际生产中,更多的情况是温度、RH和有害气体浓度等多种环境因素交互作用危害鸡群健康。应激可以引起机体免疫机能的变化,而不同RH和NH3慢性应激条件下对肉仔鸡血氨及相关细胞因子影响的研究甚少。本试验采用智能人工气候舱控制设施,利用酶联免疫吸附(ELISA)方法测定机体重要细胞因子的变化,探寻RH和NH3慢性应激条件下免疫相关细胞因子动态变化规律。
1 材料与方法
1.1 试验动物及设计
1.1.1 试验动物
试验选择生长均匀的21日龄健康爱拔益加(AA)雄性肉仔鸡288只(雏鸡苗购自北京华都肉仔鸡公司,普通鸡舍饲养至21日龄),随机分为6个处理,每个处理6个重复,每个重复8只鸡,各处理肉仔鸡体重差异不显著(P>0.05)。
1.1.2 试验设计
试验采用双因素,2×3因子设计。处理1:30 mg/kg NH3+35% RH;处理 2:30 mg/kg NH3+60%RH;处理 3:30 mg/kg NH3+85%RH;处理 4:70 mg/kg NH3+35%RH;处理 5:70 mg/kg NH3+60% RH;处理 6:70 mg/kg NH3+85%RH。试验在人工气候实验舱完成,试验期3周。
1.2 可程式人工气候实验舱
本试验在动物营养学国家重点实验室可程式人工气候实验舱进行。6个处理的试验肉仔鸡分别饲养在6个可程式人工气候实验舱内,试验期间通过计算机程序设定分别控制人工气候实验舱内RH和NH3浓度至试验要求。试验鸡入舱前5 d,用福尔马林+高锰酸钾进行熏蒸。各人工气候实验舱内NH3浓度用德国多气体检测仪,RH用湿度计,每隔4 h检测1次,与计算机控制显示系统校对。其他环境参数基本相同,试验期间各试验舱内温度为25~26℃。
1.3 试验饲粮组成及营养水平
试验采用玉米-豆粕型饲粮,饲粮配方参照NRC(1994)肉仔鸡饲养标准配制,基础饲粮组成及营养水平见表1。各处理饲喂相同基础饲粮。
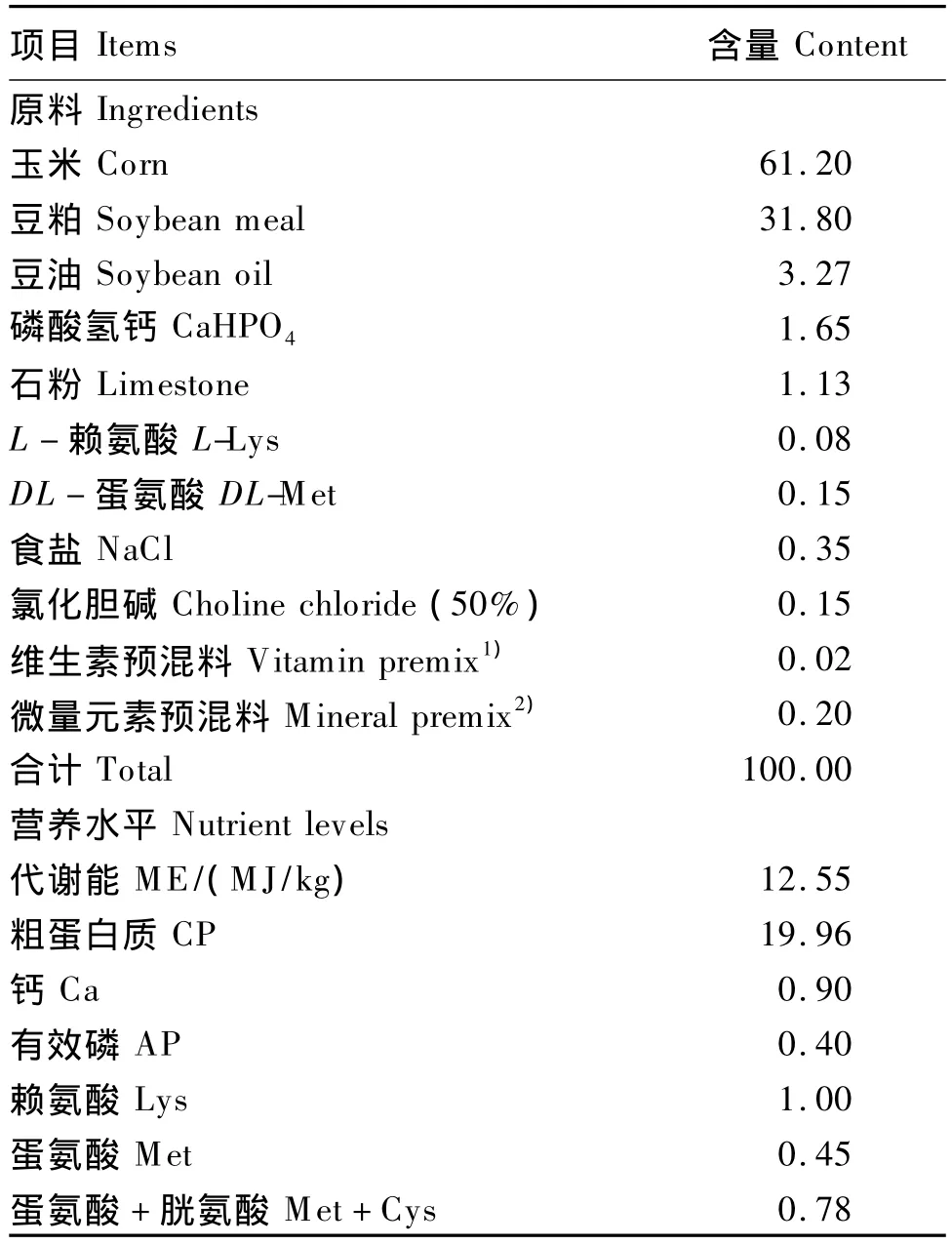
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.4 饲养管理及免疫
试验采用3层笼养,试鸡自由采食、饮水。24 h人工光照。免疫程序为:7日龄新支二联苗滴鼻点眼,14日龄法氏囊饮水免疫,19日龄法氏囊饮水免疫,26日龄新支二联苗饮水免疫。
1.5 样品采集与指标测定
1.5.1 样品采集与制备
RH和NH3慢性应激时间分别以入舱1、2和3周计。分别于入舱1、2和3周末每重复随机取1只体重接近平均体重的鸡,于清晨空腹,翅静脉采血10 mL。其中1 mL注入已制备好的抗凝管(抗凝剂为草酸钠)内,迅速摇动,使全血与抗凝剂充分接触,立即3 000 r/min、4℃离心10 min,收集血浆,并在30 min内测定血氨水平。另外9 mL全血注入干净试管内,倾斜静置,常温下制备血清。待血清析出后,在4~5℃下以3 000 r/min离心10 min。吸取上清液,分装置于安瓿管内,-20℃冷冻待测。
1.5.2 指标测定
血氨水平采用北京利德曼生化技术有限公司血氨测定试剂盒测定,加样和测定过程均在4℃条件下进行。测定方法为谷氨酸脱氢酶两点法。
细胞因子含量测定:双抗夹心酶联免疫法测定血清中IL-1β、白细胞介素4(IL-4)、IL-6、白细胞介素10(IL-10)4种细胞因子含量,严格按试剂盒说明书操作,每样品做2个复孔。按绘制的标准曲线,换算出各样品中相应细胞因子的含量(试剂盒购自RapidBio Lab,美国)。
1.6 统计分析
试验数据表示为平均值,采用SPSS13.0软件中的GLM模块的多因素程序和one-way ANOVA进行统计,以 P<0.05为显著水平,0.05≤P<0.10为存在显著性趋势,并进行LSD多重比较,如果存在互作,则对各处理进行Duncan氏法多重比较。
2 结果
2.1 RH和NH3应激对肉仔鸡血氨水平的影响
由表2可见,NH3浓度显著影响各阶段血氨水平(P<0.05)。高NH3浓度组入舱1、2周的血氨水平显著高于低NH3浓度组(P<0.05)。RH对入舱1、2周血氨水平影响不显著(P>0.05),而对入舱3周血氨水平影响接近显著(P=0.052),且随RH的增加血氨水平呈上升趋势。处理6与其他处理(处理5除外)相比,入舱3周血氨水平显著升高(P<0.05)。
2.2 RH和NH3应激对肉仔鸡血清IL-1β、IL-6含量的影响
由表3可见,NH3浓度对血清细胞因子含量有一定影响,入舱1、3周IL-1β含量分别接近显著(P=0.069)和显著(P<0.05);RH有升高血清IL-1β和IL-6含量的趋势,对入舱3周IL-1β含量影响显著(P<0.05)。
处理6入舱1周IL-1β含量显著高于处理2(P<0.05)。处理6入舱2周IL-6含量显著高于处理2(P<0.05)。处理6入舱3周IL-1β含量显著高于处理 1、2、5(P <0.05)。
随入舱时间的延长,血清IL-1β和IL-6含量呈上升的趋势。与入舱1周相比,处理3、4入舱3周血清IL-1β含量显著升高(P<0.05)。
2.3 RH和NH3应激对肉仔鸡血清IL-4、IL-10含量的影响
由表4可见,NH3浓度对入舱1、2周血清IL-4含量影响显著(P<0.05)。NH3浓度对入舱1、3周血清IL-10含量影响显著(P<0.05)。RH对入舱1周血清 IL-10含量影响显著(P<0.05)。85%RH与35%RH和60%RH相比,入舱1周血清IL-10含量显著升高(P<0.05)。
处理2入舱1周血清IL-4含量显著低于处理4、5、6(P <0.05),处理 6 显著高于处理 2、3(P <0.05);处理1入舱2周血清IL-4含量显著低于处理4、5(P<0.05);处理6入舱3周血清IL-4含量显著高于处理1(P<0.05)。处理6入舱1周血清IL-10含量显著高于处理1、2、4(P<0.05);处理6入舱3周血清IL-10含量显著高于处理1、3、5(P<0.05)。
随着入舱时间的延长,处理6血清IL-4、IL-10含量呈现持续增加趋势,而其他各处理呈现先增加后降低趋势。RH和NH3浓度对入舱1周血清IL-4含量互作效应接近显著(P=0.059),而对入舱3周血清IL-10含量有显著的互作效应(P<0.05)。
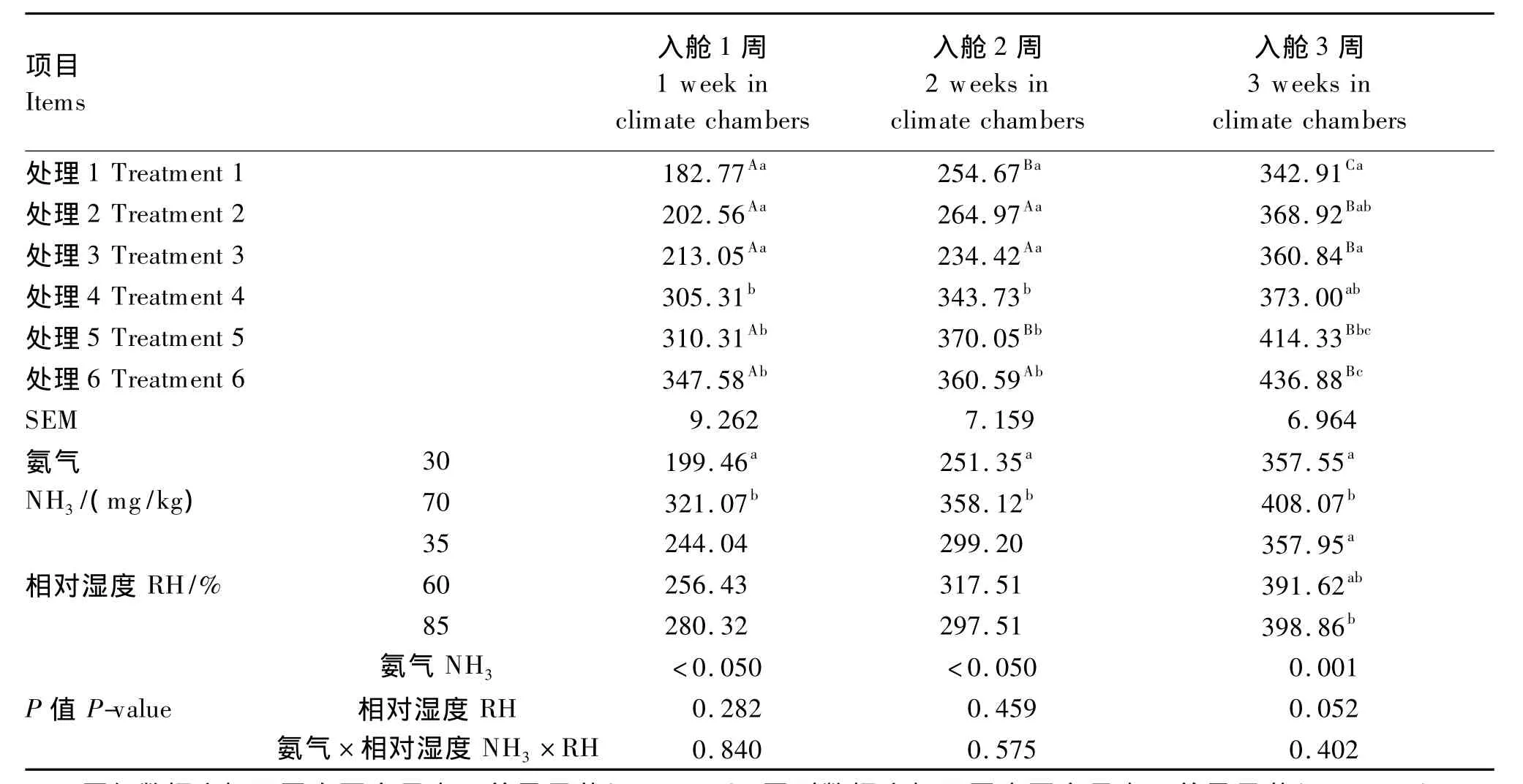
表2 RH和NH3应激对肉仔鸡血氨水平的影响Table 2 Effects of RH and NH3stress on plasma ammonia level of broilers μmol/L

表3 RH和NH3应激对肉仔鸡血清IL-1β、IL-6含量的影响Table 3 Effects of RH and NH3stress on the contents of IL-1βand IL-6 in serum of broilers ng/L
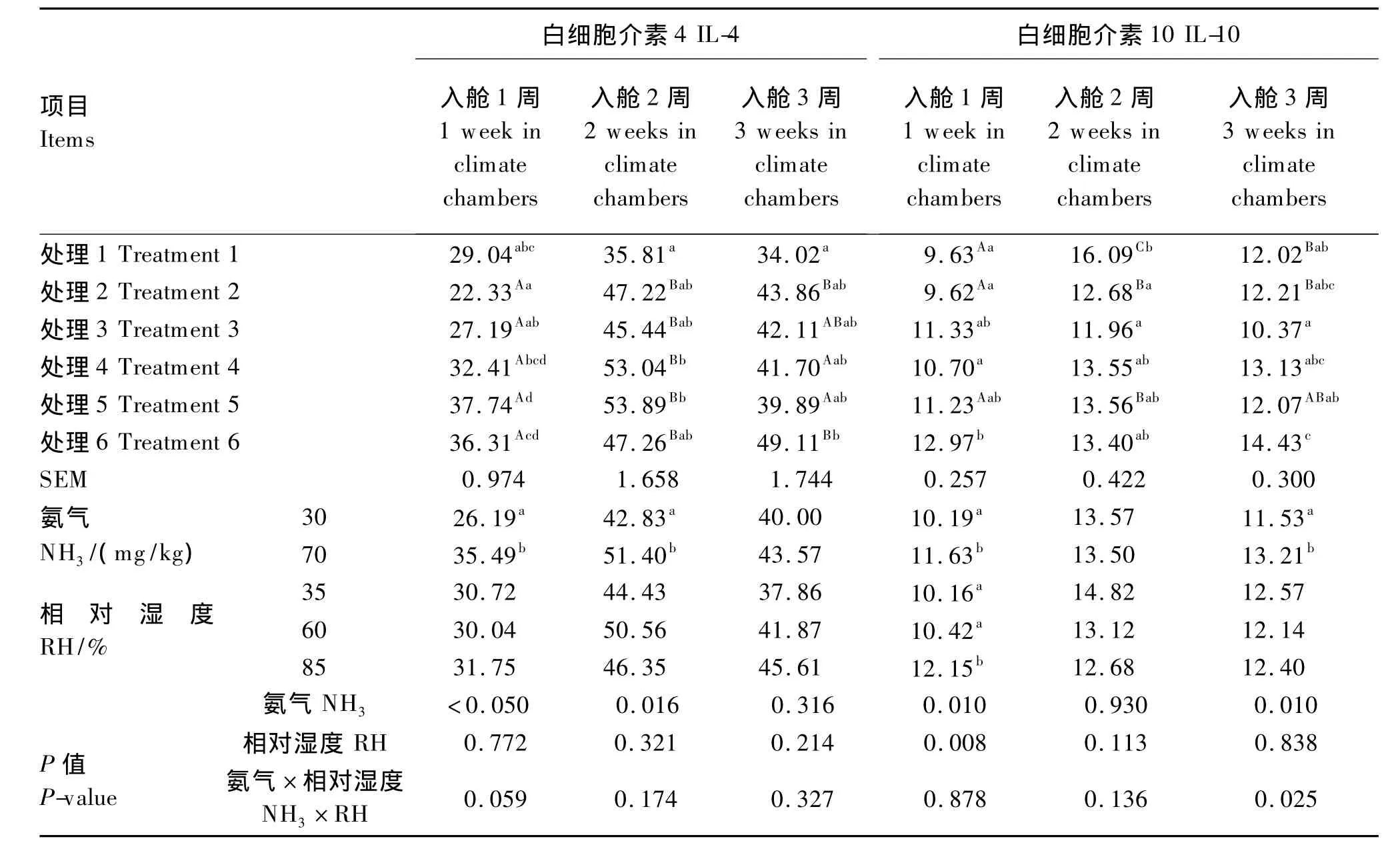
表4 RH和NH3应激对肉仔鸡血清IL-4、IL-10含量的影响Table 4 Effects of RH and NH3stress on the contents of IL-4 and IL-10 in serum of broilers ng/L
3 讨论
环境NH3浓度高是养殖生产中最常遇见的问题[8-10]。环境NH3浓度对肉仔鸡血氨水平有直接影响,宋弋[11]研究表明,血氨水平随着环境中NH3浓度的增加而逐渐升高。本研究也得到了相同的结论,环境NH3浓度极显著影响肉仔鸡血氨水平,且发现随着入舱时间的延长,肉仔鸡血氨水平呈上升趋势。同时,本试验还发现随着环境RH增加,肉仔鸡血氨水平呈上升趋势。可能是由于NH3极易溶于水,高 RH时空气中溶有更多的NH3,造成更多的NH3被吸入动物机体,这可能解释了本研究结果随RH增加动物机体血氨水平升高的现象。当血氨超过正常水平时,会影响脑神经细胞和肌肉细胞的新陈代谢,使家禽出现氨中毒现象,抑制采食中枢。同时,血氨水平升高会加剧机体相关器官如肝、脑、肌肉等对氨的解毒,而这是一个高度耗能的过程。因此,用于生长和生产的能量相应减少,使动物的生长性能受到影响,这能在一定程度上解释了高NH3浓度降低肉鸡生长性能研究结果[12]的原因。数据统计分析显示,RH和NH3浓度对肉仔鸡血氨水平的影响无互作效应,但随着RH的升高,血氨水平有升高的趋势。
细胞因子是一类主要由免疫细胞和相关细胞产生的高活性、多功能小分子蛋白质或多肽,它与免疫细胞分化发育、免疫调节、炎症反应有关。研究表明,应激能改变免疫细胞的功能,持续改变细胞因子的产生[13-15]。促炎细胞因子白细胞介素1(IL-1)、IL-6是主要由单核-巨噬细胞及Th1产生,可提高机体免疫机能,但产生过多又可促进炎症反应,造成组织损伤,是应激性损伤的直接介导物。研究发现,在缺氧、缺血及应激状态下,IL-1和IL-6表现为明显的上行调节和持续的分泌增多[13,16-17]。IL-1 有 IL-1α、IL-1β 和 IL-1γ 3 种活性形式,IL-1β是血浆和组织液中的主要分泌形式。IL-1β还可以协同其他细胞因子促进B细胞、T细胞活化,而且能诱导其他炎症产物的生成。慢性应激时交感神经及肾素-血管紧张素系统的激活导致去甲肾上腺素和平滑肌细胞表达IL-6增加,从而引起IL-6含量升高。本试验也得到了一致的结论:高NH3浓度对入舱1、3周肉仔鸡血清IL-1β含量影响分别接近显著和显著;低湿(35%RH)或高湿(85%RH)有升高肉仔鸡血清IL-1β和IL-6含量的趋势,高湿显著提高入舱3周IL-1β含量。随RH和NH3应激时间的延长,IL-1β和IL-6表现为持续分泌增多。
抗炎细胞因子IL-4和IL-10是由Th2细胞产生,为重要的内源性抗炎细胞因子,可减轻组织炎症反应。IL-4是由T细胞、肥大细胞、活化的成纤维细胞和嗜碱性粒细胞等产生的一种多功能抗炎症细胞因子。IL-10又称细胞因子合成抑制因子,是体内重要的抗炎性细胞因子和免疫抑制因子[18]。本试验中,入舱2周时,各处理鸡血清IL-4、IL-10含量呈现增加趋势,表明肉仔鸡随着RH和NH3应激时间的延长,机体组织产生炎症反应,刺激产生更多的抗炎性细胞因子IL-4、IL-10以减轻组织炎症反应,与机体处于免疫抑制状态时表现为Th2类细胞因子产生方式结论一致,机体免疫力降低。而入舱3周时,除70 mg/kg NH3+85%RH处理外,其他各处理IL-4和IL-10含量下降,但仍高于入舱1周时IL-4和IL-10含量,表明随着应激时间的延长,机体产生了一定的适应不良环境的能力,对机体的免疫抑制效应降低。RH和NH3浓度对入舱1周血清IL-4含量互作效应接近显著,而对入舱3周血清IL-10含量互作效应影响显著。35%RH或85%RH加重了高NH3浓度对机体的不良影响。
有研究报道,各种不同的应激因素能诱导IL-1β和IL-6等促炎细胞因子的分泌[13]。也有研究发现,大鼠给予心理社会应激后,白细胞介素2(IL-2)、IL-6和白细胞介素8(IL-8)含量皆显著降低[19]。但也有研究认为应激不一定引起细胞因子的含量升高[6]。不同研究报道结论有差异,可能与应激刺激的性质、强度、持续时间、应激时间的选择及动物的品种、年龄等有关。本试验结果免疫相关细胞因子的动态变化显示了应激对机体免疫功能影响的复杂性。
4 结论
①高NH3浓度显著增加肉仔鸡血氨水平;随RH增加,血氨水平呈上升趋势。70 mg/kg NH3+85%RH应激显著增加肉仔鸡血氨水平。
②禽舍低或高RH及NH3损害了肉仔鸡免疫机能。随着应激时间的延长,机体获得一定的适应不良环境的能力,对机体的免疫抑制效应具有降低趋势,但70 mg/kg NH3+85%RH长时间慢性应激对肉仔鸡的免疫抑制作用不可缓解。
[1]LAWRENCE D A,KIM D.Central/peripheral nervous system and immune responses[J].Toxicology,2000,142(3):189-201.
[2]PADGETT D A,GLASER R.How stress influences the immune response[J].Trends in Immunology,2003,24(8):444-448.
[3]CARLILE F S.Ammonia in poultry houses:a literature review [J].World’s Poultry Science Journal,1984,40(2):99-113.
[4]YAHAV S.Relative humidity at moderate ambient temperatures:its effect on male broiler chickens and turkeys[J].British Poultry Science,2000,41(1):94-100.
[5]STEPTOE A,HAMER M,CHIDA Y.The effects of acute psychological stress on circulating inflammatory factors in humans:a review and meta-analysis[J].Brain,Behavior and Immunity,2007,21(7):901-912.
[6]MAIER SF,WATKINS L R.Cytokines for psychologists:implications of bidirectional immune-to-brain communication for understanding behavior,mood,and cognition[J].Psychological Review,1998,105(1):83-107.
[7]WONG C W,SMITH S E,THONG Y H,et al.Effects of exercise stress on various immune functions in horses[J].American Journal of Veterinary Research,1992,53(8):1414-1417.
[8]LACEY R E,REDWINE J S,PARNELL C B.Particulate matter and ammonia emission factors for tunnelventilated broiler production houses in the southern U.S.[J].Transactions of the ASAE-American Society of Agricultural,2003,46(4):1203-1214.
[9]ULLMAN J L.Remedial activities to reduce atmospheric pollutants from animal feeding operations[J].Agricultural Engineering International:The CIGR Ejournal of Scientific Research and Development,2005,7(9):1-40.
[10]MUKHTAR S,ROSE A J,CAPAREDA S C,et al.Assessment of ammonia adsorption onto Teflon and LDPE tubing used in pollutant stream conveyance[J].Agricultural Engineering International:The CIGR Journal of Scientific Research and Development,2003,5:1-13.
[11]宋弋.氨气对肉鸡的危害及减氨技术研究[D].硕士学位论文.北京:中国农业大学,2006:15-16.
[12]WEI F X,XU B,LI SY,et al.The effect of ammonia and humidity in poultry houses on intestinal morphology and function of broilers[J].Journal of Animal and Veterinary Advances,2012,11(19):3641-3646.
[13]APPELS A,BÄR F W,BÄR J,et al.Inflammation,depressive symptomtology,and coronary artery disease[J].Psychosomatic Medicine,2000,62(5):601-605.
[14]STEVENSON L S,MCCULLOUGH K,VINCENT I,et al.Cytokine and C-reactive protein profiles induced by porcine circovirus type 2 experimental infection in 3-week-old piglets[J].Viral Immunology,2006,19(2):189-195.
[15]MEAGHER M W,JOHNSON R R,YOUNG E E,et al.Interleukin-6 as a mechanism for the adverse effects of social stress on acute Theiler’s virus infection[J].Brain,Behavior and Immunity,2007,21(8):1083-1095.
[16]HARTMANN G,TSCHÖP M,FISCHER R,et al.High altitude increases circulating interleukin-6,interleukin-1 receptor antagonist and c-reactive protein[J].Cytokine,2000,12(3):246-252.
[17]KARAKURUM M,SHREENIWAS R,CHEN L,et al.Hypoxic induction of interleukin-8 gene expression in human endothelial cells[J].Journal of Clinical Investigation,1994,93(4):1564-1570.
[18]MOORE K W,O'GARRA A,DE MALEFYT R W,et al.Interleukin-10[J].Annual Review of Immunology,1993,11(1):165-190.
[19]马文涛,杨来启,林玉梅,等.应激对大鼠血清皮质醇及白细胞介素2、6、8水平的影响[J].中国心理卫生杂志,2002,16(1):14-15.

