孕产期易栓症与肺栓塞的诊治
王谢桐,李善玲
(山东大学附属省立医院妇产科,山东 济南 250021)
妊娠结局不良的妇女许多具有血栓形成倾向,这种因持续高血凝状态而导致的血栓形成风险增加称为易栓症(thrombophilia),也称为血栓前状态。这种血栓前状态不一定发生血栓性疾病,但可能选择性影响子宫胎盘循环而导致胎盘的微血栓形成[1]。这些不良结局妊娠包括子痫前期、胎盘早剥、胎儿生长迟缓、死胎及复发性流产。有易栓症的孕产妇也容易发生大的静脉血栓,多见于下肢及盆腔,栓子脱落堵塞肺动脉或其所属分支而引起肺循环障碍所发生的临床和病理生理综合征称为肺栓塞,是孕产妇死亡的重要的非产科因素之一,在发达国家是孕产妇死亡的首要原因,在我国的许多省份,产科出血不再是孕产妇死亡的首要原因,肺栓塞的发生率逐年升高。美国1987~1990年1459例孕产妇死亡中,肺栓塞占20%。在发达国家,产科出血所导致的孕产妇死亡显著下降,围产期静脉血栓(venous thrombo embolism,VTE)是孕产妇死亡主要原因
1 易栓症
易栓症的发病因素可以分为遗传性和获得性。遗传性因素所致的凝血功能异常增强和纤溶功能的降低与凝血因子基因突变所致的蛋白表达异常有关。几种易栓症的基因突变,包括因子V Leiden突变、亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)基因 C677T突变、凝血酶原(因子Ⅱ)基因G20210A突变;其他的如异常纤维蛋白原血症、蛋白S(proteicn S,PS)缺乏,蛋白C(protein C,PC)缺乏,抗凝血酶缺乏等。获得性因素包括:抗磷脂综合征(antiphospholipid syndrome,APLS)、阵发性睡眠性血红蛋白尿、骨髓增生性疾病、恶性肿瘤,以抗磷脂综合征较多见。这些异常导致凝血-纤溶平衡发生偏移,使凝血功能相对增强,引起胎盘小血栓的形成[2]、绒毛梗塞及蜕膜血管纤维素样坏死,导致胎盘灌注量的下降,从而引发严重的并发症。
1.1 遗传性易栓症
1.1.1 活化蛋白C抵抗(activated protein C resistance,APCR)与凝血因子V(FV)Leiden突变 1993年Dahlhack等首次对APCR进行描述。在健康人血中加入外源性 APC后,部分凝血活酶时间(APTT)延长,因为活化的FV(FVa)及活化的FⅧa(FⅧa)被APC所灭活;某些病人的APTT并不能因为加入APC而延长,证明有一种APC抵抗现象存在。FV基因定位于染色体1q21~25,长度为80kb,包含了25个外显子。1994年,Bertina证实95%的活化蛋白C抵抗是由于FV基因第1691位核苷酸发生G-A错义突变,即Leiden突变,使FV氨基酸序列第506位的精氨酸(Arg)被谷胺酰胺(Gln)取代,而Arg 506正是APC催化活化的FVa失活的第一酶切位点,导致FVa不易被裂解失活。突变后的FVa一方面能继续表达促凝活性,另一方面却对APC的裂解作用大大降低,从而产生APCR现象,表现为高凝状态,易形成血栓。FVLeiden(FVL)为常染色体显性遗传,分为杂合型和纯合型两种表现型。APC灭活FVa还有其他两个酶切位点Arg306和Arg679。Arg306被甘氨酸(Gly)取代,命名为FVCambridge突变,该突变可能与APCR的发生无关。对FVArg679位的检测则没有发现突变。导致遗传性APCR的主要因素为FVL。FVL在白种人中发生率为5% ~22%[3],在静脉血栓患者中的发生率为20%~40%,而在妊娠期血栓病患者中的发生率为60%,也是与应用口服避孕药相关的血栓发病的主要原因,在亚洲人群中罕有发生。FVL在不良结局妊娠中的发生率增加。Kupferminc等[2]对110例曾有重度妊高征、胎盘早剥、胎儿生长迟缓和不明原因死胎的犹太妇女进行了 FVL检测,22例(20%)有Arg 506-Gln的突变,而在至少有过一次正常妊娠的110例犹太妇女中仅有7例(6%)。Ogunyemi等[1]在一项不限定种族的研究中,发现并发症组的FVL突变率为10%(7/75),正常组为2%(1/66)。徐勇等报道在中国妇女中,复发性流产与APCR和3种FV的基因多态性没有关联。在国人静脉血栓患者和健康献血者研究中没有发现FⅤL突变。
此外APCR可由其他原因引起,如APLS患者,获得性APCR是诱发血栓形成的重要原因,可能通过对蛋白C、蛋白S、血栓调节因子或血小板磷脂系统的作用导致了APCR现象。
1.1.2 凝血酶原G20210A突变 凝血酶原,即凝血因子II,是一种维生素K依赖性蛋白,分子量为72 kD,由579个氨基酸残基组成。凝血酶原基因定位于11p11~q12,全长21 kb,包含有14个外显子和13个内含子。1996年,Poort发现凝血酶原基因的3'端非翻译区20210位核苷酸的G-A突变可增加血浆凝血酶原水平及静脉血栓栓塞性疾病的发病风险,其可能与mRNA的稳定性增加和翻译效率的提高有关。该基因的杂合子携带者的凝血酶原水平比正常人高30%。该突变在正常妊娠期妇女中的发生率为1%~3%,在不良结局妊娠妇女中的发生率为10%左右,与原因不明反复性流早产 (unexplained recurrent pregnancy loss,URPL)、子痫前期、胎盘早剥和胎儿生长迟缓的发生有关[2],在非高加索人群中罕见。在国人静脉血栓患者和健康献血者研究中也没有发现凝血酶原G20210A突变。
1.1.3 亚甲基四氢叶酸还原酶基因C677T突变和高同型半胱氨酸血症 同型半胱氨酸(homocystein,Hcy)是蛋氨酸代谢的中间产物。Hcy具有细胞毒性,Hcy血症造成内皮损伤和功能异常、剌激血管平滑肌细胞增生、破坏机体凝血和纤溶系统、影响脂质代谢等,使机体处于血栓前状态;还可以引起胎儿DNA损伤及细胞凋亡而导致畸形。人体摄入的叶酸,在N-5,10-亚甲基四氢叶酸还原酶(MTHFR)的作用下,生成5-甲基-四氢叶酸,这个过程需要维生素B2参与,N5-甲基-四氢叶酸,是体内主要的甲基供体;Hcy在蛋氨酸合成酶的催化下,以维生素B12为辅酶,与5-甲基-四氢叶酸脱下的甲基结合,生成了没有毒性的蛋氨酸。当维生素B12缺乏时,蛋氨酸循环受到破坏,同型半胱氨酸浓度也会升高。MTHFR的缺乏或功能异常、维生素B2缺乏时,使得5-甲基-四氢叶酸脱甲基减少,而不能为降解Hcy提供必要的甲基;Hcy代谢的另外一条途径是在酶的催化下,以维生素B6为辅酶,经过一系列反应生成无毒的半胱氨酸。因此当人体维生素B6缺乏时,Hcy浓度也会升高。
1994年,Goyette将 MTHFR 定位于 1p36.3,其cDNA全长2.2 kb。1995年,Frosst首次发现位于MTHFR催化区域的第677位核苷酸可发生C-T突变并使其编码的丙氨酸被缬氨酸取代,该突变直接影响MTHFR的活性和耐热性,导致其活性和耐热性下降。MTHFR C677T的突变频率在不同地区和民族中有显著差异:欧洲为24% ~40%,非洲为4.9% ~9.1%,亚洲为2.5% ~33%,我国汉族和5个少数民族中等位基因频率为17% ~47%[4]。获得性高同型半胱氨酸血症最常见的原因是食物中缺乏Hcy代谢中必需的辅因子,如叶酸、维生素B2、B6、B12。慢性肾功能不全及干扰叶酸或维生素B12代谢的化合物(如MTX、抗惊厥药和笑气)也能导致轻中度高同型半胱氨酸血症。
1.1.4 PC缺乏、PS缺乏 PC和PS均属于在肝脏合成的维生素K依赖性糖蛋白。PC分子量为62 kD,血浆浓度为3~5μg/ml,半衰期为6~8小时。人类蛋白C基因定位于染色体2q13~q14,长11 kb,包含有9个外显子。其突变包括插入/缺失、错义突变、点突变,可导致蛋白合成的提前终止或影响蛋白空间折叠而降低了其稳定性,遗传方式是常染色体显性。PC是无活性的酶原,当被内皮细胞表面的凝血酶和血栓调节蛋白复合体激活后成为活性PC(APC),使PC的活化增加20000倍。在9648例献血者中,PC缺乏的发生率为1/700~1/500,分两型:I型为PC数量缺乏;II型为PC数量正常,但功能缺陷。
PS分子量为69 kD,血浆浓度为20~25μg/ml,半衰期为42小时。PS基因包括活性α基因和非表达的 β 假基因,前者位于3p11.1~3q11.2,长80 kb,包含有15个外显子;后者在α基因旁边。遗传方式及分型同PC。
APC可以灭活FVa和FⅧa,PS可增加APC与带负电荷的磷脂间的亲和力,形成APC-PS复合物,减少FVa和FⅧa与血小板膜的结合,从而抑制凝血过程。PC或PS缺乏者在妊娠期及产褥期血栓的发病率是10%~19%,在正常妊娠和妊娠并发症中PC或PS缺乏的发生率分别为1%和7%。不良结局妊娠的发生与PC或PS缺乏有关[5]
1.1.5 抗凝血酶(Antithrombin,AT)缺乏 AT是一种单链糖蛋白,分子量约为60 kD,由432个氨基酸残端和4个寡糖链组成。在肝细胞内合成,血浆浓度约为125μg/ml(2.3μmol/L),半衰期为 65小时。人类编码AT的基因由7个外显子构成,基因组DNA全长14 kb,定位于1q23~25,内含子顺序中含有约22%的Alu顺序,导致AT缺乏的基因突变有80余种,包括点突变、基因插入或缺失突变,绝大多数为常染色体显性遗传。AT属于丝氨酸蛋白酶抑制物超家族,是凝血酶的主要抑制物,也能抑制其他丝氨酸蛋白酶如 FⅨa、FⅩa、FⅪa、FⅫa,该过程能被肝素大大促进(为原来的40000倍)。AT缺乏分2型:I型为血浆中AT含量及活性降低;II型为血浆中AT含量正常,凝血酶抑制位点或肝素结合位点异常导致功能下降。肝素结合位点异常的致血栓风险较凝血酶抑制位点小。正常人群中AT缺乏的发生率是0.02%,静脉血栓患者中的发生率是0.5% ~1%,提示AT缺乏者患静脉血栓的风险增加50倍。妊高征患者的血浆AT水平呈继发性降低。AT缺乏与妊娠期及产褥期显著的易栓倾向相关,AT缺乏的妇女中多达70%在此期间有血栓形成,且流产及死胎的发病风险均明显升高。
1.2 获得性易栓症:APLS 抗磷脂抗体(APA)是能与带负电荷的磷脂或磷脂-蛋白复合物反应的免疫球蛋白家族,包括抗磷脂酰丝氨酸、抗磷脂酰肌醇、抗磷脂酰胆碱、抗磷脂酰乙醇胺及梅毒反应素等,其中研究最多的是抗心磷脂抗体(anticardiolipin antibody,ACL) 和狼疮抗凝物(lupus anticoagulant,LAC),而二者常合并存在。
ACL与血管内皮细胞的磷脂成分结合,损伤内皮细胞,阻止内皮细胞释放花生四烯酸,从而PGI2合成减少,引起血管收缩及血小板聚集。内皮损伤使血小板黏附、聚集、释放血栓素A2使血管收缩、血管内血栓形成。ACL是抗磷脂抗体中最重要的一种,阴离子的磷脂没有抗原性,然而与其辅助作用蛋白如β2-GP-1结合可成为易识别和稳定的抗原。抗心磷脂抗体的测定可受某些感染性疾病和药物的干扰而产生假阳性结果,直接测定抗β2-GP-1抗体可避免抗心磷脂抗体测定中的不足。在APL抗体阳性的孕妇中,由于滋养层细胞未能充分侵入子宫螺旋动脉,致使胎盘循环异常,胎盘小于相同孕周平均值,胎盘活检也证实子宫螺旋动脉粥样硬化显著,却不一定有胎盘梗塞。
LAC因在SLE患者中发现而得名,LAC在体内是增进血栓,在体外具有明显的抗凝活性,可以用白陶土凝固时间、aPTT、Russell蝰蛇毒稀释试验进行检测。LAC抑制内皮细胞产生PGI2,而使血栓素的产生增加,还可影响前血管增渗素的产生,减少纤维蛋白的分解作用,使PC、PS和ATIII活性出现获得性缺陷,从而促进凝血作用。LAC通过识别脂结合凝血酶原来影响凝血反应,阻断活化的凝血因子V与凝血酶原作用,从而抑制纤维蛋白的形成,致使凝血时间延长。未经治疗的LAC抗体阳性的孕妇其自发性流产和死胎的发生率可高达95%;LAC抗体与产科其他的并发症也有关,如胎儿生长迟缓、早发型妊高征和妊娠期舞蹈病。胎儿丢失的发生率与抗体的滴定度有关,尤与IgG抗体关系密切[6]。抗磷脂抗体综合征的诊断标准见表1[6]。

表1 抗磷脂抗体综合征的主要诊断标准
1.3 易栓症的筛查与妊娠期管理 妊娠期全面筛查易栓症在临床上是不合理的[7],如果所有不良妊娠结局的妇女都筛查易栓症,如结果阳性,临床如何根据这一信息进行处理?筛查的目的是确定是否需要抗凝,然而只有很少的随机研究证明不良妊娠结局的易栓症妇女的治疗是有益的,尤其是有子痫前期病史的妇女。最多的推荐易栓症筛查是前次严重的早发子痫前期,最近出版的美国胸科医生学会的指南推荐在重度/复发性/严重胎儿生长受限(FGR)中筛查APA,但不筛查遗传性易栓症。APA阳性的妇女应接受预防性或中等剂量的肝素或预防剂量的低分子肝素结合小剂量阿司匹林,妊娠和血栓症工作组赞成在34周前的重度子痫前期和HELLP中全面筛查易栓症,如果前次妊娠是小于30周的重度子痫前期或FGR,有遗传性易栓症(杂合子FVL或FⅡ基因),在以后的妊娠中应该给小剂量肝素,与孕妇及家属直接讨论(孕前咨询时)药物的利弊以及肝素在这种情况下治疗的尚未证实的效果是恰当的,就此而论,LMWH的潜在益处、风险和花费必须进行权衡,大的前瞻性研究急需确定预防策略的利弊
易栓症筛查指标包括[8]:PC(功能分析)、PS(功能分析)、抗凝血酶 III(功能分析)、因子V Leiden突变 (PCR,国人不查)、凝血酶原20210A突变 (PCR,国人不查),抗心磷脂抗体 (IgG,IgM),抗 β2-GP 抗体(IgG,IgM)、狼疮抗凝物(APTT,DRVVT)和血小板计数。易栓症的补充筛查项目有:Hcy、活化蛋白C抵抗及MTHFR C677T突变凝血因子VII、VIII、IX、XI的评估。
2 肺栓塞(pulm onary em bolism,PE)
妊娠期血液高凝状态是分娩的生理准备,但血液高凝状态使VTE的危险性增加。VTE存在两种临床表现深静脉血栓形成(deep vein thrombosis,DVT)和PE,两者的病因、治疗及临床结局密切相关。在确诊PE的患者中,70% ~90%也存在DVT。肺栓塞易漏诊及误诊,未经治疗死亡率高达20% ~30%,明确诊疗者死亡率明显下降至2% ~8% 。
2.1 流行病学 在发达国家,产科出血导致的风险已被现代产科技术所降低,VTE塞已成为孕产妇死亡的主要原因。从妊娠至分娩的产前时段孕妇静脉血栓的发病率估计为5~12人/万次妊娠,是年龄相配对照组的7~10倍,妊娠早中晚期的发病率相似。妊娠相关的DVT比PE高三倍。妊娠相关的深静脉栓塞左侧占85%,左侧易发的机制是左髂静脉受右髂动脉和妊娠子宫压迫所致。另外,在妊娠期,孤立的盆腔深静脉血栓更常见,53例DVT孕产妇中6例(11%)为孤立性盆腔静脉血栓,而一个多中心前瞻登记的5451例DVT中17例(1%)是盆腔的。产后(分娩至产后六周)VTE的发生率是3~7次/万次分娩,是年龄相配的对照组的15~35倍;美国VTE死亡率1.1/10万分娩,占孕产妇死亡的10%,既往有VTE病史的妇女,复发率可高达12%。产褥期后,母体的促凝状态逐渐恢复至非妊娠状态,其标志是各项凝血活性的指标回到妊娠前的浓度,VTE的风险逐渐降低,产后6周降至非妊娠水平[9]。
2.2 发病机制 下肢深静脉血栓形成可以起源于小腿的细小静脉,也可起源于股静脉、髂静脉的粗大静脉,血栓的蔓延可沿静脉血流方向,向近心端伸延,如小腿的血栓可以继续伸延至股静脉、髂静脉甚至下腔静脉。当血栓完全阻塞静脉主干后,也可以逆向伸延,如髂静脉血栓可以向远端延伸至小腿部位。血栓的碎块有可能脱落,随血流进入心脏。妊娠期高凝状态、静脉淤滞和血管损伤是经典的三联好发因素,又称魏克氏三特征(Virchow's triad)学说。
2.2.1 高凝状态 在妊娠期,凝血系统进行性激活为分娩期出血做准备,PS的抗凝活性减低,发生活化蛋白C抵抗,通过纤维蛋白原和因子V、IX、X和VIII增加促进了凝血功能,增强了血栓形成能力。凝血酶-抗凝血酶复合体浓度增加、可溶性纤维蛋白、凝血酶原片段F1和2,纤溶降低使血栓溶解减慢,纤溶酶原激活物抑制物-1(PAI-1)和2的活性增加和组织纤溶酶原激活物活性降低导致了这一结果,产前或产后静脉血栓的危险因素已经确定,这些危险因素对妊娠VTE有因果关系。肥胖与妊娠期和非妊娠期VTE相关,但这种关系的机制尚不清楚,这可能与纤维蛋白原和PAI-1的升高有关,或者是干扰了糖或脂代谢而影响了凝血和止血系统,辅助生育技术的患者上肢DVT的风险升高,富含雌激素的腹水进入胸导管可能活化凝血系统,降低了血栓调节素的活性,影响了内皮细胞的抗血栓能力而导致DVT。近来认为主要是增加纤外受精(IVF)后早期妊娠的风险[10]。
2.2.2 静脉淤滞 出现在早孕期,在妊娠36周达高峰。增大子宫压迫髂静脉及下腔静脉,使静脉回流发生障碍,血流淤积,引起血管内皮细胞受损;左髂总静脉被夹在右髂总动脉和骶骨岬之间,容易使左髂总静脉长期处于前后壁接触状态,使左髂静脉回流受阻,还可形成静脉腔内粘连,因此妊娠期左下肢静脉血栓发生率高于右下肢;左侧卵巢静脉回流至左肾静脉,左侧盆腔静脉曲张较多见。文献报道在尸体解剖中观察到左髂总静脉内有粘连者高达55.6%。孕酮可使静脉平滑肌松弛,血流缓慢,下肢静脉发生瘀血,增加了深静脉血栓形成的可能性。
2.2.3 血管损伤 由于正常阴道分娩或手术产所导致的盆腔血管的损伤。
2.3 围产期静脉血栓危险因素 血栓形成病史:是妊娠期VTE最重要的危险因素,妊娠期复发率15%~25%,妊娠期VTE复发风险增加3~4倍[RR 3.5(95%CI:1.6 ~ 7.8)]。易栓症是业已存在的危险因素,围产期VTE 20% ~50%有易栓症。现有的危险因素包括年龄>35岁、肥胖(孕前或早孕BMI>30 kg/㎡)、产次 >4次、静脉曲张、截瘫、镰状细胞病、炎性疾病如炎症性肠病、肾病综合症、心脏病、骨髓增生性疾病等;暂时性危险因素包括妊娠或产褥期手术(剖宫产、吸宫术、后绝育术)、妊娠剧吐、脱水、卵巢过度刺激综合征、严重感染如肾盂肾炎、制动(卧床>4天)、子痫前期、失血过多、长途旅行、产程延长、手术器械助产、产后活动少。相关危险因素的 OR 值见表 2[9]。
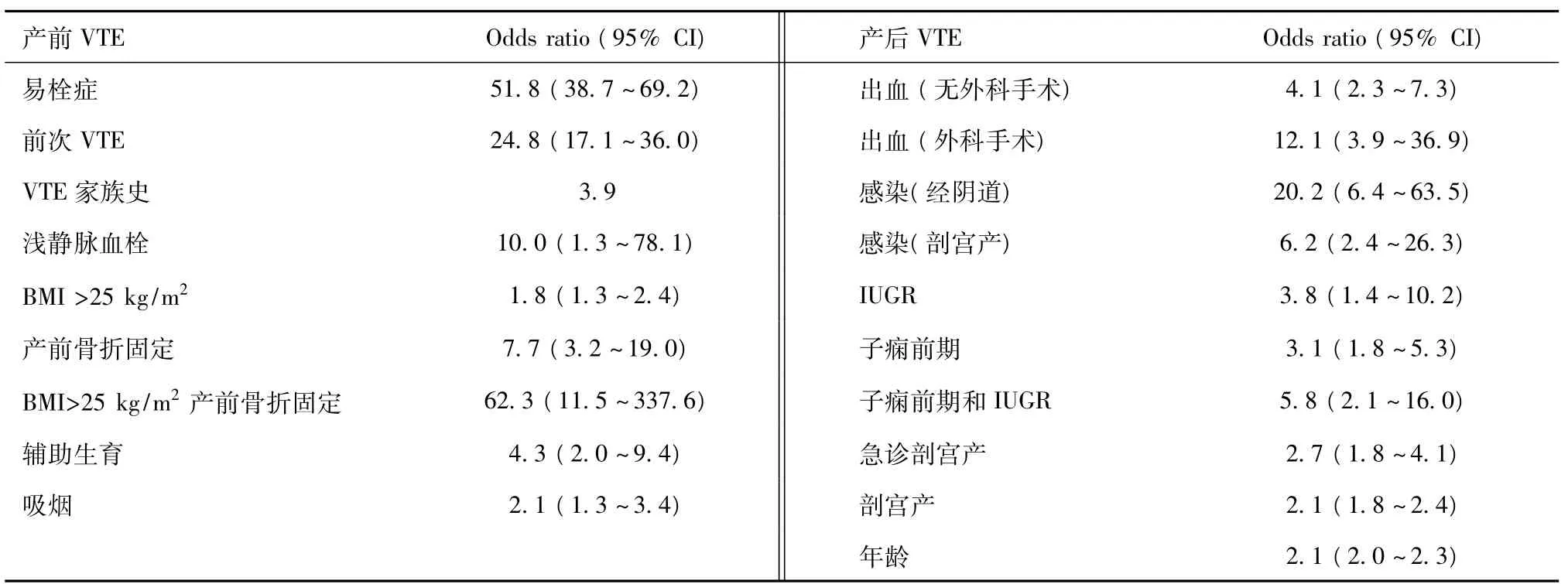
表2 产前和产后VTE危险因素
2.4 VTE病理生理及临床表现
2.4.1 DVT 静脉血栓形成后,远侧静脉压力升高,处于明显的郁血状态,毛细血管的渗透压升高,血管内皮细胞内缺氧而渗透性增加,血管内液体成分向外渗出,移向组织间隙,往往造成肢体肿胀。有红细胞渗出于血管外,其代谢产物含铁血黄素,形成皮肤色素沉着。在静脉血栓形成时,会引起淋巴淤滞、回流障碍,加重肢体的肿胀。DVT临床表现:在急性期,发病急骤,患肢胀痛或剧痛,股三角区或小腿有明显压痛;患肢广泛性肿胀,患肢皮肤呈暗红色,温度升高;患肢广泛性浅静脉怒张;Homans征、Neuhof征阳性。腓肠肌牵拉实验(Homans征):将足向背侧急剧弯曲时,可引起小腿肌肉深部疼痛。小腿深静脉血栓时,此征常为阳性。这是由于腓肠肌及比目鱼肌被动伸长时,刺激小腿血栓静脉而引起。压痛(Neuhof征):静脉血栓部位常有压痛。因此,下肢应检查小腿肌肉、腘窝、内收肌管及腹股沟下方股静脉。DVT慢性期(深静脉血栓形成后综合征)由于下肢静脉回流障碍和后期静脉血液逆流,浅静脉怒张和曲张,活动后肢体凹陷性肿胀、胀痛;出现营养障碍改变,皮肤色素沉着,淤血性皮炎,淤血性溃疡。
根据静脉血栓的部位不同,DVT可出现各种不同的临床表现,分为三种类型。周围型:血栓位于腘静脉以下,手术后最易发生血栓的部位,但因症状轻微,容易漏诊。小腿肌肉静脉丛血栓形成也属周围型。中心型:髂股静脉血栓形成,血栓脱落可导致肺动脉栓塞,威胁患者生命。混合型:全下肢深静脉内均有血栓形成,由周围型或中央型扩展而来。
50%的DVT患者可以无症状。DVT的检测方法有彩色多普勒血管超声,为首选的检查方法;下肢静脉造影,最准确,可以定位确定范围及侧支循环建立情况;电阻抗静脉图像法通过下肢血容量改变引起电阻改变,测定静脉血流情况,如静脉回流受阻,静脉容量及最大静脉回流量下降,对膝以上血流量的变化敏感性较高。超声诊断可疑或超声阴性但临床高度怀疑时可做MRI,从解剖上能清楚地看到腹股沟韧带上的部位,可诊断有无盆腔静脉血栓。
2.4.2 PE
2.4.2.1 病理生理 肺动脉被栓子堵塞后,无血液灌注的肺泡不能进行有效的气体交换,使肺泡死腔变大,栓塞区域出现通气-灌注失常,发生低氧血症;栓子在肺血管内可引起各种血管活性物质如5-羟色胺、组织胺、缓激肽等的释放,刺激肺泡壁上的受体,导致呼吸困难、心率快、咳嗽、支气管及血管痉挛,血管通透性增加,气道阻力增高,通气受限,损伤肺功能。神经体液因素除引起肺动脉收缩外,还可引起冠状动脉、体循环血管的收缩,导致呼吸、心脏骤停;肺泡表面活性物质减少,出现充血性肺不张,可引起咯血。
2.4.2.2 PE临床表现 主要取决于栓子栓塞的部位及栓子的大小。主要表现有呼吸过快(89%)、气短(81%)、胸痛(72%)、不安(59%)、咳嗽(54%)、心动过速(43%)和咯血(34%)。呼吸困难、胸痛和咯血是PE的三联症,但PE的症状和体征都是非特异性的,临床有典型肺梗死三联症的患者不足1/3。血管床有50%被阻塞时,可出现肺动脉高压。栓塞前如有严重的心肺疾患,对PE的耐受性差,肺动脉高压的程度会更为严重。神经体液因素除引起肺动脉收缩外,还可引起冠状动脉、体循环血管的收缩,导致呼吸、心脏骤停。70% ~95%PE的栓子来自下肢深静脉血栓,近40%的有DVT的无症状患者伴有PE。来自盆腔静脉血栓的妇女常无症状,直至PE的症状发生。少数栓子来自于右心或其它部位。多发生于产后,但产前也常见。发生于产后者死亡率更高。
2.4.2.3 辅助检查 包括血气分析、胸部X射线、心电图、经胸与食管二维超声心动图、肺动脉造影和血浆D-Dimer。美国胸科学会强烈推荐进行了三个具体方案:X射线胸片是首选的辐射相关检查;X射线胸片正常时选择肺闪烁显像;在孕妇用CT肺动脉造影(CTPA),而不是数字减影血管造影(DSA)[11]。
血浆D-二聚体对于诊断血栓性疾病的敏感性为98%,但特异性约为30%。血浆D-二聚体是纤维蛋白单体经活化因子Ⅷ交联后,再经纤溶酶水解所产生的一种特异性降解产物,只要机体血管内有活化的血栓形成及纤维溶解活动,D-二聚体就会升高。由于PE患者D-二聚体水平持续增高,时间一般在1周以上,如果小于500 ng/ml可排除PE。
2.4.2.4 诊断 重要的是提高对 PE的认识。有典型征象的PE患者不多,心电图和胸部X射线改变常是一过性的。患者通常仅有一、两个提示可能有PE的症状,如突发“原因不明”的气短,特别是劳力性呼吸困难,当伴有一侧下肢肿胀、疼痛者更需考虑有PE的可能。及时请呼吸科会诊,根据病情进行相应的辅助检查。重症PE发病急骤,死亡者80%在发病后2小时以内,因此对PE的治疗抢救必须争分夺秒。急救处理措施包括稳定患者血流动力学不稳定状态,治疗已发生的栓塞和防止血栓栓塞的再发生。
2.4.2.5 治疗[12]妊娠期 VTE的发生有若干的高危因素,一旦发生VTE,必须尽快进行治疗,从而降低与之相关的PE病死率以及DVT的扩展、栓塞后腿部综合征的发生率。预防性治疗比VTE发生后再进行治疗更能降低该病的发病率及死亡率。①一般处理:包括严密监测生命体征,保持安静,绝对卧床2~3周,保持大便通畅,应用抗生素预防并发感染;记录24小时出入量;吸氧,鼻导管或面罩,氧浓度以维持PaO2在70~100 mmHg为宜;留置中心静脉导管输入胶体液或晶体液扩容。监测心排血量、肺动脉压,必要时插漂浮导管。应用多巴胺、多巴酚丁胺或去甲肾上腺素,维持MAP>80 mmHg,尿量>50ml/h。对症治疗:对于严重胸痛者可给与止痛药物吗啡或盐酸哌替啶。阿托品或654-2、氨茶碱解除支气管痉挛,有心力衰竭用西地兰强心治疗。应用肾上腺皮质激素。控制心律失常。②溶栓治疗:对有些危重患者,根据临床情况作出诊断后就开始溶栓治疗,不宜等待核素扫描和肺动脉造影结果。主要用于2周内的新鲜血栓栓塞,愈早愈好。溶栓疗法出血发生率为5% ~7%,致死者约1%。溶栓治疗可迅速溶解血栓,恢复肺组织再灌注和逆转右心衰竭,增加肺毛细血管血容量及降低病死率和复发率。指征为:大块肺栓塞;PE伴休克;原有心肺疾病的次大块肺栓塞引起循环衰竭者。溶栓治疗绝对禁忌证:活动性胃肠道出血,两个月内的颅内出血,颅、脊柱术后。相对禁忌证:10天内外科大手术、分娩,近期严重胃肠道出血,肝肾功能衰竭,严重创伤及高血压患者收缩压>200 mmHg,舒张压>110 mm-Hg。FDA批准的溶栓方案:链激酶(SK)负荷量25万U/30min,继10万U/h,维持24小时静脉滴注。链激酶分子量高不通过胎盘,是常用溶栓剂。尿激酶(UK)负荷量 2000 U/(0.454 kg·10 min),继2000 U/0.454(kg·h),维持12~24小时静脉滴注。重组组织型纤溶酶原激活物(rtPA)100 mg/2 h,静脉滴注。用药前后测定血小板、凝血时间、凝血酶原时间、部分凝血活酶时间。严重出血时可用氨基己酸对抗。③抗凝治疗:一旦明确诊断或高度怀疑PE者,应立即开始抗凝治疗,可防止栓塞的继续发展和再发,使自身纤溶机制溶解己存在的血栓。目前常用的有肝素和华法林。但单纯抗凝的疗效及远期结果远不如与溶栓并用好。抗凝治疗1~4周,肺动脉血块完全溶解者为25%,4个月后为50%。④外科治疗:血栓切除术,在内科治疗无效或肺栓塞范围>50%时,有明显肺动脉高压和心排出量减低者,行血栓切除术治疗可及时挽救母婴的生命,该法在孕产妇PE的急救方面已取得了显著的效果。下肢深静脉栓塞的切除则阻断了大部分复发性PE的源头。在确认血栓来自下腔静脉系统后,安装下腔静脉滤器可以降低PE的危险,可从颈静脉、股静脉放置,一般放置10日取走,亦可长期放置。常规行下腔静脉造影,确定下腔静脉和释放途径静脉无血栓形成,将滤器放置于平肾静脉开口之下的下腔静脉。⑤产科处理:孕期因高凝状态,肝素用量较大,临产分娩时需停药。分娩时,抗凝治疗是否引起出血取决于肝素剂量、途径及给药的时间、切口及撕裂的程度、产后子宫收缩的强度、是否有其他凝集缺陷的存在。若近期发生PE,但又必须剖宫产时,是个严重的问题;减少肝素的用量可再栓塞,充分剂量的肝素治疗亦可发生危及生命的大出血,调整好肝素的剂量十分重要。使用肝素时需准备硫酸鱼精蛋白,防止血液凝固性增加。⑥预防:识别有血栓栓塞性疾病风险的孕妇,据其情况提供个体化的预防措施很重要。血栓栓塞倾向的筛查抗核抗体(ANA)、ACL、抗β2-GP抗体、狼疮抗凝物、抗凝血酶Ⅲ、C蛋白和蛋白S和血小板。对有心脏机械换瓣、心房纤颤、创伤、长时间卧床或手术后的妇女也要进行筛查,及时开始预防性的抗凝治疗。对已发生明显临床症状、高度怀疑PE者,需立即开始积极的抗凝治疗。防止血液凝固性增加及血管损伤,手术操作轻柔,保护暴露于手术野的血管,在手术中应及时纠正脱水,保持水、电解质平衡,减少出血量,预防术后感染。避免血流减慢术后鼓励病人深呼吸,每小时12~15次,以增加横膈肌运动,减小胸腔压力,促进血液循环。鼓励患者在床上多翻身或屈伸膝,踝、趾关节;早期下床活动,避免长时间的半卧位,不放膝垫,必要时下肢热敷促进血液循环。长期卧床者应用分级加压长筒袜或间歇性序贯充气泵。
预防性抗凝:血栓栓塞疾病的低危患者:仅有一次前次血栓栓塞性史,可用小剂量阿司匹林75mg/d或肝素5000单位每12小时皮下,确诊妊娠开始直到分娩停用。分娩后改为连续使用肝素6周或2~7天后换成华发林,连续用5周以上。血栓栓塞性疾病高危患者:有一次以上的前次血栓栓塞性史,或虽然仅有一次前次血栓栓塞性史但有血栓栓塞的家族或血栓症化验检查阳性者。肝素7500~10000U,每12小时皮下,或低分子量肝素依诺40 mg/d。确诊妊娠开始或在前次妊娠发生血栓栓塞的孕期前4~6周开始抗凝治疗,产后继续用肝素6~12周或2~7天后改用华发林。
妊娠期抗凝适应证血栓的预防性抗凝治疗目前尚有争议。对VTE进行预防性治疗的对象、时机以及方法均未统一,抗凝治疗的程度应取决于每个个体血栓形成倾向的具体高危因素。尽管VTE在妊娠期间和产后期间的风险增加,但大多数女性不需要抗凝。对可能需要妊娠期抗凝的妇女应该在受孕前评估,至少在妊娠早期。普通肝素或低分子肝素出血等并发症的风险高达2%,对于有血栓病史的妇女、获得性或遗传性易栓症且有不良妊娠结局病史的妇女预防性抗凝可能是有益的。处于血栓性死亡率高风险的妇女、机械心脏瓣膜、慢性血栓栓塞性肺动脉高压症、充分抗凝后的复发性血栓形成的历史、心肌梗死病史者应劝阻妊娠。
妊娠期VTE预防性抗凝:曾经完全抗凝的妇女经继续进行抗凝治疗,推荐在整个妊娠期及产后6~12周都进行正规的抗凝治疗,之后再重新开始既往采取的抗凝治疗。易栓症检测的结果不会改变妊娠期抗凝的建议,但可能会改变用药剂量。虽然有些专家建议对所有遗传性易栓症孕妇进行血栓预防,但如果没有血栓或不良妊娠结局史的孕妇抗凝可能没有必要。例外情况是有多个易栓因素。华法令是除妊娠外的长期抗凝首选制剂,早期妊娠对胎儿有不良影响,在器官发生的关键时期,流产风险是15% ~56%,有多达30%的先天性畸形的危险。在受孕前把华法林换成低分子量肝素。在妊娠期抗凝的首选药物是肝素类药物,肝素或低分子肝素都不穿过胎盘,妊娠期安全。肝素抗凝在妊娠期应用有特殊性,由于孕妇血容量增加40% ~50%,药物分布容积增加,肾小球滤过增加导致排泄增加,肝素结合蛋白增加,半衰期短,峰浓度低,通常需较高剂量和频繁给药。在非妊娠患者中,低分子肝素比普通肝素的副作用少,妊娠期的应用的研究较少。普通肝素可能导致出血、骨质密度减低、椎体骨折和肝素诱发的血小板减少症(HIT)的风险,而低分子肝素较少出血、HIT的风险较小、骨质流失少、但较昂贵、半衰期较长,可能影响分娩的时机。没有妊娠期使用抗凝剂的大样本试验,妊娠期抗凝剂的使用建议是根据病例研究和专家意见提出的。
[1]Ogunyemi D,Ku W,Arkel Y.The association between inherited thrombophilia,antiphospholipid antibodies and lipoprotein A levels with obstetrical complications in pregnancy[J].JThromb Thrombolysis,2002,14(2):157-162.
[2]Kupferminc MJ,Eldor A,Steinman N,etal.Increased frequency of genetic thrombophilia in women with complications of pregnancy[J].N-Engl-J-Med,1999,340(1):9-13.
[3]Rosendaal FR.Venous thrombosis:a multicausal disease[J].Lancet,1999,353:1167-1173.
[4]焦海燕,薛亚丽.亚甲基四氢叶酸还原酶基因(C677T)多态性研究进展[J].国外医学·遗传学分册,2002,25(4):207-210.
[5]Kupferminc MJ,Fait G,Many A,etal.Severe preeclampsia and high frequency of genetic thrombophilic mutations[J].Obstet-Gynecol,2000,96(1):45-49.
[6]Tan JYL.Thrombophilia in pregnancy[J].Ann Acad Med Sigapore,2002,31:328-334.
[7]Rath W.Pre-eclampsia and inherited thrombophilia:a reappraisal[J].Semin Thromb Hemost,2011,37(2):118-124.
[8]Lockwood C,Wendel G.Committee on Practice Bulletins-Obstetrics.Practice bulletin no.124:inherited thrombophilias in pregnancy[J].Obstet Gynecol,2011,118(3):730-740.
[9]Bourjeily G,Paidas M,Khalil H,etal.Pulmonary embolism in pregnancy[J].Lancet,2010,375(9713):500-512.
[10]Henriksson P,Westerlund E,Wallén H,etal.Incidence of pulmonary and venous thromboembolism in pregnancies after in vitro fertilisation:cross sectional study[J].BMJ,2013,346:e8632
[11]Leung AN,Bull TM,Jaeschke R,etal.ATS/STR Committee on Pulmonary Embolism in Pregnancy.American Thoracic Society documents:an official American Thoracic Society/Society of Thoracic Radiology Clinical Practice Guideline--Evaluation of Suspected Pulmonary Embolism in Pregnancy[J].Radiology,2012,262(2):635-646.
[12]Bourjeily G,Paidas M,Khalil H,etal.Pulmonary embolism in pregnancy[J].Lancet,2010,375(9713):500-512.

