苦瓜籽蛋白的提取条件及其抗氧化性质
张 美 萍,叶 淑 红,王 际 辉,王 晗,肖 珊,金 慧 燕
(大连工业大学 辽宁省食品生物技术重点实验室,辽宁 大连 116034)
0 引 言
苦瓜具有提高人体免疫力等良好的食用和药用价值[1],但苦瓜籽目前还未能引起人们的关注和重视,常常作为废物弃掉。近期的研究表明,苦瓜籽中同样含有丰富的活性成分[1]。苦瓜籽蛋白可以特异性地抑制一些肿瘤细胞,诱发其凋亡,但对正常的细胞却没有毒副作用,因此在临床领域的应用上有着广阔的前景[2]。
近年来,国内外许多学者从苦瓜籽中提取蛋白质并对其生理作用进行研究[3-4],研究发现,苦瓜籽蛋白具有多方面的生物活性和功能,尤其在清除自由基方面。目前对于苦瓜籽蛋白的抗氧化活性主要是研究SOD(超氧化物歧化酶)的活性[5],而清除羟自由基(·OH)的研究还未见报道。本试验优化了苦瓜籽蛋白的提取条件,并研究了苦瓜籽蛋白的还原力和清除羟自由基(·OH)的能力,为以后进一步的研究奠定基础。
1 材料与方法
1.1 原料与试剂
干苦瓜籽,山东寿光市场中购买。
考马斯亮蓝G-250(0.1mg/mL):称取50mg G-250溶于25mL 95%乙醇中,加入50mL 85%磷酸,用蒸馏水稀释至500mL。标准牛血清蛋白液(1.0mg/mL):称取100mg牛血清蛋白,用0.9%生理盐水配制,定容至100mL。铁氰化钾、三氯乙酸、三氯化铁、磷酸二氢钾、番红花红、ED-TA-Na2、硫酸亚铁、硼酸、甲基红、无水乙醇、溴甲酚绿等,分析纯;85%浓磷酸、丙酮等。
1.2 方 法
1.2.1 苦瓜籽粉的制备
将晒干的苦瓜籽去壳粉碎,过50目筛,得苦瓜籽粉,105℃恒重法[6]测定苦瓜籽中的水分。
1.2.2 苦瓜籽蛋白的提取
准确称取2.0g苦瓜籽粉,加入2mmol/L不同pH的磷酸缓冲液(PBS)20mL,于25℃、150r/min条件下搅拌一定时间后于10 000r/min离心15min,离心后取上清液,加入一定液料比的50%的丙酮溶液,摇匀。将混合溶液于4 000r/min离心10min,取沉淀,加入2mmol/L的磷酸缓冲液(PBS)(pH=7.2)10mL溶解,得到的溶液为苦瓜籽蛋白的粗提液[7]。
1.2.3 成分测定方法
粗蛋白质量分数的测定采用凯氏定氮法[8],提取液中蛋白质质量分数的测定采用考马斯亮蓝法[9],粗脂肪质量分数的测定采用索氏提取法[10]。
1.2.4 单因素试验
分别以液料比、提取体系pH、搅拌时间为单因素,考察各因素对苦瓜籽蛋白提取率的影响。各因素水平梯度分别为:液料比1∶1、1.5∶1、2∶1、2.5∶1、3∶1、3.5∶1、4∶1;提取体系pH 2.0、4.0、6.0、8.0、10.0、12.0;搅拌时间 1、2、3、4、5h。将提取液中蛋白质和苦瓜籽总蛋白质量之比定义为蛋白质提取率(%)。
1.2.5 正交试验优化
在单因素试验基础上,进行三因素三水平试验,每个试验做3个平行,采用L9(33)试验。其因素与水平设计见表1。
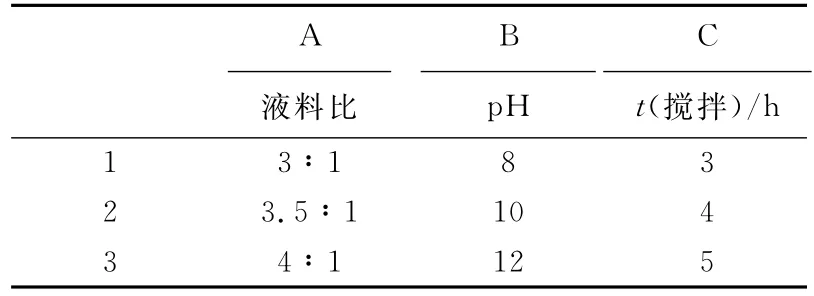
表1 因素与水平Tab.1 Factors and levels
1.2.6 苦瓜籽蛋白还原能力的测定
取不同浓度的苦瓜籽蛋白样品溶液1mL,加入0.2mol/L的pH 6.6磷酸缓冲液和1%铁氰化钾溶液各2.5mL,混匀,50℃水浴保温20min,冷却,加入2.5mL 10%的三氯乙酸终止反应。摇匀,离心,取上清液2.5mL,加入2.5mL去离子水和0.5mL 0.1%的FeCl3溶液,混匀,静置10min,以去离子水作参比,700nm下测定吸光度值。以同浓度维生素C作阳性对照,吸光度值越大表示还原能力越强[12]。
1.2.7 苦瓜籽蛋白对羟自由基的清除
取0.15mol/L pH 7.4的磷酸盐缓冲溶液1.0mL、番红花红(0.52mg/mL)0.2mL、6mmol/L的 EDTA-Na2-Fe2+1.0mL(现 配 现用),再加入不同浓度的样品溶液3mL,最后加入0.3%的过氧化氢0.8mL,混匀后于37℃水浴中保温30min,在520nm处测定吸光值,空白组以等体积去离子水代替样品溶液,对照组以等体积去离子水代替样品溶液和过氧化氢溶液。以同浓度维生素C代替多糖作对比试验[13]。结果按下式计算:
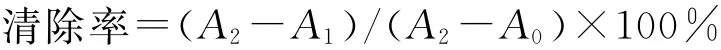
式中:A0为空白组吸光度值;A1为苦瓜籽蛋白样品的吸光度值;A2为对照组吸光度值。
2 结果与讨论
2.1 苦瓜籽粗蛋白的含量
用恒重法测得苦瓜籽粉含水分为4.0%。用凯氏定氮法测得的苦瓜籽蛋白质量分数为39.6%,与文献报道的39%~45%一致[14]。用索氏提取法测得苦瓜籽脂肪质量分数为38%。表明苦瓜籽具有很高的营养价值。
2.2 单因素试验
2.2.1 液料比的影响
由图1可知,苦瓜籽蛋白质提取率受液料(丙酮与样液)比的影响较明显,随着丙酮体积增大,苦瓜籽蛋白质提取率随之上升,当液料比为3.5∶1时达到最大值16.28%,液料比为4∶1时蛋白质提取率开始降低。可能是丙酮浓度太高导致蛋白质变性使可溶性蛋白溶解度降低,从而使蛋白质提取率降低,所以液料比选择3.5∶1为最佳。
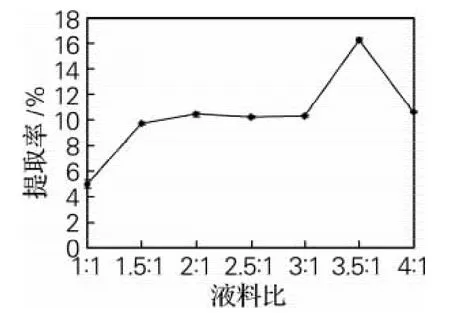
图1 液料比对蛋白质提取率的影响Fig.1 Effect of liquid-solid ratio on the protein extraction rate
2.2.2 提取体系pH的影响
由于蛋白质为两性电解质,所以提取体系的pH会影响苦瓜籽蛋白的提取率。比色法测得该苦瓜籽蛋白的等电点为3.0~5.0,所以pH在2.0~6.0,蛋白质发生沉淀使得可溶性蛋白含量降低,造成蛋白质提取率较低。由图2可知,当pH为10.0时,苦瓜籽蛋白的提取率达到最大18.98%。这可能是由于蛋白质在等电点附近溶解度最小,远离等电点时,溶解度增加,提取率增加;但pH为12.0时,可能蛋白质因变性而沉淀,提取率降低。所以当提取体系pH为10.0时,提取率达到最大。
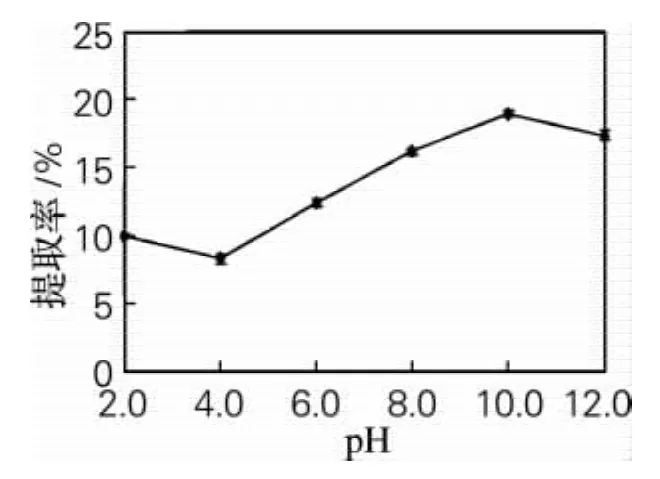
图2 pH对蛋白质提取率的影响Fig.2 Effect of pH on the protein extraction rate
2.2.3 搅拌时间的影响
由图3可知,随着搅拌时间的延长,苦瓜籽蛋白质提取率增大,4h后开始逐渐下降。这是由于随着搅拌时间的延长,溶液中的蛋白质出现凝聚而沉淀,离心后蛋白沉淀被去除,使蛋白质提取率降低[15]。当搅拌时间为4h时提取率最大,最大值为19.13%,因此最佳搅拌时间为4h。
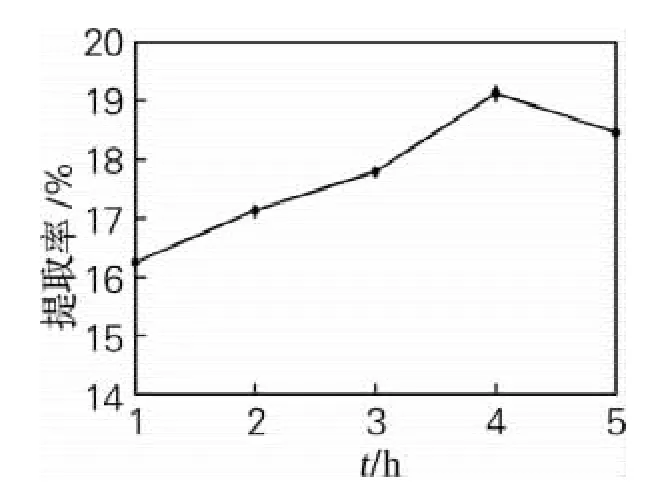
图3 搅拌时间对蛋白质提取率的影响Fig.3 Effect of stirring time on the protein extraction rate
2.3 正交试验结果
正交试验结果如表2所示,由表2可以看出,3个因素对试验结果影响的主次顺序为:A>B>C[16],最佳提取组合为A2B1C3,即液料比为3.5∶1、pH为8.0、搅拌时间为5h。在此最佳提取条件下进行验证试验,苦瓜籽蛋白的提取率可达19.43%,根据文献[5]报道,该提取率处于较高水平。
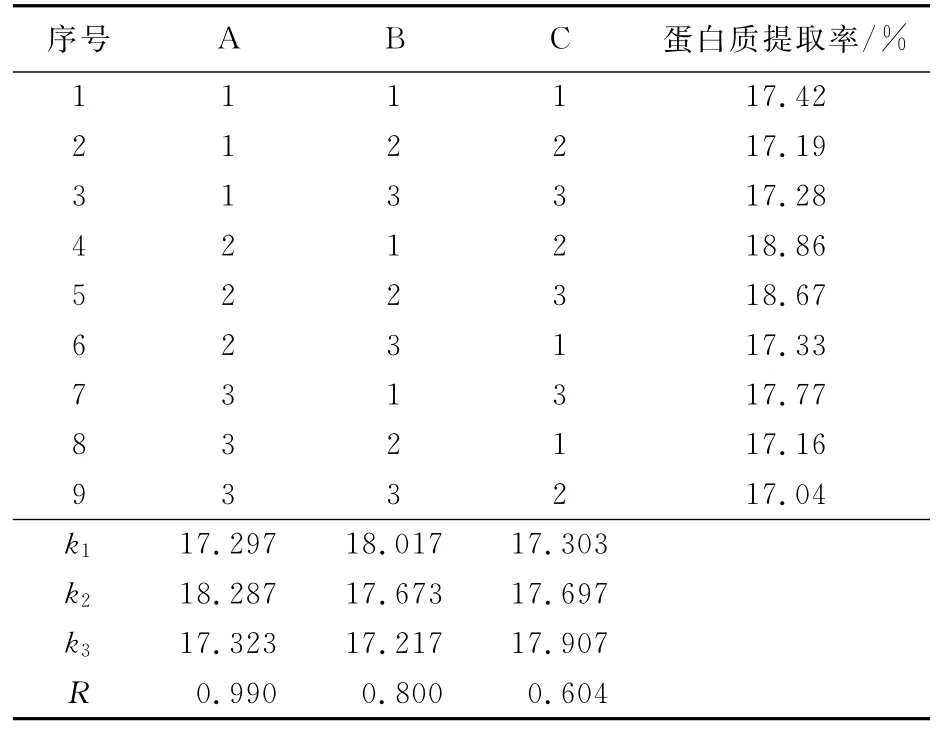
表2 L9(33)正交试验表Tab.2 Orthogonal table
2.4 苦瓜籽蛋白的抗氧化性
2.4.1 苦瓜籽蛋白的还原能力
物质的还原能力与其抗氧化活性之间存在显著的相关性[17]。选用不同浓度的苦瓜籽蛋白样品,测定还原能力和浓度的关系,与维生素C作对比,结果如图4所示。
从图4中可以看出,苦瓜籽蛋白的还原能力虽然低于维生素C,但是也表现出了一定的还原能力,且其还原能力随蛋白质量浓度的增加而增大。苦瓜籽蛋白的还原能力为其抗氧化活性奠定了基础。
2.4.2 苦瓜籽蛋白对羟自由基(·OH)清除作用
羟自由基使番红花红褪色,因而根据褪色的程度来衡量·OH的清除效果[15]。选用不同质量浓度的苦瓜籽蛋白样品和维生素C,测定清除羟自由基的清除率和质量浓度的关系,IC50表示当清除率达到50%所需的样品质量浓度,结果如表3所示。
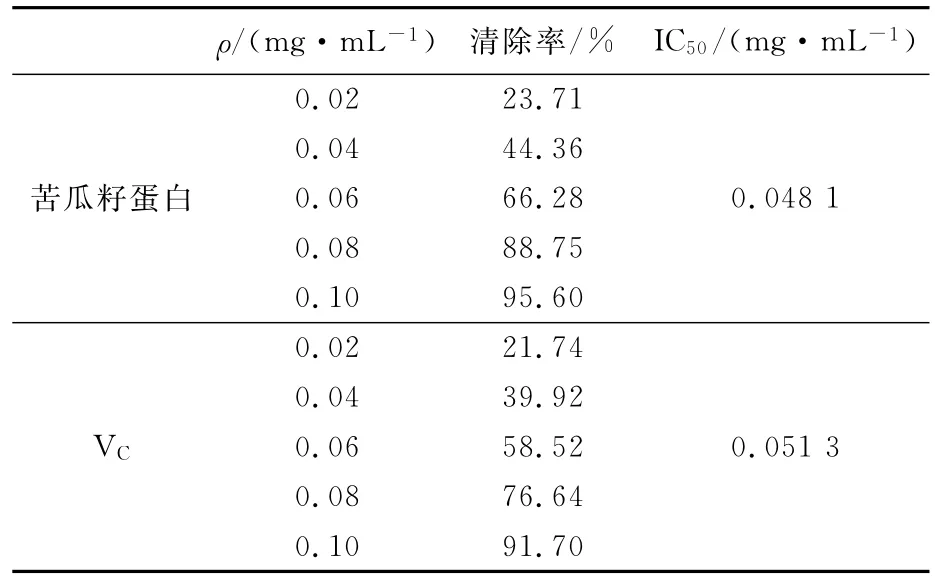
表3 苦瓜籽蛋白和维生素C对羟自由基(·OH)的清除率Tab.3 The elimination rate of the protein to·OH
由表3可知,苦瓜籽蛋白清除·OH的能力随着蛋白质量浓度的增加而增大,并且存在着一定的量效关系。当清除率达到50%时,所需的苦瓜籽蛋白和VC质量浓度分别为0.048 1和0.051 3mg/mL。从表3中可以看出,苦瓜籽蛋白样品具有较强的清除羟自由基的能力,其清除羟基自由基的能力与同等质量浓度的VC接近,最高可达91.7%,具有较强的清除羟自由基(·OH)的能力。
3 结 论
以苦瓜籽为原料,对苦瓜籽蛋白的提取方法、抗氧化性质进行了研究。结果表明,苦瓜籽中粗蛋白质量分数为39.6%;单因素试验结果表明,液料比为3.5∶1时,蛋白质提取率为16.28%;pH为10.0时,蛋白质提取率为18.98%;搅拌时间为4h时,蛋白质提取率为19.13%。正交试验结果表明,最佳提取条件为液料比3.5∶1、pH=8、搅拌时间为5h,苦瓜籽蛋白的提取率可达19.43%。抗氧化性的结果表明,苦瓜籽蛋白具有一定的还原力,其还原力随着质量浓度的增加而增大;苦瓜籽蛋白清除·OH的能力随着蛋白质量浓度的增加而增大,其清除羟基自由基的能力与同等质量浓度的VC接近。
[1]黄建中.苦瓜籽活性成分的研究进展[J].食品科学,2004,14(4):55-57.
[2]包凌晟,吴民泸,聂宇,等.苦瓜籽核糖体失活蛋白的基本性质研究[J].四川大学学报:自然科学版,2009,46(4):1203-1207.
[3]孟延发,杜毅峰,张雪梅.苦瓜籽核糖体失活蛋白的理化性质及生物活性[J].中国生物化学与分子生物学报,1999,15(6):920-923.
[4]叶国杰,钱瑞卿,卢保元,等.苦瓜子蛋白的分离纯化及其性质研究[J].化学学报,1998,56(11):1135-1144.
[5]博明辉.苦瓜籽蛋白的分离、纯化及抗氧化作用的研究[J].药物生物技术,2001,8(5):248-250.
[6]魏林.小麦粉水分测定方法的比较[J].山地农业生物学报,2005,24(4):363-365.
[7]王宾香,时祥柱,郭春腾,等.阴阳离子交换色谱串联分离纯化苦瓜籽核体失活蛋白[J].色谱,2004,22(5):543-536.
[8]陈智慧,史梅,王秋香,等.用凯氏定氮法测定食品中f的蛋白质含量[J].新疆畜牧业,2008(5):22-24.
[9]王文平,李琳,王明力,等.考马斯亮蓝法测定野木瓜多糖中蛋白质的含量[J].食品研究与开发,2008,29(1):115-120.
[10]汪东风.食品科学实验技术[M].北京:中国轻工业出版社,2006:24-26.
[11]张恒,柯泽伟,佘余辉.从野生荞子提取蛋白质和淀粉的研究[J].郑州粮食学院学报,2000,21(1):36-38.
[12]DORMAN H J D,HILTUNEM R.Fe(III)reductive and free radical-scavenging properties of summer savory(SaturejahortensisL.)extract and subfractions[J].Food Chemistry,2004,88(2):193-199.
[13]李平,王艳辉,马润宇.山茱萸多糖PFCCI抗氧化性能研究[J].食品工业科技,2003,24(5):34-36.
[14]朱新产,张庭荣,宋玉芹.苦瓜的营养成分研究[J].广西科学,2003,10(3):238-240.
[15]李凤英,崔蕊静,李春华.葡萄籽蛋白质的提取工艺研究[J].中国油脂,2005,30(4):50-52.
[16]金虹.豌豆蛋白质提取工艺的优化[J].湖北农业科学,2010,29(9):2209-2215.
[17]舒媛,刘安军,王丽霞.山药多糖结合蛋白质对抗氧化作用的影响[J].食品研究与开发,2006,127(11):39-42.

