阿伏伽德罗常数与气体常数测定实验的改进
张鑫雨 丁家琦 谢祎祎 苏泽彬 顾春晖 杨艺
(北京大学化学与分子工程学院2010级 北京100871)
1 原实验方案的引述
1.1 原方案的简要介绍
阿伏伽德罗常数与气体常数可同时由电解酸性硫酸铜溶液测得。
以铜片为阴极,发生反应:Cu2++2e-=Cu,根据铜的增重可得到铜增加的物质的量。再根据通过的电量即可得到阿伏伽德罗常数。

阳极为铂丝,发生反应2H2O-4e-=O2+4H+,根据气体体积与气体物质的量(可由铜的增重算得)可求得气体常数 R[1]。
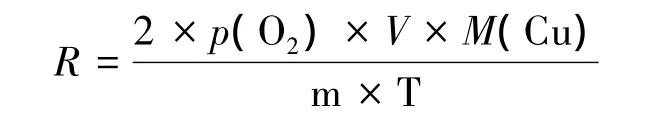
1.2 原方案的缺陷
1.2.1 气体常数测定误差
原方案是通过测量由阳极氧化产生氧气的体积,再经计算得到气体常数。由于氧气在水中有一定溶解度,且电解产生的气泡直径小,与溶液接触表面积大,溶解速率较快,因此在测定气体常数时误差较大。
1.2.2 铜离子的污染
铜离子作为一种常见的重金属离子,在自然界中广泛存在;但当其由于人类活动进入土壤,使土壤中铜离子含量超过土壤本身的自净能力时,会使土壤的成分、性质发生变异,影响植物的生长和繁殖[2],降低农作物的产量和质量,影响土壤生物化学过程的强度和方向[3],改变土壤微生物的区系以及群落结构和功能[4],并危害人体健康[5]。
1.2.3 能耗因素
原方案中,直流稳压电源的输出电压为25~30V,电阻箱电阻约100Ω,保持电流约190mA。按电解30min计,每人次实验共需电功9kJ。
2 新实验方案详述
2.1 实验原理介绍
2.1.1 新实验方案的提出过程
阳极连接金属片,使其在阳极电解为离子脱离固相,然后通过金属片减重测得阿伏伽德罗常数;通过测量阴极生成氢气的体积得到气体常数,同时在实验中不使用会造成污染的硫酸铜电解液。
在实验之初,我们选用NaOH溶液替换酸性硫酸铜溶液做电解液,金属片仍用铜片。但在预实验中发现,电解中铜片上缓慢地积累灰蓝色的氢氧化铜,测定误差大。通过讨论,我们认为防止电极被氢氧化物钝化是减小误差的关键。由此提出采用EDTA络合电离出的Cu2+,以保证氢氧化铜不附着在阳极上。鉴于EDTA在水溶液中溶解度较低,且为减弱EDTA酸根在络合Cu2+时酸效应的影响,故在配制EDTA溶液时按等物质的量混合EDTA与NaOH,以增加溶解度,并提高其与Cu2+络合的稳定常数。通过实验,初步确定了以0.25mol/L EDTA溶液为电解液。
此外,由于Cu2+-Cu电对标准电极电势较大,易发生副反应,因此有必要对金属材料进行测试。综合实验室情况与不同金属的电化学性质,决定对铜片、锌片进行探究。
电极反应如下(金属以M代表):
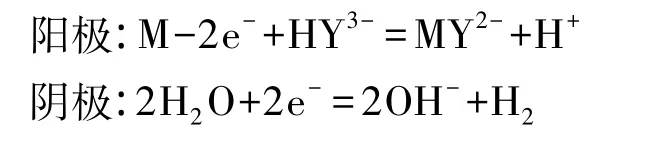
阿伏伽德罗常数及气体常数的计算公式:
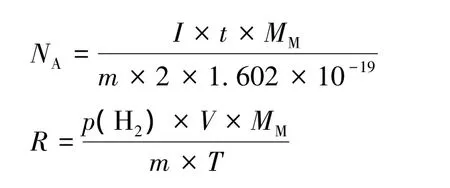
2.1.2 新实验方案可行性的理论证明
实验实测条件为:电解液为0.25mol/L Na3HY溶液,溶液pH为7~8。阴极发生反应:2H2O+2e-=2OH-+H2;阳极发生反应:阳极副反应:2H2O-4e-=4H++O2;阴极副反应:
(1)阳极上发生反应的竞争。
由Nernst方程,电解之初,按pH=8.0时计算氧气析出的条件电位为:
在电解完成后,溶液pH下降至6,此时氧气析出的条件电位为:
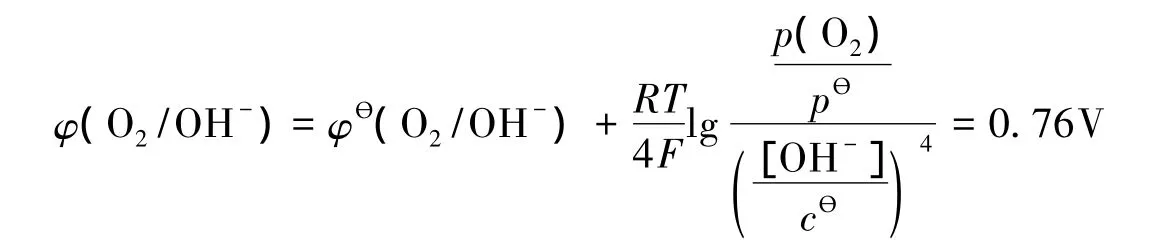
在电解过程中,铜、锌与Y4-络合,在pH=8时,EDTA副反应系数为:
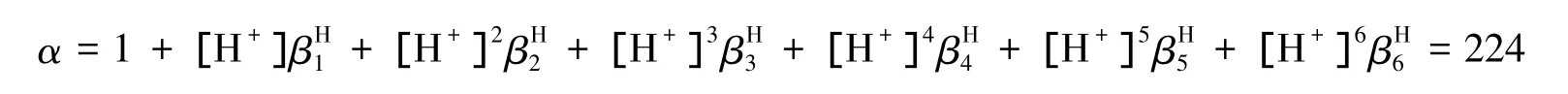
则[Y4-]=c/224=1.12×10-3mol/L,此时铜、锌离子的条件电位为:
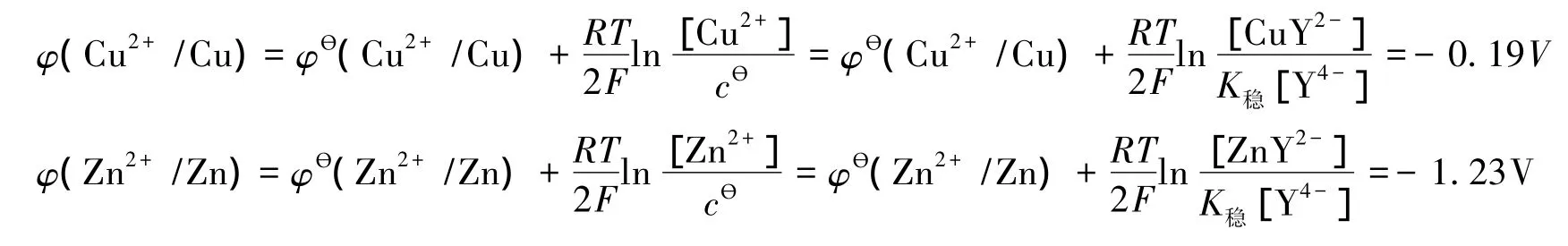
可见,EDTA的络合作用大大降低了铜、锌离子的条件电位,使φ(Cu2+/Cu)和φ(Zn2+/Zn)远小于φ(O2/OH-)。故金属片在阳极发生氧化反应在热力学上是可行的。
(2)阴极上发生反应的竞争。
由Nernst方程,电解初溶液按pH=8.0计算溶液中氢离子的条件电位为:
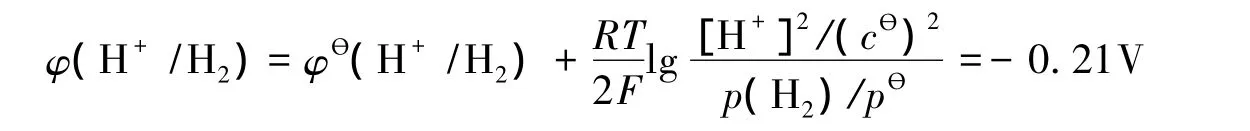
锌离子的条件电位为-1.23V,故φ(H+/H2)>φ(Zn2+/Zn),因此热力学上反应倾向于析出氢气。
而此时铜离子的条件电位为-0.19V,故φ(H+/H2)<φ(Cu2+/Cu)。因此热力学上阴极应首先析出金属铜。但在实际实验中,测得由于阴极析出铜导致的测定误差远小于实验允许误差,该部分误差可忽略。
2.2 新实验方案实验条件的确定
在前期探究过程中,我们主要对电解质溶液的组成、浓度、直流稳压电源的输出电压以及电解电流进行了探索。
2.2.1 电解质溶液
通过讨论,决定利用EDTA的络合性,对电解产生的M(OH)2进行络合,从而防止其附着在铜片表面影响电解反应进行。经实验验证,采用EDTA做电解液进行电解时,电流较为恒定,结果比较理想。
2.2.2 电解质溶液的浓度
电解液浓度过低将导致电解液导电性下降。为达到理想的电流密度,需要提高电压,但这有可能导致副反应发生。
在实验中,我们配制了 0.02mol/L、0.04mol/L、0.06mol/L、0.08mol/L、0.10mol/L、0.20mol/L 以及0.25mol/L的EDTA溶液。通过实验,发现在相同电流下,电压与浓度成反比。考虑到EDTA的溶解度以及使用成本,我们选定0.25mol/L的EDTA溶液。
2.2.3 直流稳压电源的输出电压与电解电流
电解电压过低将导致反应速率慢,不利于电解反应高效进行;电解电压过高则将引起副反应的发生。通过尝试,最终输出电压为20V。而电流密度决定了电极反应的速率,通过调节电阻箱可控制电流。最终电解电流为100mA。
由此,我们初步确定了如下反应条件:以0.25mol/L EDTA溶液为电解质,在外接电压20V条件下,通过调节电阻箱阻值,使电流稳定在100mA进行电解。
2.3 实验方法及步骤
2.3.1 仪器及试剂
仪器:直流稳压电源(上海冠威电器有限公司,GPS3020),直流电阻器(上海星悦电子科技有限公司,ZX21),毫安表(永恒精密电表厂,C19),分析天平(北京赛多利斯仪器系统有限公司,BS-224S),百分之一台秤(梅特勒-托利多仪器(上海)有限公司,PL602-S),定槽水银气压表(长春气象仪器厂,DYM2),导线,电极夹,秒表,温度计,50mL酸式滴定管,250mL烧杯,25mL移液管,铂电极,零号砂纸,米尺。
试剂:纯紫铜片,纯锌片,氢氧化钠(北京化工厂,AR),乙二胺四乙酸二钠(简称EDTA,北京化工厂,AR)。
2.3.2 实验步骤[1]
(1)电解液的配制。
在百分之一台秤上称取94g EDTA,10g氢氧化钠,溶于1L去离子水,搅拌均匀备用。
(2)滴定管无刻度部分的测量。
用25mL移液管移取25.00mL去离子水至酸式滴定管中,再把酸式滴定管夹在滴定管夹上,每隔2min读一次管内液面刻度(至0.01mL)。直至读数不变,记下读数。设读数为a,则酸式滴定管无刻度部分的体积为(a-25.00)mL。重复测量两次,测量结果相差不得超过0.10mL。最终结果取两次测量结果的平均值。
(3)连接装置,初调电流。
参照图1,取纯薄紫铜片(约3cm×5cm),用零号砂纸擦去氧化膜,用去离子水洗净,晾干。以铂丝做阴极,伸入量气管内。向250mL烧杯中加入200mL电解液。以铜片做阳极,打开量气管活塞,用洗耳球从乳胶管口吸气,使溶液充满量气管,然后关闭活塞。接通电源,调节电阻箱的电阻和直流稳压电源的输出电压(20V),使毫安表的读数在95mA左右。
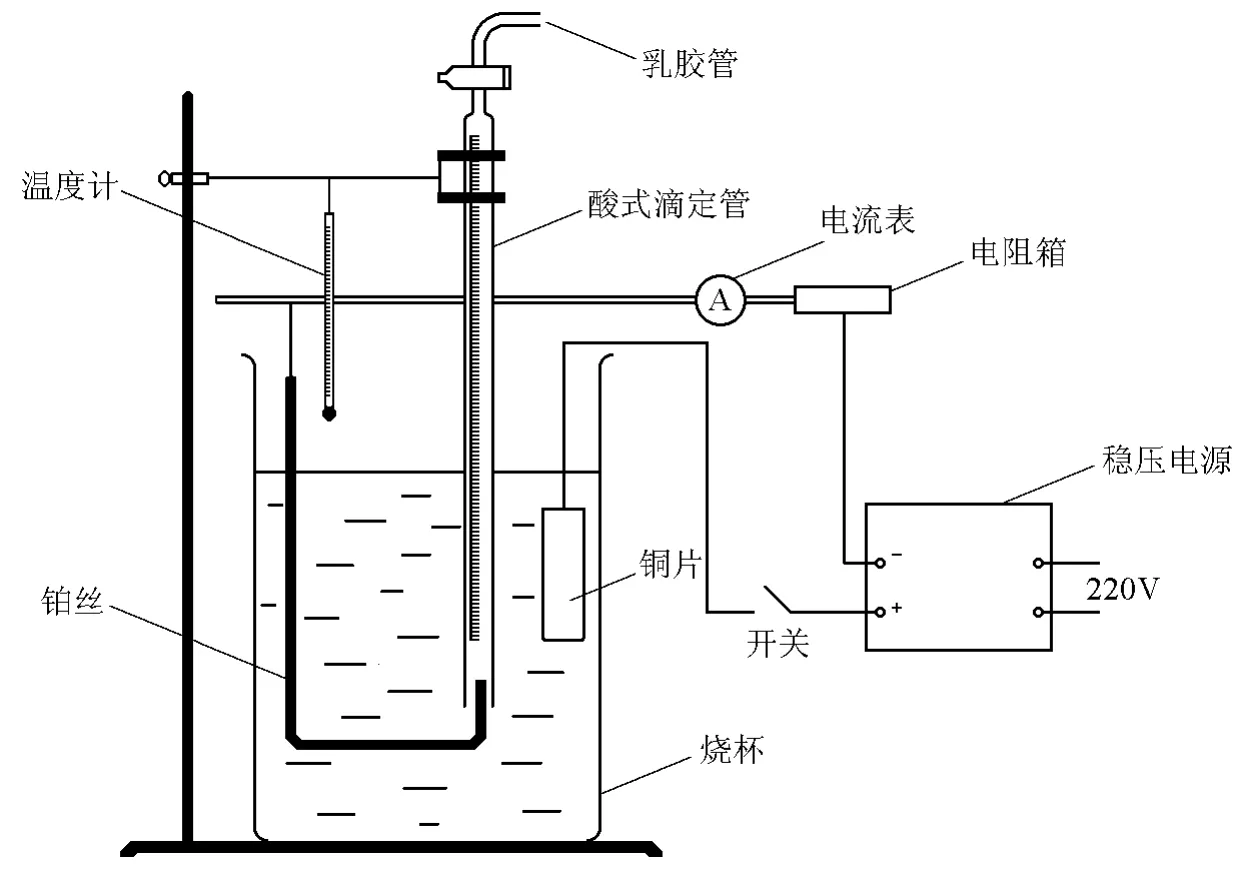
图1 新方案电解反应装置图
(4)电解。
取下铜片,用去离子水洗净铜片并晾干。在分析天平上称重(称准至0.1mg)后重新连接铜片,使量气管充满电解液。接通电源同时启动秒表,记录电流强度。电解过程中随时调节电阻箱的电阻,以维持电流恒定。
(5)记录数据及后处理。
通电30min后,切断电源,取下铜片。用去离子水漂洗铜片并晾干。在分析天平上称重。测量量气管内液柱高度,记录温度和管内液面读数(精确至0.01mL)。
2.3.3 实验结果
分别以铜片和锌片为阳极,进行了5次实验,实验数据见表1和表2;表3为北京大学化学学院2010级本科学生的数据处理结果。
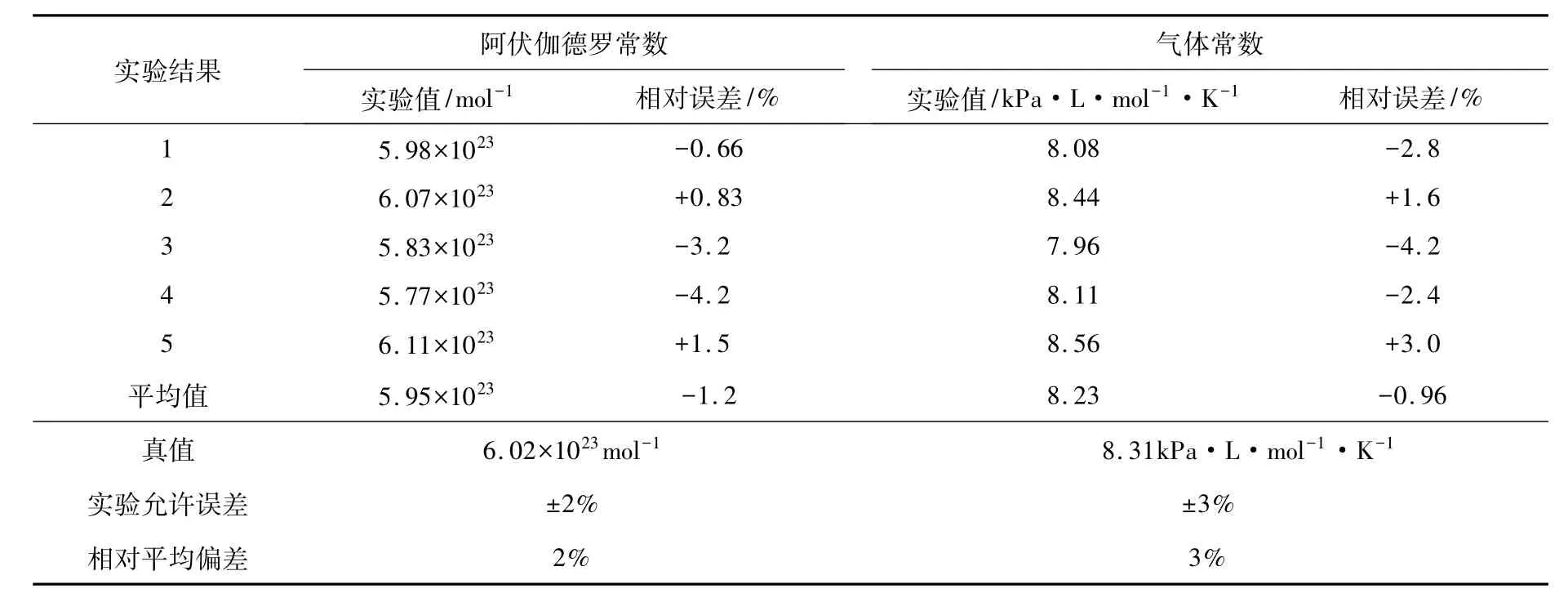
表1 铜片做阳极测定阿伏伽德罗常数与气体常数的结果及数据处理

表2 锌片做阳极测定阿伏伽德罗常数与气体常数的结果及数据处理

表3 原方法测定阿伏伽德罗常数与气体常数的数据处理
由表1、表2对比可知,采用铜片作阳极得到的测定结果更加准确。而对比表1与表3可知,在平行度相当的前提下,新方案测定阿伏伽德罗常数及气体常数的相对误差均小于原方案的误差,且在实验允许误差范围内。
2.4 对新实验方案的一些讨论
2.4.1 实验方案的进一步优化
由于实验时间有限,我们在探究中难免有不足之处。为提高溶液导电率,使反应顺利、平稳进行,实验中采用的EDTA溶液已接近室温下EDTA二钠盐在水中的饱和浓度。在配制电解液时需消耗大量EDTA,同时会造成不必要的浪费。而加入惰性强电解质可提高电解液的导电性,从而适当降低EDTA浓度,减少浪费。此外该改进还可降低电解电压,降低阳极板副反应发生的可能性。经过讨论,我们认为可向溶液中加入相同离子浓度的常见钠盐、钾盐或铵盐以探究电解质对电解反应的影响。
2.4.2 实验中的异常现象
(1)铜片表面出现气泡。
在电解初期,阳极铜片边缘或表面不平整的位置会有少量气泡生成,即有副反应2H2O-4e-=4H++O2发生。由于粗糙的表面改变了金属片表面的动力学性质,利于氧气在极板表面析出,使实验出现正误差。为减少该副反应的发生,我们采用如下方法:
①选用表面光洁,面积较大(4cm×5cm)且较薄的铜片。②使用零号砂纸仔细打磨铜片至表面光亮。
在采用以上两方法后,铜片表面的副反应明显减少。
(2)铜片表面出现少量不溶于酸的黑色固体。
在电解过程中,个别铜片表面出现了黑色固体。电解后将铜片从电解液中取出,用3mol/L硫酸溶液漂洗,发现黑色固体不溶解,且易被剥离。基于以上现象,我们考虑电解中逐渐暴露出的黑色固体是铜片中的不溶性杂质。通过提高铜片纯度,可减小实验误差。
3 新旧实验方案的比较
3.1 能耗比较
新实验方案采用的电化学条件为断路电压20V,电流约100mA,电阻25Ω左右。经计算,每人次实验所需消耗的电功为3.6kJ,可比原方案节电60%(参见本文1.2.3节)。
3.2 污染
实验的主要污染由铜离子造成。新实验方案每人次实验铜片平均失重折合成五水硫酸铜约为0.16g,而原实验方案人均排放五水硫酸铜约2.4g,可见新方案大幅度减少了铜离子的排放。
3.3 废液处理
3.3.1 废液处理的必要性
EDTA是典型的螯合剂,可以有效地络合重金属离子。由于EDTA与重金属的络合能力较土壤对重金属离子的吸附能力强,可用于净化被重金属离子污染的土壤,因此在一定程度上,实验中排放出的EDTA可缓解环境污染。但过浓的EDTA会使土壤中沉积的重金属离子重新溶解,引起环境污染。同时,高浓度EDTA排放到土壤、水体中将导致其中大量的Ca2+、Mg2+离子被络合,引起环境离子平衡的改变。
此外,电解液经过重复使用后,溶液中的铜离子浓度也相对较高,若电解后的溶液不加处理直接排放,待EDTA被土壤中微生物分解后亦会使铜离子游离析出,引起土壤污染。因此,对电解废液进行处理十分必要。
3.3.2 处理方案及展望
考虑到EDTA溶解度较EDTA大,故采用提高溶液酸度的方法可大大降低EDTA溶解度,从而达到回收EDTA的目的。
基于以上原理,我们采用如下方法对废液进行处理:对已重复使用的电解液进行回收、集中,然后在快速搅拌下加入浓硫酸溶液(实际实验可以使用废酸)调节pH至0.5。减压抽滤并用去离子水洗涤固体2~3次,将固体EDTA回收。实际测得EDTA回收率近100%。在搅拌下向滤液中加入NaOH固体调节pH至7~8,随后加入足量Na2S固体,使金属离子浓度大大降低,待反应完全后弃去废液[6]。
该废液处理方案充分回收了溶液中的EDTA,并将潜在的环境污染降至最低。
4 总结
通过以上讨论可见:以EDTA溶液做电解液,用氧化纯铜阳极失重法测定阿伏伽德罗常数及气体常数的方案有较大优越性。利用EDTA对铜离子的强配位作用,避免了阳极电解生成的氢氧化铜附着在电极表面,从而使电解过程中电流保持相对稳定,使电解得以顺利进行。而通过探究EDTA浓度以及电化学条件,我们初步探索到适当的实验条件。通过实验的数据可看出,该方案具有一定的可靠性、准确度与精密度。
本文得到北京大学化学与分子工程学院卞江、朱涛老师在实验设计中的指导;以及北京大学化学基础实验教学中心李维红老师及其他老师提供实验条件并全程指导,特此致谢。
[1]北京大学化学系普通化学教研室.普通化学实验.第2版.北京:北京大学出版社,2000
[2]林义章,徐磊.中国生态农业学报,2007,15(1):201
[3]邱莉萍,张兴昌.环境农业科学学报,2006,25(3):30
[4]孙晋伟,黄益忠,石孟春,等.生态学报,2008,28(6):2861
[5]郑现军.山西建筑,2008,34(33):343
[6]王罗春,闻人勤,丁桓如.环境工程学报,2007,1(10):46

