达沙替尼治疗初发性慢性髓细胞白血病的疗效分析
陈荣华 甘思林
1.郑州人民医院血液科,河南郑州 450003;2.郑州大学第一附属医院血液科,河南郑州 450052
慢性髓细胞白血病(chronic myeloid leukemia, CML)是一种起源于骨髓造血干细胞,以携带费城染色体(Ph)、异常造血细胞克隆扩增为特征的骨髓增殖性疾病。CML为血液系统常见的恶性疾病,发病率为1.6/10万,占成人白血病的15%,男性多于女性,其严重影响患者的生活质量,甚至威胁患者的生命[1]。BCR-ABL融合蛋白是CML发病和疾病进展的分子基础,其具有很强的酪氨酸激酶活性,使一系列信号蛋白发生持续性磷酸化,影响细胞的增殖分化、凋亡及黏附。伊马替尼是临床用于一线治疗CML的酪氨酸激酶抑制剂,其能够靶向的抑制BCR-ABL蛋白的酪氨酸激酶活性,从而抑制细胞增殖并诱导其凋亡,已显示较好的临床疗效;但随着其在临床广泛应用,药物的不耐受和治疗后CML问题逐渐显现,且部分患者疗效欠佳[2]。达沙替尼是第二代酪氨酸激酶抑制剂,其对BCR-ABL蛋白活性的抑制作用显著强于伊马替尼,且能够抑制引起伊马替尼耐药的BCR-ABL突变,已被批准用于CML的一线治疗[3],但其用于治疗CML的确切疗效目前仍不是十分清楚。本研究通过对比分析伊马替尼和达沙替尼治疗初发性CML患者的临床资料,来探讨达沙替尼治疗初发性CML的疗效。
1 资料与方法
1.1 一般资料
选取2010年1月—2011年12月我院诊治的初发性CML患者26例。根据治疗方案的不同,将患者分为达沙替尼组和伊马替尼组。其中,达沙替尼组14例,男8例,女6例;年龄25~66岁,平均(43.5±6.85)岁。伊马替尼组12例,男7例,女5例;年龄26~68岁,平均(44.1±7.08)岁。所有患者均经骨髓细胞形态学CML、骨髓细胞遗传学检查发现Ph+或其变异体,未接受针对CML的系统治疗,在初次确诊后1个月入院治疗。排除肝肾功能异常、心脏功能异常、对治疗药物过敏的患者。所有患者均签署书面知情同意书,自主选取治疗方案。两组患者在性别、年龄方面无显著性差异(P>0.05),具有可比性。
1.2 方法
1.2.1 治疗方法 达沙替尼组:口服达沙替尼片100 mg/d,1次/d;治疗过程中,根据疗效和不良反应情况进行剂量调整或短暂停药,最高剂量不得超过180 mg/d。伊马替尼组:口服伊马替尼片400 mg/d,1次/d;治疗过程中,根据疗效和不良反应情况进行剂量调整或短暂停药,最高剂量不得超过800 mg/d。患者治疗后3个月未获得血液学完全缓解(CHR),6个月未获得部分细胞遗传学反应(PCyR),12个月未获得完全细胞遗传学反应(CCyR),18个月未获得主要分子学反应(MMR),未发现严重的血液学或其它严重不良反应时,可增加药物剂量。如果治疗过程中,出现严重的血液学或其它严重不良反应,则需减少药物剂量,甚至停药。
1.2.2 疗效观察和评价 治疗过程中密切观察患者症状、体征以及行为状态的变化。所有患者分别于治疗前,治疗后第1个月,以后每3个月行血液学、血液生化、尿液常规、生命体征的检测;记录治疗过程中不良反应的情况。疗效评价包括治疗前后骨髓细胞形态学、染色体核型和分子学反应;主要疗效参数为CHR 率、CCyR率、PCyR率、MMP率,次要疗效参数为达到CCyR时间、CCyR持续时间。比较两组患者疗效参数差异和不良反应情况。
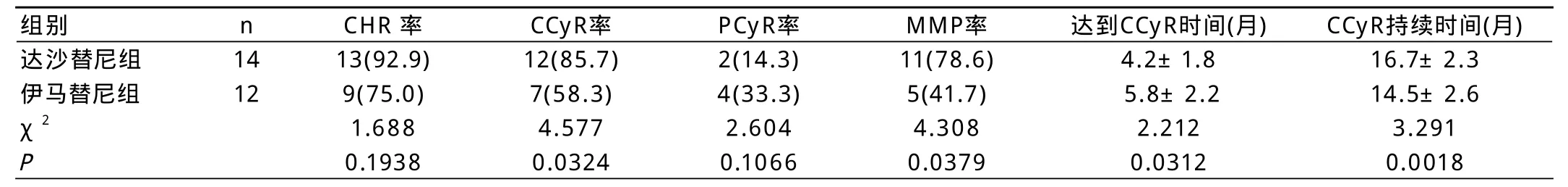
表1 两组患者疗效参数比较比较[n(%)]
1.3 统计学处理
采用SPSS 17.0统计学软件对数据进行分析,数据以(±s)表示。采用的统计学方法为两随机样本的t检验和χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者疗效参数比较
两组患者疗效参数比较见表1 达沙替尼组患者CCyR率、MMP率、达到CCyR时间和CCyR持续时间显著高于伊马替尼组,差异有统计学意义(P<0.05)。两组患者在CHR率和PCyR率方面无显著性差异(P>0.05)。
本研究患者接受治疗直至CML疾病进展、出现严重血液学或其它严重不良反应、出现不能耐受的不良反应。随访截止日期为2013年02月28号,达沙替尼组仍有13例患者继续服用药物,剂量100 mg/d;伊马替尼组仍有10例患者继续服用药物,剂量400mg/d。两组均未出现失访和死亡的病例。
2.2 两组患者不良反应情况比较
非血液学不良反应:达沙替尼组患者不良反应发生率为57.1% (8/14),主要为谷丙转氨酶升高、低磷血症、低钾血症等,均为1~2级不良反应,未发现因不良反应停药情况。伊马替尼组患者不良反应发生率为83.3%(10/12),主要为低磷血症、低镁血症、低钾血症、低钙血症和水肿等;1~2级不良反应6例,3~4级4例,1例因不良反应停药。达沙替尼组患者非血液学不良反应程度、发生率显著低于伊马替尼组(P<0.05)。
血液学不良反应:达沙替尼组患者不良反应发生率为50%(7/14),主要为中性粒细胞减少、贫血、血小板减少等;1~2级不良反应3例,3~4级4例,1例因不良反应停药。伊马替尼组患者不良反应发生率为75%(9/12),主要为中性粒细胞减少、贫血、血小板减少等;1~2级不良反应3例,3~4级不良反应6例,1例因不良反应停药。达沙替尼组患者血液学不良反应程度、发生率显著低于伊马替尼组(P<0.05)。
3 讨论
CML是一种恶性克隆性血液系统疾病,其实质为9号染色体上C-ABL原癌基因移位至22号染色体,与22号染色体断裂点集中区BCR连接,形成BCR-ABL融合基因,该基因编码的蛋白具有极强的酪氨酸激酶活性,影响细胞的增殖分化、凋亡及黏附,导致CML发生[4]。及时采取有效的治疗措施,可以使抑制CML疾病的进展,使患者获得CHR、CCyR和MMP。作为一种有效抑制BCR-ABL活性的酪氨酸激酶抑制剂,伊马替尼给CML患者带来了治愈的希望,但此药物的不良反应较多、耐受性较差、治疗后易复发等缺点,影响了该药物治疗CML的疗效。因此,寻找一种有效控制和治疗CHC的方法亟待解决。
达沙替尼是第二代酪氨酸激酶特异性抑制剂,可以靶向的作用于BCR-ABL基因,抑制BCR-ABL蛋白活性,阻断BCR-ABL依赖的信号转导途径的活化;其次,达沙替尼还能够抑制引起伊马替尼耐药的BCR-ABL突变,甚至可以强力抑制PDGFR、ephrin受体激酶和Src家族激酶,从而达到治疗CML的目的[5],但目前有关达沙替尼治疗初发性CML的疗效仍不十分清楚。Aguilera等[6]报道称,84例耐伊马替尼的CML患者接受达沙替尼治疗平均13月后,69例患者的症状得到明显改善,产生完全血液学反应率为93%,总细胞应答率为35%,且治疗较为持久。周励等[7]对37例CML患者接受达沙替尼或伊马替尼治疗研究显示,达沙替尼患者的MMP率为76%,显著高于伊马替尼患者的37%,两者在CCyP率和疾病无进展生存率方面无明显差异;而达沙替尼患者达CCyP和MMP的中位时间均明显短于伊马替尼患者。本研究发现,达沙替尼组患者CCyR率、MMP率、达到CCyR时间和CCyR持续时间显著高于伊马替尼组。与上述研究结果不尽一致,提示达沙替尼治疗初发性CML疗效优于伊马替尼,是治疗初发性CML患者较理想的选择。
Kantarjian等[8]报道称,达沙替尼治疗CML发生的非血液学不良反应和血液学不良反应多为1~2级,3~4级不良反应的发生率较低。Kim等[9]研究发现,达沙替尼治疗CML患者主要非血液学不良反应为头痛、腹泻、发热、痤疮和肝功能的改变,而血小板减少、中性粒细胞减少和贫血是血液学最常见的不良反应。本研究发现,达沙替尼组患者主要非血液学不良反应为谷丙转氨酶升高、低磷血症、低钾血症等,均为1~2级不良反应;主要血液学不良反应为中性粒细胞减少、贫血、血小板减少,1~2级不良反应3例,3~4级4例。与上述研究结果不尽一致,说明达沙替尼治疗初发性CML仍有一定比例的非血液学不良反应和血液学不良反应发生,但其确切的不良反应情况仍需进一步研究。此外,本研究还发现,达沙替尼组患者常见的非血液学和血液学不良反应与伊马替尼患者相似,但达沙替尼组患者非血液学和血液学不良反应的程度、发生率均显著低于伊马替尼组,提示达沙替尼治疗初发性CML不良反应轻于伊马替尼,是一种相对安全治疗初发性CML的方法。
由于达沙替尼在我国应用于临床的时间较短,有关达沙替尼治疗初发性CML的长期疗效和安全性仍有待于进一步随访研究。此外,如何降低达沙替尼治疗初发性CML的血液学和非血液学不良反应也是一个亟待解决的问题。
综上所述,达沙替尼治疗初发性CML疗效显著,具有较好的安全性和耐受性,是治疗初发性CML较理想的选择。
[1] 燕玮,杨威.达沙替尼应用于伊马替尼耐药的慢性粒细胞白血病的研究进展[J].实用药物与临床,2012,15(2): 108-110.
[2] 王娅婕,邬国和.达沙替尼的临床研究进展[J].南昌大学学报(医学版),2010,50(4): 132-134.
[3] 郭敏,席亚明,晁荣,等.达沙替尼不同治疗方案治疗慢性髓细胞白血病疗效的Meta分析[J].中国循证医学杂志,2012,12(7): 785-790.
[4] 江浩,黄晓军.慢性髓性白血病临床诊疗指南与中国实践[J].中国实用内科杂志,2010,30(1): 32-34.
[5] 肖志坚.国际多中心伊马替尼治疗慢性髓性白血病随机研究8年随访进展[J].中国新药杂志,2010,19(17): 1556-1558.
[6] Aguilera DG, Tsimberidou AM. Dasainib in chronic myeloid leukemia: a review[J]. Ther Clin Risk Manag, 2009,5(6):281-289.
[7] 周励,王建祥,黄晓军,等.达沙替尼与伊马替尼治疗初发慢性髓性白血病的疗效和安全性初步比较[J].中华血液病杂志,2013,34(2):93-97.
[8] Kantarjian H, Shah NP, Hochaus A, et al. Chronic myeloid leukemia: an update of concepts and management recommendations of European leukemianet[J]. N Engl J Med, 2010, 362(6): 2260-2270.
[9] Kim D, Goh YT, Hsiao HH, et al. Clinical profile of daseatinib in Asian and non Asian patients with chronic myeloid leukemia[J]. Int J Hematol, 2009, 89(5): 664-672.