水酶法提取橡胶籽油的工艺研究
祖亭月 何美莹 张连富
(江南大学食品学院1,无锡 214122)
(云南省热带作物科学研究所2,景洪 666100)
橡胶籽(Rubber seed)是橡胶种植业的副产品,种仁含油率高达50%,且橡胶籽油中不饱和脂肪酸含量很高,因此橡胶籽是一种优质的油料资源。我国现有橡胶种植面积约49.3万 hm2,主要分布在海南和云南两省。据估计,我国橡胶籽年产量可达80万吨,预计可生产橡胶籽油35万吨[1]。橡胶籽油有着悠久的食用历史,我国对橡胶籽油的利用始于20世纪50年代后期,当时国内生活资料十分匮乏,食用油更是短缺。植胶农场就开始了用橡胶子油作为食用油的利用实践。与此同时,华南热带作物研究院、云南省热带作物科学研究所、昆明医学院、海南医学院等科研院所也加快了对橡胶种子油的成分、安全性、功能性等方面的研究,取得了60余项成果(含论文成果)。研究结果表明,精炼的橡胶籽油不但可以食用,还可以降低血脂胆固醇,对治疗和预防动脉硬化及心血管系统疾病有明显的疗效[2-3]。
水酶法提油工艺是一种新兴的提油方法,它通过机械和酶解来降解植物的细胞壁,使细胞中的油脂释放出来[4]。水酶法提油与传统工艺相比,有如下优点:能够保证较高的游离油得率,得到无有机溶剂残留的可以直接食用的油;处理条件温和,所提取的油纯度高,色泽浅,酸值及过氧化值低;蛋白质变性程度小,有利于残渣中蛋白质的综合利用;与溶剂浸提法相比,水酶法提油所产生的废水BOD和COD下降30% ~40%,有利于环境保护和油脂工业的可持续发展[5]。目前,水酶法已广泛应用于芝麻油、大豆油、玉米胚芽油、花生油等的提取[6-9],但是未见在橡胶籽油提取方面的利用。鉴于橡胶籽油的高产量,研究水酶法在橡胶籽油提取方面的应用是很有价值的。
1 材料与方法
1.1 材料与试剂
橡胶种子:云南热带作物研究所提供;柠檬酸、磷酸氢二钠(分析纯):国药集团化学试剂公司;果胶酶、水解蛋白酶、多聚半乳糖醛酸酶、纤维素酶、中性蛋白酶、复合植物水解酶、β-葡聚糖酶:诺维信公司;山梨醇单月桂酸酯(司盘-20)、聚氧乙烯山梨糖醇酐单硬脂酸酯(吐温-60)(分析纯):国药集团化学试剂公司。
1.2 仪器与设备
SXJQ-1型数显直流无极调速搅拌器:郑州长城科工贸有限公司;控温水浴锅:江苏省金坛市荣华仪器制造有限公司;DELTA 320 pH计:梅特勒-托利多仪器(上海)有限公司;EBA20离心机:德国Hettich公司;600克摇摆式高速中药粉碎机:温岭市林大机械有限公司;GC-2010气象色谱仪:日本岛津公司。
1.3 试验方法
1.3.1 橡胶籽基本成分的测定
水分测定:GB/T 5009.3—2003直接干燥法;粗蛋白测定:GB/T 5009.5—2003凯式定氮法;粗脂肪测定:GB/T 5512—2008索氏提取法;粗纤维含量的测定:GB/T 5009.10—2003酸性洗涤法;灰分含量的测定:GB/T 2009.4—2003重量法;氰化物测定:GB/T 5009.36—2003粮食卫生标准的分析方法。
1.3.2 橡胶籽油提取工艺流程和提取率计算公式


式中:A为游离油Ⅰ的质量/g;B为橡胶籽的质量/g;ω为橡胶籽中油的质量分数/%;C为游离油Ⅱ的质量/g。
1.3.3 橡胶籽的破碎
采用中药粉碎机在25 000 r/min的转速下对橡胶籽进行破碎,每次破碎时间为4 s,分别破碎1~5次,得到不同粒径分布的橡胶籽粉末。根据游离油Ⅰ得率和总游离油得率考察不同粒径对游离油得率的影响。
1.3.4 酶制剂与酶解工艺参数的研究
取50 g破碎后的橡胶籽,依照1.3.2工艺,加入原料4倍的缓冲液,调节适宜的pH和温度,加入料液总质量0.5%的酶,酶解反应4 h,80℃灭酶10 min,5 000 r/min离心30 min,分别计算游离油Ⅰ得率和总游离油得率,根据提取率筛选出最佳酶制剂。由于使用单一酶的酶解效果往往较差,因此考虑将两种酶复配使用,以提高清油的得率,方法同上,筛选出最佳组合。
在确定复合酶的种类后,研究固液比、酶解pH、酶解温度、酶解时间、酶的添加量对清油提取率和总油提取率的影响,分析不同条件对橡胶籽油水酶法提油的影响,试验重复1次。最后做4因素3水平正交试验,确定最佳的酶解工艺参数。
1.3.5 破乳方法
将乳状液在沸水浴中加热10 min,用离心机在6 000 r/min下离心15 min,得到破乳油,即游离油Ⅱ。
1.3.6 橡胶籽油的质量评定
1.3.6.1 油脂脂肪酸组成的分析
将压榨法和水酶法提取出的橡胶籽油经甲酯化后用岛津GC-2010色谱仪分析。
检测器:氢火焰离子化检测器;分析柱:PEG-20M交联石英毛细管柱20 m×0.25 mm;柱温:200℃;载气:N2。
1.3.6.2 油脂常规指标的测定
透明度、气味、滋味检验:GB/T 5525—2008;色泽检验:GB/T 22460—2008;水分及挥发物检验:GB/T 5528—1995;不溶性杂质检验:GB/T 15688—2008;酸值检验:GB/T 5530—1998;过氧化值检验:GB/T 5538—2005;氰化物检验:GB/T 5009.36—2003粮食卫生标准的分析方法。
2 结果与分析
2.1 橡胶种子成分分析
测得的脱壳橡胶籽主要成分及组成见表1。

表1 橡胶籽主要成分及组成
由表1可知,橡胶籽的粗脂肪和粗蛋白含量都很高,具有很高的利用价值。水分含量各文献报道不一[10],与贮藏时间和干燥程度有关。
2.2 破碎次数对得率的影响
将原料进行适当的破碎,有助于细胞中油滴的释放[11],增加游离油得率。从图1可以较直观的看出,破碎程度较高的细胞,油脂释放较容易。根据文献报道[12],破碎有干法破碎和湿法破碎,但是由于湿法破碎容易产生乳状液,降低提取率,故本试验只采用干法破碎。不同破碎次数下游离油Ⅰ和总游离油得率的结果见图2。
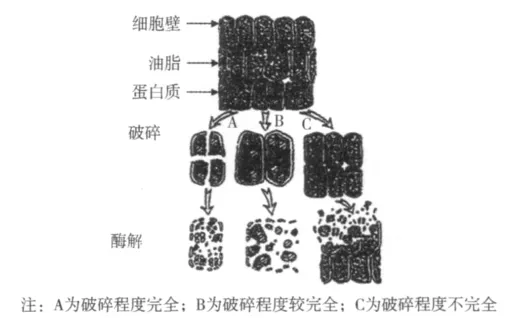
图1 不同破碎程度对油脂释放的影响

图2 不同破碎次数对游离油得率的影响
从图2可以看出,随着粒径的减小,游离油得率增大。但是在粒径较大时,形成的乳状液较少,随着粒径的减小,形成的乳状液增多,这是因为溶出了更多的蛋白质,与油发生了乳化。因此选择破碎3次得到的橡胶籽粉末进行后续试验。
2.3 酶制剂对得率的影响
2.3.1 单一酶制剂对得率的影响
水酶法是用酶水解油料细胞的细胞壁、脂蛋白或脂多糖,使其中包裹的油释放出来,以提高得油率。橡胶籽仁细胞壁的主要成分是纤维素、半纤维素和果胶质,故选取可以水解这些物质的酶进行试验。本试验主要选取了果胶酶、水解蛋白酶、多聚半乳糖醛酸酶、纤维素酶、中性蛋白酶、复合植物水解酶、β-葡聚糖酶,用以上酶分别处理后,以游离油Ⅰ提取率为指标对不同酶制剂的作用效果进行比较,结果见图3。

图3 单一酶制剂对游离油得率的影响
由图3可以看出,在无酶的条件下,游离油Ⅰ得率仅为22.6%,总游离油得率也仅为25.8%。单独使用其他酶,得率有所提高,但是总体水平不高。这是因为每一种酶有其酶解的专一性,单独使用效果有限,故考虑将酶复配使用,以提高提油率。
2.3.2 复配酶制剂对得率的影响
将两种不同的酶复配后进行酶解,以得率为指标,对酶解效果进行比较,结果见图4。
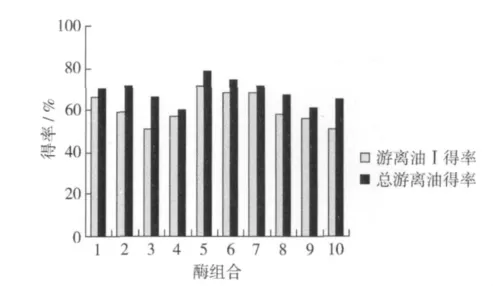
图4 复配酶制剂对游离油得率的影响
由图4可以看出,将酶制剂复配可以显著提高得率。这是因为细胞壁的组成成分主要是纤维素和多糖类物质,若只用单一酶处理很难将其分解完全。其中,酶组合5得油率最高,且乳状液形成量较少,故选取这一组合为复配酶制剂组合。
试验还尝试了将3种酶复配进行比较,但是得油率未有明显提高,考虑到生产成本,故选用纤维素酶与β-葡聚糖酶作为复合酶制剂。
2.4 酶解条件对得率的影响
2.4.1 固液比对游离油得率的影响
固定反应条件为pH 4.5,酶解温度50℃,酶解时间4 h,加酶量为0.5%(每种酶单独的添加量),研究不同固液比对游离油得率的影响,结果见图5。

图5 固液比对游离油得率的影响
由图5可以看出,开始时随液体比例的增加,游离油的得率也随之增加,至1∶4时达到最大值,随后液体再增加,油得率逐渐降低。固液比较低时,乳状液形成量较少,随着固液比增大,由于蛋白质溶出量增多,乳状液的量也增大。故选取固液比为1∶4,此时游离油得率较高,且乳状液生成量适中。
2.4.2 pH对游离油得率的影响
pH影响着酶的活性,也影响着蛋白质的溶解度。为得到较多的澄清油,尽量防止乳化的发生,有必要对不同pH的作用效果进行比较,结果见图4。其他酶解条件为温度50℃,固液比1∶4,酶解时间4 h,酶添加量为 0.5%。

图6 不同pH对游离油得率的影响
由图6可以看出,pH较低时游离油得率较低,随着pH的升高,游离油得率随之升高,至pH 5.0时达到最大,游离油得率为72.3%。还可以看出,在较低pH时,乳状液生成量较低,随pH升高,乳状液的生成量也升高,从而导致游离油得率降低。因为pH影响着蛋白质的等电点,在pH较高时,有较多的蛋白质溶解在油中,起到了表面活性剂的作用,导致较多的乳状液形成。从图6可以看出,在pH 5.0时,游离油得率最高,且乳状液生成量较低,故选取pH 5.0为最佳反应pH。
2.4.3 酶解温度对游离油得率的影响
酶解温度对于酶的活性影响很大,通常温度高时酶活性较大。纤维素酶与β-葡聚糖酶的最适温度为40~60℃。不同温度下酶解效果见图5。其他条件为:固液比1∶4,pH 5.0,酶解时间4 h,酶添加量为0.5%。
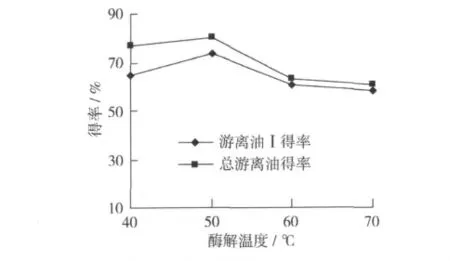
图7 温度对游离油得率的影响
由图7可以看出,游离油得率随温度升高而增大,50℃时达最大,得率为73.5%。之后温度继续升高,游离油得率下降加速,原因是温度过高,加速了酶的失活,从而减弱了酶解作用,导致游离油得率下降。乳状液的生成随温度升高而降低,这是因为高温降低了乳状液的稳定性,有助于破乳。但为了得到较高的游离油得率,选取最适酶解温度为50℃。
2.4.4 酶解时间对游离油得率的影响
酶与底物接触的时间越长,酶解得越彻底,故研究酶解时间对游离油得率的影响。其他反应条件为:固液比 1∶4,pH 5.0,温度 50 ℃,酶添加量为0.5%。结果见图 8。

图8 酶解时间对游离油得率的影响
由图8可以看出,随着酶解时间的延长,提油率缓慢增长,但是超过12 h后,游离油得率都开始下降,原因可能是油与蛋白质接触时间过长,产生了稳定的乳状液,破乳也比较困难。还可以看出,在酶解时间为8、10、12 h时,游离油得率几乎没有变化,考虑到生产成本,选择酶解时间为8 h较适合。
2.4.5 酶添加量对游离油得率的影响
选取不同的酶添加量,考察其对游离油得率的影响。其他反应条件为:固液比1∶4,反应时间4 h,反应温度50℃,pH 5.0。结果见图9。
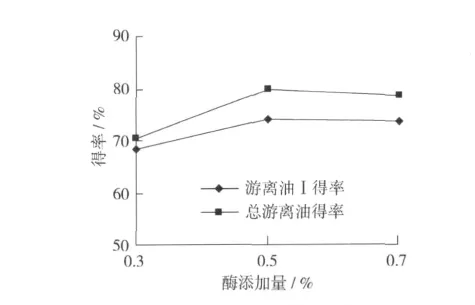
图9 不同酶添加量对游离油得率的影响
由图9可以看出,游离油得率随酶添加量的增加而略有增加,当酶添加量增加到0.7%时,游离油得率反而降低。这可能是由于随着酶添加量的增加,油释放的速度加快,乳状液形成速度随之增加,导致游离油得率降低。同时,酶添加量增加,容易形成稳定的乳状液,导致破乳困难,使总游离油得率也略有下降。
2.4.6 酶解工艺的优化
选取固液比,酶解时间,酶添加量,酶解温度进行四因素三水平正交试验,按L9(34)设计正交表,以总游离油得率为指标,正交试验的因素水平见表2。
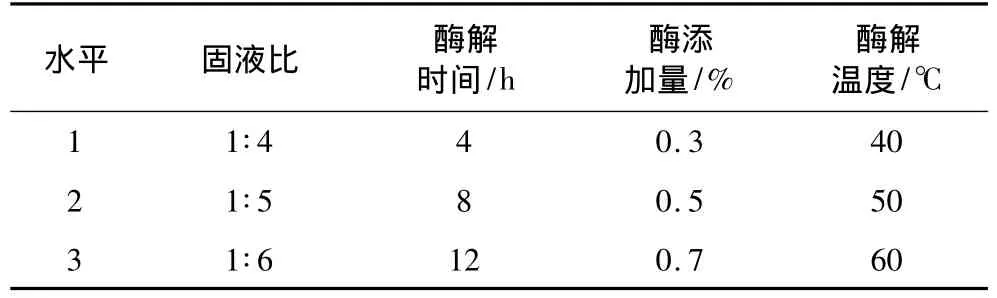
表2 正交试验因素水平表
按照L9(34)设计,以总游离油得率为指标进行正交试验,结果见表3。
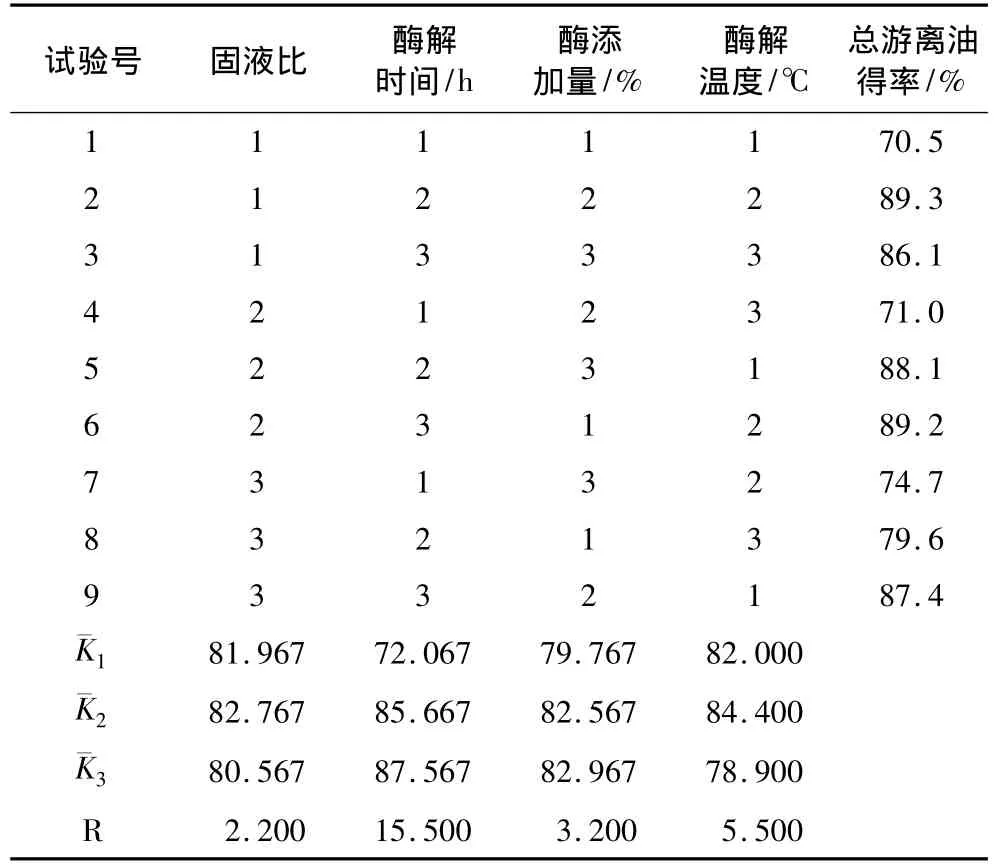
表3 正交试验结果表
对上述结果进行方差分析,结果见表4。

表4 方差分析表
极差分析和方差分析结果表明,影响总游离油得率因素的顺序为酶解时间>酶解温度>酶添加量>固液比,其中,酶解时间对结果影响显著,最佳反应组合为A1B2C3D2。但是组合A1B2C2D2与最佳组合相比,相差不大,但是反应条件比最佳组合低,考虑到生产成本,故选取组合A1B2C2D2代替最佳组合。即酶解工艺确定为固液比1∶4,酶解时间8 h,酶添加量0.5%,酶解温度50℃。
3 橡胶籽油质量评定
3.1 橡胶籽油的脂肪酸组成
将水酶法提取的橡胶籽油处理后,测定其脂肪酸组成,结果见图10a。同样方法分析压榨橡胶籽油的脂肪酸组成,结果见图10b。

图10 不同方法提取的橡胶籽油的脂肪酸气相色谱图
将图10的峰经归一化处理后得到的橡胶籽油主要脂肪酸组成见表5。可以看出,橡胶籽油不饱和脂肪酸质量分数很高,达到了84.5%,因此橡胶籽油是一种具有很好的保健作用的新的食用油。水酶法提取油与压榨法提取油的脂肪酸组成无明显差别,说明水酶法工艺对于油的品质没有破坏,进一步说明了水酶法提取橡胶籽油工艺是可行的。

表5 橡胶籽油的主要脂肪酸组成
3.2 橡胶籽油的理化指标
由于橡胶籽油是一种新型食用油,目前还没有国标来评定其等级。将橡胶籽与几种常见的油料原料进行比较,橡胶籽与葵花籽组成最为接近,故选用葵花籽油的国家标准作为橡胶籽油质量评定的依据,结果见表6。
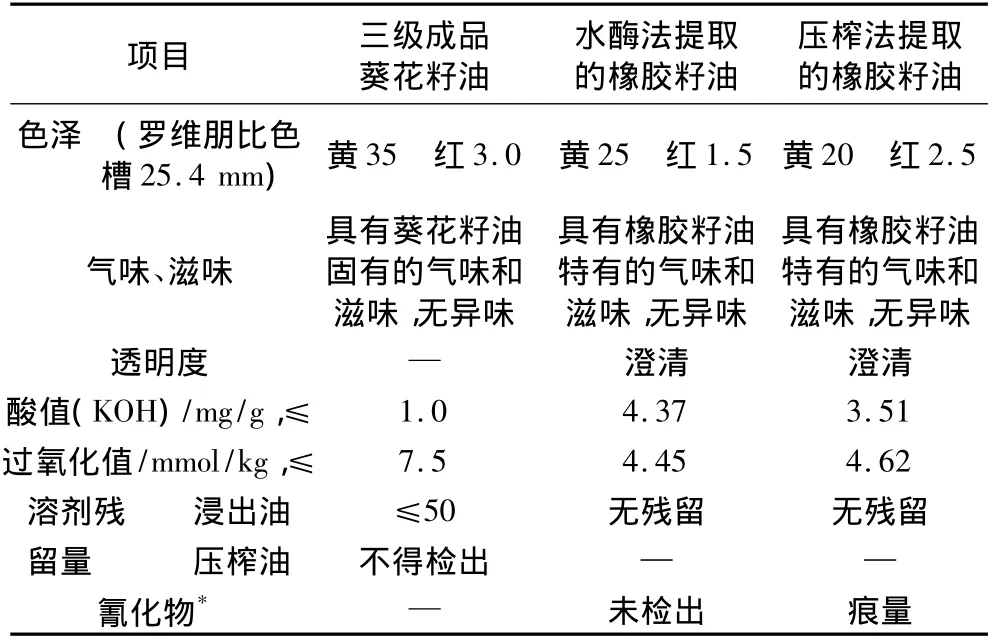
表6 橡胶籽油质量评定
将水酶法和压榨法得到的橡胶籽油分别进行了氰化物的定性检测,水酶法提取的橡胶籽油未检出氰化物,但是压榨法提取的橡胶籽油检出了氰化物。因此,采用水酶法提取的橡胶籽油无需进一步进行氰化物的脱除,从而简化了制取工艺。
由表6可以看出,用水酶法得到的橡胶籽油除酸值偏高外,其余均符合国家标准。酸值偏高的原因一方面是因为原料贮存较久,另一方面是因为水酶法提取工艺是在较低的pH下进行的,pH约为5.0,导致游离油的酸值偏高。而且,H+可以作为油脂水解的催化剂,促使油脂发生水解反应,游离脂肪酸增加,酸值也会随之增高。
水酶法提取的橡胶籽油,只需进行脱酸得到符合标准的成品油,比起压榨法提取工艺需要脱胶、脱酸、脱腊、脱水、脱臭、脱色等精炼步骤而简化了许多,从而使生产效率得到了提高,并且减少了污染。
4 结论
本试验通过单因素和正交试验优化了工艺参数,确定了水酶法的最佳提取工艺为固液比1∶4,酶解时间8 h,酶添加量0.5%,酶解温度50℃,pH 5.0。在5 000 r/min下离心 30 min,然后对乳状液进行加热破乳,破乳条件为沸水浴10 min,6 000 r/min下离心10 min。最后总游离油得率可达到89.3%。
采用水酶法提取的橡胶籽油,品质较好,后续所需精炼步骤简单,节约了精炼步骤所需的成本。提取率高于压榨法的提取率(约66%),并且,水酶法的反应条件温和,蛋白质变性小,可对残渣中的蛋白质进行回收,有利于原料的综合利用。
[1]胡小泓,刘大川,张新才.橡胶籽油的制取及精炼工艺研究[J].中国油脂,2005,30(11):65 -67
[2]潘善甫,郑联合.食用橡胶籽油的开发利用研究[J].中国油脂,2000,25(6):114 -115
[3]何美莹,李国华,李海泉.关于云南橡胶种子油食用开发现状与思考[J].热带农业科技,2010,33(4):36-42
[4]Dominguez H,Nunes M J,Lema J M Enzymatic pretreatment to enhance oil extraction from fruits and oilseeds:a review[J].Food Chemistry,1994,49:271 -286
[5]谭春兰,袁永俊.水酶法在植物油脂提取中的应用[J].食品研究与开发,2006,27(7):128 -130
[6]Latif S,Anwar F.Aqueous enzymatic sesame oil and protein extraction[J].Food Chemistry,2011,125:679 -684
[7]Rosenthal A,Pyle D L.Combined effect of operational variables and enzyme activity on aqueous enzymatic extraction of oil and protein from soybean[J].Enzyme and Microbial Technology,2008,28:499 -509
[8]王素梅,王璋,单晓红.玉米胚水酶法提油工艺机理探索[J].西部粮油科技,2003(6):19 -21
[9]华娣,许时婴,王璋,等.酶法提取花生油与花生水解蛋白的研究[J].科研开发,2006,22(6):16 -19
[10]刘石生,梁振益,陈香英.响应面法优化橡胶籽油的溶剂法提取工艺[J].中国油脂,2010,35(2):14 -17
[11]Rosenthal A,Pyle D L,Niranjan K.Aqueous and enzymatic process for edible oil extraction [J].Enzyme and Microbial Technology,1996,19:402 -420
[12]刘倩茹,赵光远,王瑛瑶,等.水酶法提取油茶籽油的工艺研究[J].中国粮油学报,2011,26(8):36 -40.

